Parodontologie 21.02.2011
Parodontitis und Periimplantitis - ein Blick hinter die Kulissen
Parodontitis und Periimplantitis sind die Folge einer gestörten Wechselbeziehung zwischen der natürlichen Keimbesiedlung im Mund und dem Immunsystem. Während sogenannte parodontopathogene Bakterien die Hauptursache von Parodontitis und Periimplantitis sind, ist es letztlich das körpereigene Immunsystem, das für die Entstehung parodontaler Erkrankungen verantwortlich ist.
Die Immunantwort ist von Mensch zu Mensch unterschiedlich und erblich vorbestimmt. Warum Veränderungen in den Interleukin-1-kodierenden Genen in diesem Zusammenhang eine wichtige Rolle spielen, erklärt der nachfolgende Artikel. Es wird aufgezeigt, wie das Zusammentreffen schädlicher Bakterien und erblicher Vorbelastung des Patienten sowie weiterer Faktoren (z.B. Stress, Rauchen und prädisponierende Krankheiten) zu parodontalen Erkrankungen führen können.
Interleukin-1: Ein wichtiger Mitspieler im Immunsystem
Die Parodontitis ist bekanntlich eine Entzündung der Gingiva und des Zahnhalteapparates. Und wie bei allen Entzündungen im Körper reagiert das Immunsystem zunächst mit der Bildung von Entzündungs-Mediatoren. Dies führt unter anderem zu einer Erweiterung der Blutgefäße, wodurch die Immunzellen schneller an den Entzündungsort gelangen und die Entzündung vor Ort bekämpfen können. Die Immunzellen „fressen“ die schädlichen Keime und produzieren Entzündungs-Mediatoren, um weitere Immunzellen anzulocken, die bei deren Bekämpfung helfen sollen. Zu den wichtigsten Entzündungs-Mediatoren oder Zytokinen gehören das Interleukin-1a (IL-1a) und Interleukin-1b (IL-1b). Als wichtiger Botenstoff ist IL-1 an der Zerstörung von bakteriellen Erregern oder defekten sowie entarteten Zellen beteiligt. Auch beim Knochenauf- oder -umbau spielt IL-1 eine wichtige Rolle. Einerseits wirkt es bei der Differenzierung von Vorläuferzellen zu Osteoklasten, also Knochengrundsubstanz abbauende Zellen, mit. Und andererseits hemmt es die sogenannten Osteoblasten oder Knochenbildungszellen.
Der Wirkmechanismus von IL-1 ist in Abbildung 1 dargestellt: Bei Vorhandensein von parodontopathogenen Bakterien bindet IL-1 an seinen Rezeptor auf der Oberfläche der Zielzelle. Diese IL-1-Rezeptor-Bindung bewirkt die Weiterleitung des Entzündungssignals und somit die Initiierung weiterer Immunabwehrreaktionen. Der Gegenspieler von IL-1 ist der IL-1-Rezeptor Antagonist (IL-1RN). Er bindet an denselben Rezeptor wie IL-1, blockiert diesen jedoch. Sind also die Infektionsauslöser bekämpft und demnach keine weitere Aktivierung mehr nötig, bindet der IL-1-RN an den IL-1-Rezeptor und das Signal ist beendet (Abb.1).
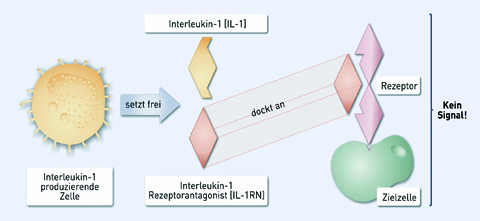
Abb. 1: IL-1-Wirkmechanismus auf zellulärer Ebene.
„Das liegt wohl in der Familie!“
In Zwillingsstudien konnte gezeigt werden, dass erbliche Anlagen einen wesentlichen Einfluss auf den Verlauf einer Parodontitis haben (Michalowicz et al., 1991). Des Weiteren konnte in Sulkusflüssigkeit und Weichgewebe von PA-Patienten im Unterschied zu gesunden Personen eine erhöhte Menge von IL-1b nachgewiesen werden (Pociot et al., 1992). In experimentellen Studien verhinderte die Gabe des IL-1-Rezeptor-Antagonisten weiteren Knochenabbau (Assuma et al., 1998). Die genetische Information für die Interleukine IL-1a, IL-b und IL-1rn sind auf den Genen IL-1A, IL-1B und IL-1-RN hinterlegt. Diese Gene befinden sich beim Menschen auf dem Chromosom 2. Ende der 90er-Jahre konnte ein US-amerikanisches Forscherteam den genetischen Zusammenhang der obigen Beobachtungen aufklären (Kornman et al., 1997). Sie fanden heraus, dass Patienten mit bestimmten Veränderungen oder sogenannten Polymorphismen in den Genen IL-1A und IL-1B auf einen starken Entzündungsreiz (z.B. parodontopathogene Bakterien) mit einer überschießenden Produktion von IL-1 reagierten. Die Folge ist eine Verschiebung des Gleichgewichtes in Richtung Knochenabbau sowie einer allgemein erhöhten, erblich bedingte Entzündungsneigung. Heute weiß man, dass in Europa etwa ein Drittel der Bevölkerung Träger dieser veränderten IL-1-Gene ist (Kornman et al., 1997) und damit ein erhöhtes Risiko für parodontale Erkrankungen aufweist. Eine Veränderung in den Strukturgenen IL-1A und IL-1B führt also zu einer Überproduktion des Zytokins IL-1. Entzündliche Prozesse werden somit angeregt und der Knochenabbau vorangetrieben (Abb. 2a).

Abb. 2a: Mechanismus bei Veränderung in den Strukturgenen IL-1A und IL-1B.

Abb. 2b: Mechanismus bei Veränderung des IL-1-Rezeptor Antagonisten.

Abb. 2c: Mechanismus für eine stark erhöhte Entzündungsneigung.
Liegt eine Veränderung im Gen des IL-1-Rezeptor Antagonisten vor, kann die Bindung von IL-1 an den IL-1-Rezeptor nicht mehr blockiert werden. Dies führt zu einer abgeschwächten Hemmung entzündlicher Prozesse (Abb. 2b), da die Weiterleitung des Entzündungssignals nicht beendet wird. Treten diese genetischen Veränderungen, also eine Überproduktion von IL-1 durch Veränderungen in den IL-1A- und IL-1B-Genen und eine abgeschwächte Hemmung der Entzündung aufgrund der Veränderung im IL-1-RN-Gen, gleichzeitig auf, ist eine stark erhöhte Entzündungsneigung beim Patienten die Folge. Das übermäßige Vorhandensein von IL-1 kann durch die geringen IL-1-RN-Konzentrationen nicht kompensiert werden und die entzündliche Wirkung des IL-1 wird noch zusätzlich verstärkt (Abb. 2c). Solche Patienten reagieren daher äußerst empfindlich auf parodontopathogene Bakterien und andere äußere Reize. Sie haben ein erhöhtes Risiko für einen frühen Krankheitsbeginn und einen schwerwiegenden Verlauf (Laine et al., 2006). Diese Patienten benötigen daher eine besonders sorgfältige und intensive Betreuung und sollten sich in regelmäßigen Abständen in der Praxis vorstellen. Vor diesem Hintergrund wird klar, warum manche Patienten trotz geringer Keimbesiedelung und guter Mundhygiene starke Krankheitssymptome aufweisen, während andere mit verhältnismäßig hoher Bakterienlast keine oder nur wenig Beschwerden haben. Die Aussage: „Das liegt in der Familie!“ erhält eine ganz neue Bedeutung.
Eins plus eins macht vier
Die erblich bedingte IL-1-vermittelte Entzündungsneigung hat also einen großen Einfluss auf die Entwicklung und den Verlauf einer Parodontitis. Sind neben der erblichen Veranlagung noch weitere Risikofaktoren vorhanden, so verstärken sich diese in ihrer Wirkung, wirken also synergistisch. So hat ein Patient mit einer Veränderung in den IL-1-Strukturgenen ein ähnlich hohes Risiko, an einer Parodontitis zu erkranken (2,7-fach), wie ein Raucher ohne Genveränderung (2,9-fach). Hat ein Raucher jedoch zusätzlich eine Veränderung in den IL-1-Strukturgenen, so erhöht sich das Risiko auf das 8-fache (Abb. 3; McGuire & Nunn, 1999). Kommen noch weitere Risikofaktoren hinzu, nimmt das Erkrankungsrisiko bis zu 20-fach zu (Tab. 1; Simon & Dannewitz, 2007).
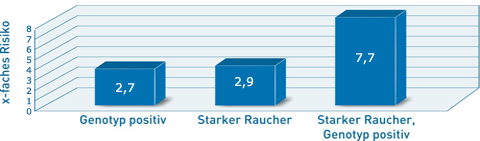
Abb. 3: Risikoverteilung für Parodontalerkrankungen in Abhängigkeit verschiedener Risikofaktoren (Genotyp-positiv = Polymorphismen in den IL-1-Strukturgenen) nach McGuire & Nunn, 1999.
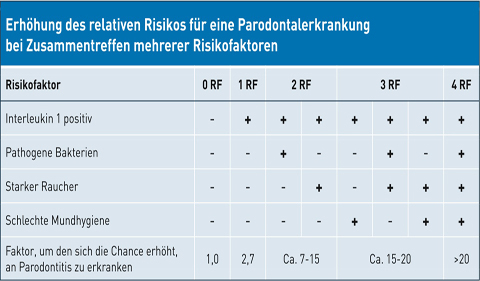
Tab. 1: Erhöhung des relativen Risikos für eine Parodontalerkrankung bei Zusammentreffen mehrerer Risikofaktoren (modifiziert nach: Simon & Dannewitz, 2007. Parodontologisches Recall, Wissen kompakt 1, 41–52.)
Werden jedoch die beeinflussbaren Risikofaktoren minimiert, können auch Patienten mit einer erblich bedingten, erhöhten Entzündungsneigung über Jahre hinweg klinisch stabil gehalten werden (McGuire & Nunn, 1999). Der Nachweis einer erblich bedingten, IL-1-vermittelten Entzündungsneigung ist nicht mit der Diagnose von parodontalen Erkrankungen gleichzustellen, sondern hilft, das individuelle Risiko eines Patienten richtig einzuschätzen. Wenn der Risikotyp bekannt ist, kann die Behandlung individuell auf den Patienten abgestimmt werden. So muss der Patient bei einer genetischen Vorbelastung besonders intensiv betreut werden. Zusätzlich sollte darauf hingewiesen werden, dass weitere Risikofaktoren, wie z.B. Rauchen, vermieden werden sollten, da diese den Krankheitsverlauf zusätzlich negativ beeinflussen. Auch ist bei den betroffenen Patienten eine Antibiotika-Therapie zur Beseitigung der parodontopathogenen Bakterien häufig zu einem früheren Zeitpunkt indiziert als bei Patienten ohne erbliche Vorbelastung. Besteht eine nachgewiesene erbliche Veranlagung für einen oder beide Elternteile, so ist es ratsam, auch die Kinder auf Veränderungen in den IL-1-Genen zu untersuchen. Nur so kann frühzeitig einer möglicherweise drohenden Erkrankung vorgebeugt werden. Auch vor kieferorthopädischen Maßnahmen ist es sehr wichtig, zu erfahren, ob mit einer veränderten Osteoblasten-Aktivität zu rechnen ist, da gerade kiefer- und zahnregulatorische Behandlungen maßgeblich durch diese Zellen getragen werden. Ein IL-1-positives Testergebnis kann beim Patienten zu der Einsicht führen, das Rauchen aufzugeben und die Mundhygiene zu verbessern. Durch die frühzeitige Kenntnis der erblichen Vorbelastung können auch entsprechende Prophylaxemaßnahmen rechtzeitig eingeleitet werden.
IL-1 und Implantatverlust
Die Versorgung mit implantatgetragenem Zahnersatz bringt einen erheblichen Planungs- und Kostenaufwand mit sich. Es gilt als gesichert, dass die gleichen Keime, die eine chronische Parodontitis verursachen, auch die Ursache für bakteriell bedingte Periimplantitis sind (Mombelli, 2002). Um eine Implantation in vorgeschädigtes Gewebe zu vermeiden und das Risiko für spätere Infektionen zu minimieren, sollte daher zunächst eine Keimanalyse durchgeführt werden. Liegt eine Belastung mit parodontopathogenen Bakterien vor, wird eine Keimreduktion vor der Implantation dringend empfohlen. Da IL-1-positive Implantatträger besonders empfindlich auf pathogene Bakterien reagieren, kann auch die Vorkenntnis über die Entzündungsneigung des Patienten den Behandlungserfolg maßgeblich beeinflussen (Agerbaeck et al., 2006).
Verschiedene wissenschaftliche Veröffentlichungen haben gezeigt, dass ein Zusammenhang zwischen dem Auftreten von IL-1-Veränderungen und einem schwerwiegenden Krankheitsverlauf bzw. dem Auftreten von Komplikationen besteht. Wenn weitere Risikofaktoren, wie z.B. Rauchen und bestimmte Keimkonstellationen, hinzukommen, wird diese Tendenz zusätzlich verstärkt (Laine
et al., 2001; Scapoli et al., 2005, Mc Guire & Nunn, 1999). Es gilt ebenfalls als gesichert, dass die Kombination aus Rauchen und Risiko-Genotyp ein deutlich höheres Risiko für Implantatkomplikationen oder Implantatverlust mit sich bringt. Es konnte gezeigt werden, dass insbesondere Raucher mit Veränderungen im IL-1-Gen ein erhöhtes Risiko für Implantatverlust aufweisen (Abb.4).
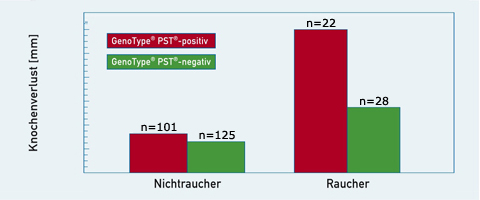
Abb. 4: Durchschnittlicher Verlust des Alveolarknochens pro Patienten in zehn Jahren bei Rauchern und Nichtrauchern mit positivem (GenoType®PST®-positiv) oder negativem (GenoType®PST®-negativ) Polymorphismus des Interleukin-1-Gens (modifiziert nach Axelsson, 2002).
Bis zu 50% der Raucher hatten Implantatkomplikationen und der Attachmentverlust im Recall war bis um das Dreifache höher (Gruica et al., 2004; Axelsson, 2002). Bei Rauchern mit Zahnverlust infolge einer Parodontitis wird die Bestimmung des IL-1-Genotyps daher dringend empfohlen. Für den Implantologen stellt die Analyse ebenfalls eine Möglichkeit dar, sich gegen Implantatversagen und mögliche Regressforderungen abzusichern.
Einfluss von IL-1 auf die Gesundheit
Nachdem der Zusammenhang zwischen IL-1-Polymorphismen und schweren Verläufen von parodontalen Erkrankungen heute weitgehend bekannt ist, werden sie zunehmend mit Allgemeinerkrankungen in Verbindung gebracht. So spielt IL-1 eine wichtige Rolle bei der Entstehung von rheumatischen Entzündungen und Gelenkschädigungen. Bei Patienten mit rheumatoider Arthritis wird IL-1 in erhöhtem Maße vom Körper produziert und reichert sich insbesondere in den entzündeten Gelenken an. Unter dem Einfluss von IL-1 beginnt die Knorpelzelle Enzyme herzustellen, welche schließlich zur Zerstörung des Knorpels führen. Durch die zusätzliche Aktivierung von Osteoklasten kommt es zum Knochenabbau. Eine Therapiemaßnahme bei Patienten mit rheumatoider Arthritis besteht z.B. in der Injektion von IL-1RN. Aktuelle Forschungsansätze gehen der Frage nach, ob die für die Parodontitis als indikativ geltenden Veränderungen in den IL-Genen auch als Risikofaktor für rheumatische Erkrankungen anzusehen sind (Bartold et al., 2005). Auch für weitere Erkrankungen, wie z.B. Multiple Sklerose, Alzheimer oder Angina Pectoris, wird ein Zusammenhang mit Veränderungen der IL-1-Gene diskutiert (Bidwell, 2006). Parodontale Entzündungen werden ebenfalls mit dem Risiko einer Früh- bzw. Fehlgeburt assoziiert, da durch die IL-1- und damit verbundene Prostaglandin-Ausschüttung vorzeitige Wehen ausgelöst werden können. Das Risiko einer Frühgeburt bzw. ein untergewichtiges Kind zu gebären ist für Frauen mit Parodontitis bis zu 7-fach erhöht (Offenbacher et al., 1996).
Praktische Konsequenzen der IL-1-Bestimmung im Praxisalltag
Das Testsystem GenoType® IL-1 der Firma Hain Lifescience erlaubt die gleichzeitige Bestimmung aller relevanten IL-1-assoziierten Genveränderungen. Die Probenentnahme erfolgt einfach, schnell und schmerzfrei durch einen Wangenabstrich in der Praxis. Der kostenlose Transport der Abstrichprobe findet auf dem Postweg statt. Das Ergebnis wird innerhalb von ca. drei Arbeitstagen je nach Wunsch per Post, E-Mail oder Fax mitgeteilt. Je nach Auftreten und Kombination der verschiedenen Genveränderungen sind vier unterschiedliche Risikotypen A bis D zu unterscheiden. Bei der Ergebnismitteilung wird mithilfe des „Ampelmännchens“ auf einen Blick ersichtlich, welchen Risikotyp der Patient hat. Das IL-1-vermittelte, genetisch bedingte Entzündungsrisiko nimmt von Risikotyp A nach D zu (Abb. 5). Patienten der Risikotypen B, C und D haben ein erhöhtes Entzündungsrisiko und benötigen daher einen intensiven Therapie- und Prophylaxeplan mit kurzen Recall-Intervallen. Nur so kann dem Verlust von natürlichen Zähnen oder Implantaten vorgebeugt werden.
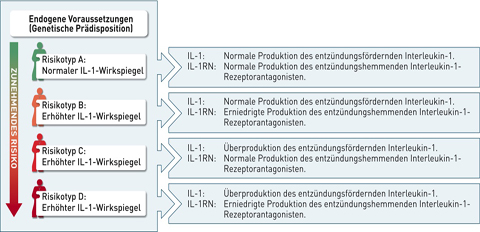
Abb. 5: Risikotypen nach GenoType-IL-1-Analyse.
Fazit
Bei der Behandlung von Parodontalerkrankungen ermöglicht die Kenntnis des IL-1-Risikotyps und weiterer Risikofaktoren sowie die Bestimmung der Keimbelastung eine fundierte Einschätzung des Krankheitsverlaufes. Diese Faktoren bilden zusammen mit den klinischen Parametern, wie z.B. Sondierungstiefe, Blutungsindex, die Grundlage für eine individuelle und effektive Therapieplanung.
Eine Literaturliste kann in der Redaktion angefordert werden.
Autor: Dr. rer. nat. Dipl.-Biol. Sylke Dombrowa
Seitenanfang







