Implantologie 13.06.2013
Mögliche Wege zum Bioengineering von Zahnkeimen
share
Bis zum Anfang der 1980er-Jahre herrschte die gängige Lehrmeinung, dass einzelne hoch spezialisierte Zellen, wie z.B. Herzmuskel- oder Nervenzellen, nach ihrem durch äußere Einflüsse bedingtem Absterben nicht mehr ersetzt werden können. Mit der Entdeckung der adulten Stammzellen und der fortschreitenden Erforschung ihres Verhaltens musste diese Ansicht jedoch weitestgehend aufgegeben werden, nachdem bekannt wurde, dass durchaus spezialisierte somatische Zellen in einem gewissen Umfang neu angelegt werden können.
Eine weitere wichtige Grundlage für künftige Möglichkeiten des Tissue Engineerings (TE) stellt die Erforschung der Gewebe- und Organregeneration bei bestimmten Tierarten dar. So ist z.B. von einigen Amphibien bekannt, dass sie beim traumatischen Verlust ihrer Extremitäten diese vollständig und ohne Narbenbildung regenerieren können. Die Säugetiere haben im Laufe der Evolution diese Fähigkeit verloren. Lediglich Hirsche sind in der Lage, jährlich ihr Geweih neu zu bilden. Aber auch die Untersuchung über die Ursache des kontinuierlichen Zahnwachstums der Frontzähne von Nagern und der als „Waffen“ bezeichneten Eckzähne der Wildschweine mögen in der Lage sein, unser Wissen auf dem Wege zum TE zu erweitern. Die Bündelung der neueren Erkenntnisse aus diesen Forschungsgebieten hat die Möglichkeiten des Tissue Engineerings erheblich erweitert.
Für die zahnmedizinische Forschung drängt sich daher die Frage auf, ob die Regeneration echter Zähne der „3. Generation“ eine zukünfte Alternative zu der Insertion von Implantaten darstellen könnte. Im Folgenden soll daher ein kurzer Überblick über die Stammzellforschung, ihre Möglichkeiten und gegenwärtige Grenzen im Hinblick auf die „Dritten“ gegeben werden. Aufgrund der vorgegebenen Länge dieses Beitrags sind dabei komplexe molekularbiologische Zusammenhänge zum besseren Verständnis stark vereinfacht und nicht erschöpfend dargestellt worden.
Einige Grundlagen
In jedem Organismus sterben ständig Zellen durch Verletzungen, Blutungen oder aufgrund des programmierten Zelltodes, der Apotose, oder aus vielen anderen Gründen ab. Diese müssen ersetzt werden. Erwachsene Menschen produzieren daher in jeder Sekunde ca. 50 Millionen neue Zellen. Die Basis dieser Erneuerung bilden die adulten Stammzellen des erwachsenen Individuums, da vollständig ausdifferenzierte Zellen nicht mehr oder nur in sehr geringem Maße zur Zellteilung befähigt sind (Abb. 1).
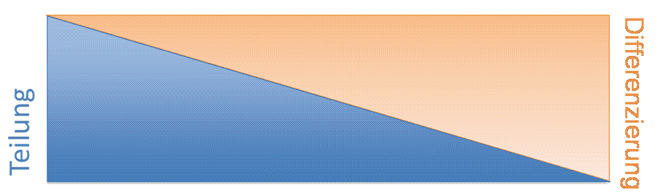
Abb. 1: Schaubild des Proliferations- und Differenzierungsverhaltens von Zellen. Proliferation und Differenzierung zeigen gegenläufiges Verhalten. Nur nicht oder wenig differenzierte Zellen können sich schnell teilen.
Stammzellen (SZ) sind daher undifferenzierte Zellen, die keinem endgültigen Zelltyp angehören. Nach der heutigen Auffassung müssen Stammzellen definitorisch zwei Funktionen erfüllen. Sie müssen sich selbst durch unbegrenzte Zellteilung erneuern und Tochterzellen hervorbringen können, die dann zu bestimmten Zelltypen differenzieren. Es werden embryonale von adulten Stammzellen unterschieden. Das Differenzierungsverhalten der Tochterzellen wird mit verschiedenen Termini ihrer Potenz beschrieben. Das größte Differenzierungspotenzial haben die embryonalen Stammzellen. Hier werden zwei unterschiedliche Stammzelltypen unterschieden. Die Nachfolgezellen der befruchteten Eizelle bis zum Achtzellenstadium werden als totipotent bezeichnet, da sich aus ihnen nicht nur alle Zelltypen des Embryos, sondern auch die Zellen der Plazenta und der Nabelschnur ableiten. Aus jeder dieser Zellen kann ein vollständiger Embryo generiert werden. Die eigentlichen embryonalen Stammzellen liegen im Inneren der Keimblase. Da ihr Differenzierungsverhalten bereits eingeschränkt ist, werden sie pluripotent genannt. Sie können aber alle Zellen aller Keimblätter, also die des Ekto-, Ento- und Mesoderms, bilden. Die multipotenten Stammzellen können alle Zelltypen eines Keimblattes hervorbringen. Beispielsweise können mesenchymale Stammzellen Knochen-, Knorpel-, Muskel- und Fettzellen bilden. Unipotente SZ können nur einen Zelltyp hervorbringen.
Wege und Methoden zum Tissue Engineering des Zahnes
Für das Bioengineering eines Zahnkeimes müssen Kenntnisse über den Ablauf der Zahnentwicklung, der Beteiligung welcher Keimblätter, welcher Stammzellen, der Aktivierung welcher Gene in welcher Reihenfolge und in welchem Milieu diese Prozesse ablaufen, bekannt sein. Wir wissen bereits, dass sich die Zähne aus dem Zusammenspiel von Ektoderm und Mesenchym aus der Zahnleiste, einer bogenförmigen ektodermalen Epithelverdickung unter dem embryonalen Mundhöhlenepithel, bilden. Ferner sind die Zielzellen bekannt, die den Zahn aufbauen. Die Ameloblasten bilden den Schmelz, die Odontoblasten das Dentin und die Zementoblasten den Zement. Die Pulpa besteht aus mesenchym-ähnlichem Bindegewebe und enthält Fibrozyten, Endothelzellen und Nervenzellen. Gefunden werden müssen dazu allerdings noch die zugehörigen Stammzellen und der Bauplan mithilfe der dazu notwendigen Erkenntnisse auf zellulärer und molekularer Ebene. Einige grundlegende Methoden sollen in den folgenden Abschnitten kurz erwähnt werden.
Bestimmung und Isolierung von Stammzellen
Die Isolierung und Bestimmung von Stammzellen aus zu untersuchenden Gewebetypen wird üblicherweise durch Anzüchtung der Gewebezellen in Zellkulturen vorgenommen (Abb. 2). Diese Zellkulturen beherbergen viele verschiedene Zelltypen und sind Mischkulturen. Anschließend können die verschiedenen Zelltypen gezählt und separiert werden, um herauszufinden, welche und wie viele Zellen einer zu bestimmenden Stammzelllinie in der Kultur vorhanden sind. Die Zellseparierung wird mit der Durchflusszytometrie vorgenommen. Hier gibt es zwei verschiedene Möglichkeiten. Die gängigste Methode stellt die fluoreszenzaktivierte Analyse dar, die sogenannte FACS Methode (FACS = Fluorescence Activated Cell Sorting). Stammzellen weisen an ihren Oberflächen stammzellspezifische Rezeptoren oder andere Oberflächenproteine auf, mit deren Hilfe sie charakterisiert werden können. Wird nun ein an diesen Rezeptor bindender Antikörper mit einem Fluoreszenzfarbstoff gekoppelt, so markiert es die Zelle farblich. Sie kann dann mithilfe des FACS-Gerätes aussortiert werden. Die Sortierung kann auch auf magnetischem Wege (MACS) erfolgen, wenn statt des Fluoreszenzfarbstoffes ein magnetisches Partikelchen an den Antikörper gekoppelt wird. Im Rahmen einer in unserer Abteilung durchgeführten Dissertation (A. M. Gümmer, 2011) ließen sich in der Pulpa von Zahnkeimen ektodermale und mesenchymale Stammzellen nachweisen. In Abbildung 3 sind mesenchymale Stammzellen dargestellt, die mit dem Stro-1-Antikörper und einem grün fluoreszierenden Farbstoff markiert wurden.
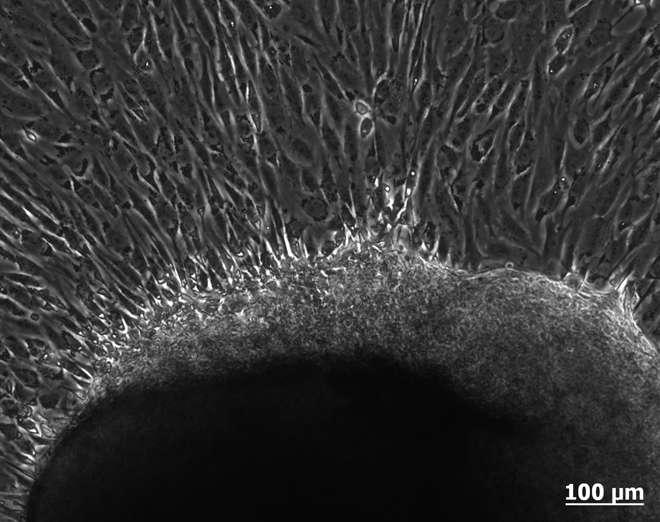
Abb. 2: Gewebeteilchen, aus dem Zellen für eine Zellkultur auswachsen.
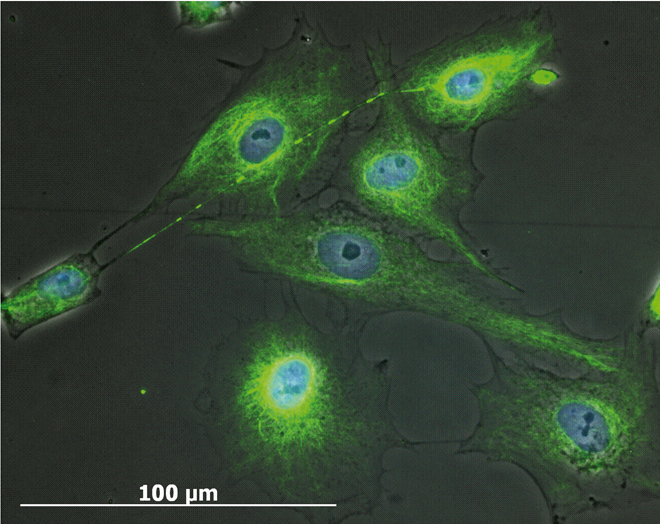
Abb. 3: Stro-1-positive mesenchymale Stammzellen nach einer Zellsortierung. Die Zellen sind mit einem grün fluoreszierenden Farbstoff und die Kerne mit einem blauen Farbstoff markiert. Im oberen Anteil des Bildes ist eine Zellverbindung der oberen rechten Zelle mit einer an der linken Bildrandmitte gelegenen Zelle zu sehen. Gut sichtbar sind die kleinen Gondolae, in denen die kommunizierenden Zellen Stoffe austauschen.
Die Genexpression und Nachweis der Multipotenz
Die Genaktivität in Zellen so auch in Stammzellen kann mithilfe der PCR-Methode sowohl qualitativ als auch quantitativ gemessen werden. Die gängige Methode dafür ist die RT-PCR (real time-PCR). Mit dieser Methode lässt sich auch über bestimmte Zwischenschritte die Expression der mRNA nachweisen und somit darstellen, welche Proteine die Zelle gerade produziert. Allerdings muss dabei berücksichtigt werden, dass die Höhe der mRNA Expression nicht immer und unbedingt mit der Höhe der Proteinsynthese gleichzusetzen ist.
Um nachzuweisen, ob die nach FACS isolierten Stammzellen auch multipotent sind, werden sie nun in verschiedenen Kulturmedien erneut angezüchtet. In einem osteogenen Medium müssten dann die Tochterzellen in Richtung Knochenzellen, also Osteoblasten, differenzieren.
Reife Osteoblasten exprimieren die mRNA des Knochenzellenmarkers Osteokalcin und synthetisieren auch das Protein Osteokalcin. Die mRNA lässt sich dann mit der RT-PCR und das Protein mit einem ELISA-Test quantitativ nachweisen. In einem adipogenen Medium können Stro-1-positive mesenchymale Stammzellen Fettzellen generieren. Hier ließe sich dann z.B. der Fettzellenmarker PPAg nachweisen. Werden die Fettzellen ähnlich wie Gewebeschnitte fixiert, können sie auch mit einer histologischen Färbemethode (Öl-Rot-O-Färbung) nachgewiesen werden.
Wo stehen wir und wo wollen wir hin – erste Ergebnisse
Werden die wesentlichen Ergebnisse der jüngsten Veröffentlichungen zum Bioengineering von Zähnen zusammengefasst, so lässt sich feststellen, dass der Weg bereits ein gutes Stück beschritten ist, aber das Ziel noch längst nicht erreicht ist. So konnten Ikeda et al. (2009) einzelne epitheliale und mesenchymale Zellen aus einem Zahnkeim eines 14 Tage alten Mausembryos isolieren und anschließend für fünf bis sieben Tage auf einem Kollagengel kultivieren. Das sich aus den Zellen gebildete Konstrukt wurde dann in leere Alveolen acht Wochen zuvor gezogener Zähne erwachsener Mäuse implantiert. Nach 36,7 ± 5,5 Tagen wurden die Zahndurchbrüche beobachtet. Die im Molarenbereich des Kiefers durchgebrochenen Zähne sahen aber nicht wie Molaren, sondern eher wie die Mausprämolaren aus. Sie waren aber sonst in ihrem Aufbau und mechanischem Verhalten echten Zähnen gleich. Einen ähnlichen Versuch führten Oshima et al. (2011) durch. Sie kultivierten die Zellen einer embryonalen Zahnanlage von Mäusen nach Keimblättern getrennt auf einem Kollagenträger und implantierten sie anschließend in die Nierenkapsel erwachsener Tiere. Nach 60 Tagen entstanden mineralisierte, zahnähnliche Gebilde.
Diese zunächst faszinierenden Ergebnisse lassen bezüglich ihres klinischen Nutzens und der Anwendung am Menschen aber eine schwerwiegende Hürde außer Acht. Hier wurden pluripotente embryonale Zellen verwandt, um in erwachsenen Individuen Zähne zu generieren. Embryonale Zellen werden uns nach der heutigen Gesetzeslage und mit Wahrscheinlichkeit auch zukünftig für das Bioengineering der Zähne nicht zur Verfügung stehen. Wir werden daher nur auf multipotente adulte Stammzellen zurückgreifen können. Um Abstoßungsreaktionen zu vermeiden, müssen Zellspender und Zahnkeimempfänger identisch sein. Ferner müssen alle beteiligten Stammzellen bekannt sein. Sonoyama und Mitarbeiten (2006) konnten verschiedene Stammzelltypen im Gewebe des Wurzelapex unter anderen auch Stro-1-positive mesenchymale Stammzellen nachweisen, die wir in eigener Untersuchung auch in der Zahnkeimpulpa fanden. Hier konnten ferner auch Nervenstammzellen gefunden werden.
Sind alle beteiligten Stammzellen bekannt, so ergibt sich eine weitere Schwierigkeit. Woher sollen beispielsweise die wichtigen Stro-1-positiven Stammzellen wissen, ob sie nun Osteoblasten oder Odontoblasten produzieren müssen und das gebildete Hartgewebe die Form eines Röhrenknochens oder die eines Zahnes haben soll. Als der Amerikaner Craig Venter mit seinem Team das menschliche Genom entschlüsselte, trat neben der Freude über das gelungene Werk auch eine Ernüchterung ein. Man hatte herausgefunden, dass nur ca. drei bis vier Prozent des menschlichen Genoms Proteine kodiert. Was aber ist die Aufgabe der restlichen Gene? Es wird daher angenommen, dass eine große Anzahl dieser Gene Baupläne repräsentiert. Die ersten „Bauplan-Gene“ wurden bei der Fruchtfliege Drosophila nachgewiesen. Inzwischen ist bekannt, dass diese sogenannten Homeobox-Gene (HOX) in ihrer Abfolge und Chromosomenlokalisation bei allen Spezies gleich und am selben Ort zu finden sind.
Es muss dann folglich gelingen, das HOX-Gen für die entsprechenden Zähne in unseren Stammzellen zu aktivieren. Dazu wird es notwendig sein, Transkriptionsfaktoren in die betreffenden Zellen einzuschleusen, die diese Gene aktivieren. Bestimmte Transkriptionsfaktoren sind auch in der Lage, bereits differenzierte Zellen in multi- oder sogar pluripotente Stammzellen „zurückzuschalten“. Diese Transkriptionsfaktoren werden nach ihrem Entdecker auch Yamanaka-Faktoren genannt. Yamanaka und Mitarbeiter (2006) schleusten bei Versuchen mit Mäusezellen die vier Faktoren Oct4 (octamer binding factor 4), SOX2 (sex determining region Y box 2), c-Myc und KLF4 (Kruppel like Factor 4) mithilfe eines viralen Vectors in somatische Zellen, die danach pluripotente Stammzellen wurden. Sie werden daher induzierte pluripotente Stammzellen (iPSCs) genannt. Leider haben c-Myc und KLF4 auch onkogene Wirkung, sodass ca. 20% der iPSCs zu Tumorzellen entarteten. Heute ist bekannt, dass Oct4 alleine in der Lage ist, Pluripotenz zu induzieren. Ein Problem stellt nach wie vor die Tatsache dar, dass die Oct4-Aktivierung in die Zelle bislang nicht auf natürlichem Wege, sondern nur mithilfe eines Virus gelang, der die Oct4 mRNA einschleusen musste. Ein virushaltiger Zahnkeim kann aber sowohl für die Patienten als auch für Behandler keine ideale Lösung darstellen. Es konnte aber kürzlich nachgewiesen werden, dass Oct4 auch auf natürlichem Wege von Stro-1-positiven Zellen an bereits differenzierte Zellen übertragen werden kann, die anschließend wiederum Oct4 aktivieren (Rolf et al., 2012). Es gibt daher die Hoffnung, dass die „echten Dritten“ bei weiteren Fortschritten in der Stammzellforschung durchaus keine Utopie sein werden.
Zur Literaturliste.










