Parodontologie 28.02.2011
Parodontitis gleich Periimplantitis?
share
Unterschiede und Gemeinsamkeiten der beiden Entzündungskrankheiten
Prof. Dr. Heinz H. Renggli referierte während der Unnaer Implantologie Tage Ende Februar 2007 über den Unterschied zwischen Parodontitis und Periimplantitis. Basierend auf seinem Vortrag gibt er nachfolgend einen Einblick in seine Erkenntnisse.
Zahnimplantate haben in der restaurativen Zahnmedizin ihren festen Platz. Mit ihnen sind die Versorgungsmöglichkeiten mit Einzelkronen und Brücken erheblich erweitert worden und der feste Sitz von totalen Prothesen im Ober- und Unterkiefer ist garantiert. Bei fachgerechtem Anbringen und sorgfältiger Pflege ist den Implantaten langfristiges Bestehen zugesichert. Untersuchungen zeigen jedoch, dass Implantate bereits nach wenigen Jahren verloren gehen können. Neben unsachgemäßen chirurgischen Maßnahmen liegt dies vornehmlich daran, dass die meisten Implantate bei Patienten eingesetzt werden, die Zähne durch fortgeschrittene Parodontitis verloren haben und deren Parodontitis vor dem Anbringen der Implantate nicht behandelt wurde.
Ursache der chronischen Parodontitis bei Erwachsenen ist die mikrobielle Plaque, die über langfristige Vernachlässigung der Mundhygiene aufkommt und zur Entzündung des Zahnfleisches und schließlich der tieferliegenden parodontalen Gewebe, zur Parodontitis führt. Es drängen sich die Fragen auf, ob ein Zusammenhang besteht zwischen Parodontitis und Periimplantitis, die Ursache für beide Entzündungsprozesse dieselbe ist und sich die Destruktionsvorgänge gleichen.
Gesundes Parodont
Schroeder (1986) hat aufgrund seiner ausgiebigen histologischen Untersuchungen des Parodonts Jugendlicher und Erwachsener, Lindhe und Karring (2003) haben durch Zusammenfassung der Literatur die klinischen Merkmale gesunder Parodontien definiert (Abb. 1, Schroeder, 1986). Beim Kind ist die Gingiva mittels Saumepithel am Schmelz, beim jungen Erwachsenen an der Schmelz-Zement-Grenze fixiert. Die Zellen des Saumepithels treten dabei nicht in direkten Kontakt zum Schmelz. Sie sind über ihre Hemidesmosome direkt mit der elektronen-optisch durchleuchtenden Schicht verbunden, die die Fortsetzung der Lamina lucida zwischen den basalen Epithelzellen und dem Bindegewebe ist und indirekt verbunden mit einer elektronen-optisch dichten Schicht, die die Fortsetzung der Lamina densa zwischen Saumepithel und Bindegewebe ist und die direkt auf dem Schmelz aufliegt. Die Epithelzellen sind miteinander durch Desmosome verbunden. Die Zellen des Saumepithels sind nicht keratinisiert. Sie werden in Richtung Sulkusboden abgestoßen. Ihre Erneuerungsrate beträgt 10–15 Tage. Die Tiefe des Sulkus beträgt beim Kind etwa 0,5 mm, beim Erwachsenen etwa 1 mm. Der Anteil der Gingiva oberhalb des Sulkusbodens wird freie Gingiva genannt, ist beweglich und von der festen Gingiva durch eine zarte Furche abgegrenzt. Die feste Gingiva wird durch das keratinisierte orale Epithel bedeckt. Ihr Ausmaß variiert von 1 mm in der Frontregion bis zu mehreren Millimetern im Seitenzahnbereich. Die Basalschicht des oralen Epithels ist ebenfalls über die Lamina lucida und Lamina densa mit dem darunterliegenden Bindegewebe fest verbunden.
Das vorherrschende Gewebe in der Gingiva ist das Bindegewebe. Als Hauptkomponente fallen die Kollagenfasern auf, die in verschiedenen, durch die Funktion vorgegebenen Richtungen angelegt sind. Sie sind über dem Alveolarknochen direkt mit dem Wurzelzement verbunden und sichern die bindegewebige Anheftung. Daneben finden sich Fibroblasten, Blutgefäße, Nerven und Grundsubstanz. Im Bindegewebe klinisch gesunder Gingiva kommen neben Makrophagen und Mastzellen auch Infiltrate von neutrophilen Granulozyten, Lymphozyten und Plasmazellen vor.
Das parodontale Ligament, auch Desmodont genannt, ist ein weiches, reichlich mit Blutgefäßen und Zellkomponenten durchsetztes Bindegewebe, welches die Zahnwurzel umschließt und den Wurzelzement mit der Lamina dura des Alveolarknochens verbindet. Das parodontale Ligament geht im zervikalen Anteil in die Lamina propria der Gingiva über, wird aber hier durch die Faserbündel, die den Alveolarknochen mit der Wurzel verbinden, getrennt. Wiederum sind, durch die Funktion bedingt, verschiedene Faserbündel im parodontalen Ligament zu unterscheiden. Über die Volkmann-Kanäle ist das Desmodont direkt mit den Knochenmarkräumen des alveolären Knochens verbunden. Die Hauptfasern, die einerseits im Knochen und andererseits im Wurzelzement inserieren, sind gemäß ihrer Funktion in apiko-okklusaler Richtung angeordnet. Sie verbinden sich im Desmodont zu einem Komplex. Neben dem ausgehnten Netz von Blutgefäßen, die mit den jenen der Gingiva und des alveolären Knochens verbunden sind, finden sich im parodontalen Ligament Fibroblasten, Osteoblasten, Cementoblasten, Osteoklasten, Epithelzellen und Nerven.
Der Wurzelzement ist ein wichtiger Bestandteil des Parodontes. Er enthält keine Blut- und Lymphgefäße und keine Nerven. Er unterliegt keinen Resorptions- oder Remudulationsvorgängen, erfährt aber zeitlebens Apposition. Sein Mineralgehalt ist etwas höher als jener des Knochens. Im Wurzelzement sind zwei Schichten zu unterscheiden: unmittelbar auf dem Dentin befindet sich der azelluläre oder primäre Zement, der während des Zahndurchbruches geformt wird. Darüber liegt der zelluläre oder sekundäre Zement, der sich nach der Eruption aufgrund der funktionellen Beanspruchung des Zahnes bildet. Sowohl primärer wie sekundärer Zement werden von Zementoblasten gebildet, die gelegentlich im sekundären Zement ins Zementoid eingebettet werden und nach dessen Mineralisation Zementozyten genannt werden. Die primären und sekundären Zement-Schichten ziehen sich nicht über den ganzen Wurzelanteil hin, sie können alternierend vorkommen. Der sekundäre Zement findet sich lediglich am intraalveolären Anteil der Wurzel. Die Hauptfasern des parodontalen Ligamentes inserieren sowohl im azellulären wie zellulären Zement. Sie geben dem Zahn Halt in der Alveole, lassen aber auch eine geringe Mobilität des Zahnes innerhalb dieser zu. Die Faseranteile im Wurzelzement und im alveolären Knochen werden Sharpey’s Fasern genannt.
Beim alveolären Knochen wird zwischen kompaktem und spongiösem Knochen unterschieden. Die Zahnalveole ist mit kompaktem Knochen ausgekleidet – auch Lamina dura genannt –, der sowohl im Ober- wie Unterkiefer mit dem bukkalen oder palato-lingualen kompakten Knochen des Kieferkammes verbunden sein kann. Zwischen den Alveolen befindet sich spongiöser Knochen mit einer Vielzahl von Trabekeln. Der bukkale und palato-linguale kompakte Kieferknochen kann gelegentlich sehr dünn sein oder gar fehlen. Ist alveolärer Knochen vom zervikalen Knochenrand her verloren gegangen und ist die Wurzel denudiert, wird dies Dehiszenz genannt. Von Fenestration wird gesprochen, wenn Knochen über der Wurzel fehlt, aber am zervikalen Rand die Wurzel noch mit Knochen bedeckt ist. Über die Volkmann’sche Kanäle, die im kompakten Knochenanteil der Zahnaveole liegen, kommt eine direkte Verbindung der Blut- und Lymphgefäße sowie der Nervenfasern des alveolären Knochens mit dem parodontalen Ligament zustande.
Die Blutversorgung des parodontalen Ligamentes und des perialveolären Knochens erfolgt über die Äste der intraseptal wie apikal verlaufenden Gefäße, die mit den Blutgefäßen des Desmodontes Anastomosen eingehen. Die Gingiva wird vornehmlich durch supraperiostal verlaufende Blutgefäßäste versorgt.
Der Abstand zwischen dem Sulkusboden und dem alveolären Knochenrand – Limbus alveolaris – wird als biologische Höhe oder Breite bezeichnet. Sie ist ein wichtiger Parameter der gesunden Gingiva. Der Anteil des Saumepithels an der biologischen Höhe beträgt 0,97 mm, jener des bindegewebigen Attachments 1,07 mm. Klinisch gesehen hat sich der Durchschnittwert von 2mm bewährt. Zählt man für die Vereinfachung der Einschätzung der biologischen Breite die freie Gingiva hinzu, kann man einen durchschnittlichen Wert von 3 mm, ausgehend vom marginalen Gingivarand bis zum alveolären Knochenrand, annehmen. Wird bei restaurativen Arbeiten die biologische Höhe durch zu tiefes Einlegen des Randes in den gingivalen Sulkus negiert, stellt sich als Folge eine gingivale Rezession ein.
Seitenanfang
Periimplantäre Gewebe
Reaktionen und Merkmale weicher und harter Gewebe nach Anbringen von Implantaten sind in Übersichts- und Konsenspublikationen von mehreren Autoren zusammengefasst worden (Berglund, 1999; Vogel, 1999; Albrektsson et al., 2003; Lindhe & Berglund, 2003). Im Folgenden geht es darum, auf klinischem und mikroskopischem Niveau Unterschiede zwischen gesunden parodontalen und entzündungsfreien periimplantären Geweben darzulegen. Es gilt anschließend zu überlegen, ob daraus für die Praxis relevante Folgerungen gezogen werden müssen. Ausgangspunkt wird dabei sein, dass die Implantate sowohl in kontrollierten Tierversuchen wie in Human-Experimenten gemäß strengen Kriterien angebracht werden.
Klinisch entzündungsfreie periimplantäre Mukosa wird von einem keratinisierten Epithel bedeckt, welches histologisch dem oralen Epithel gesunder Gingiva entspricht. Es setzt sich Richtung Implantat in einem Saumepithel fort. Die Saumepithelzellen sind auch hier mittels Hemidesmosomen an der Lamina auf dem Implantat fixiert. Das Saumepithel wird durch ein Bindegewebsband von ungefähr einem Millimeter Höhe vom knöchernen Implantatbett getrennt. Diese histologischen Merkmale sind sowohl bei Implantaten zu finden, die von Mukosa bedeckt einheilen, als auch bei jenen, die unbedeckt bleiben (Abrahamsson et al., 1996). Die ursprüngliche Dicke der Mukosa spielt dabei keine Rolle. Es bilden sich immer ein ungefähr 2 mm langes Saumepithel und eine Bindegewebszone von ungefähr 1mm Höhe (Berglund & Lindhe, 1996).
Die Kollagenfasern des Bindegewebes zeigen – verglichen mit der Gingiva – ganz andere Eigenschaften. Sie inserieren entweder in groben Bündeln im Periost des marginalen Knochens und sind mehr oder weniger parallel zur Implantatoberfläche ausgerichtet, oder verlaufen in Bündeln mehr oder weniger parallel zum Knochenrand. Die periimplantäre Mukosa enthält substanziell mehr Kollagen als die Gingiva, aber weniger Fibroblasten als korrespondierende Teile der Gingiva. Es wird der Vergleich mit Narbengewebe gemacht.
Unter Osseointegration wird der direkte Kontakt zwischen Knochen und Implantat verstanden. Es darf kein Weichgewebe dazwischen liegen. Osseointegration ist – histologisch betrachtet – weitgehend, aber nicht zu 100% möglich. Sie ist zeitabhängig. Johansson & Albrektsson haben bereits 1987 festgestellt, dass 3–4 Wochen nach Implantation noch kaum von Osseointegration gesprochen werden kann. Erst drei Monate nach Einsetzen des Implantates ist der Knochen zu einem relativ hohen Prozentsatz in direktem Kontakt zur Implantatoberfläche. In Schraubenwindungen, die weniger groß sind als 100 µm, kann sich kaum vollwertiger Knochen mit Grundsubstanz und Zellen bilden, wohl kann sich Grundsubstanz in Poren von viel geringerem Ausmaß festsetzen und zur Integration beitragen. Die Technik der gelenkten Geweberegeneration kann unter bestimmten Umständen die Osseointegration fördern.
Die Blutversorgung der periimplantären Mukosa erfolgt – im Gegensatz zur Gingiva – lediglich über einen Weg. Es sind die großen supraperiostal verlaufenden Blutgefäße an der Außenseite des Alveolärknochens, deren Kapillaren sich bis unter die orale Epitheldecke erstrecken und sich teilweise unter dem Saumepithel verästeln. Ein vaskulärer Plexus, der die Blutversorgung aus dem parodontalen Ligament kompensieren könnte, fehlt aber. Konsequenter Weise ist der unmittelbar unter dem Saumepithel liegende Bindegewebsanteil nur mäßig vaskularisiert. Die biologische Höhe der periimplantären Mukosa weicht geringfügig von der biologischen Breite der Gingiva ab. Das Saumepithel nimmt 2,1 mm ein, das Bindegewebe 1,3–1,8 mm. Vom Mukosarand aus gemessen beträgt sie 3–4 mm (Abb. 2 und 3).
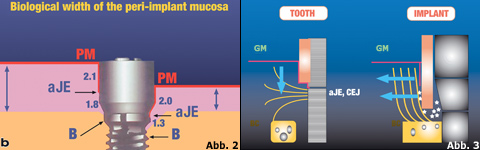
Abb. 2 Quelle: Berglund & Lindhe, 1996 Abb. 3 Quelle: Kornmann et al., 1993
Das periimplantäre Gewebe unterscheidet sich also essenziell vom Parodont. Es gibt zwar eine das Implantat fest umschließende Epithel- und Bindegewebsmanschette, die in ihrem kompartimentalen Aufbau mit jener der Gingiva verglichen werden kann. Das Bindegewebe ist aber anders zusammengestellt, die Fasern sind komplett anders orientiert und die Durchblutung ist geringer. Das parodontale Ligament fehlt, die okklusoartikulären Kräfte werden nicht durch ein elastisches Puffersystem primär aufgefangen, sondern treffen direkt auf den das Implantat umgebenden Knochen auf.
Seitenanfang
Sondierung des gingivalen Sulkus und der periimplantären Mukosa
Klinisch gesunde Gingiva und periimplantäre Mukosa wurden in verschiedenen Tier- und Humanstudien sondiert (Lindhe & Berglund, 2003). Deren Ergebnisse sind unterschiedlich. Der Grund dafür ist, dass kaum standardisierte experimentelle Bedingungen vorlagen. Ericsson & Lindhe (1993) hatten in ihrer Studie darauf geachtet, dass sie vergleichende Messungen mit standardisierten Druckkräften und Sondendicken an Zähnen und Implantaten durchführen konnten. Die Resultate ihrer Untersuchung sind auch wichtig für das Verständnis des Fortschreitens der Entzündungsprozesse in der periimplantären Mukosa.
Wird eine Parosonde mit einer abgerundeten Spitze von 0,5 mm Durchmesser und 0,5 N Druckkraft in den gingivalen Sulkus eingeführt, kann sie die apikalsten Zellen des Saumepithels nicht erreichen. Die Faserbündel der Gingiva werden in apikaler Richtung zusammengepresst. Sie bringen der eindringenden Sonde Widerstand entgegen. Das Saumepithel bleibt im apikalsten Teil unversehrt. Wird dieselbe Sonde mit derselben Kraft für die Sondierung periimplantärer Mukosa gebraucht, dringt die Sonde durch das apikal gelegene Epithel, trifft auf zumeist zur Implantatoberfläche parallel verlaufende Bindegewebs-Faserbündel und verdrängt diese mit der Mukosa nach lateral. Dem Eindringen der Sonde ins tieferliegende Gewebe wird kaum Widerstand geboten.
Plaquebildung und Struktur
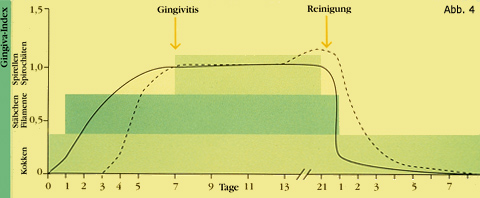
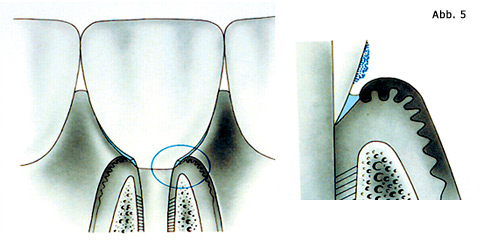
Als Ursache der gingivalen Entzündung wurde von Löe und seiner Gruppe (1965) die mikrobielle Plaque verantwortlich gemacht, die sich bei Vernachlässigung der Mundhygiene entlang des Zahnfleischrandes bildet (Abb. 4). Schroeder (1970) und später Listgarten (1976) haben mikroskopisch die Plaqueentwicklung studiert und die Grundlagen für den aktuellen Wissensstand gelegt (Berglund, 1999; Mombelli, 1999; Quirynen et al., 1999; Lang et al., 2003). Primär setzt sich auf der gereinigten Zahn- oder Metalloberfläche eine aus der Mundflüssigkeit stammende Mukoproteinschicht ab. An ihr fixieren sich als erste Bakterien Kokkenpopulationen, die bei genügender Kohlenhydratzufuhr Dextrane bilden. Diese verbinden sich zur Plaquematrix und fördern das Kolonisieren der Bakterien an Oberflächen. Stäbe und Filamente kommen dazu und schließlich etablieren sich für Zahnfleisch und Parodont gefährliche, gramnegative, anaerobe Mikroorganismen, die letztlich für die Entzündungsprozesse verantwortlich sind. Die Bakterien liegen in mehreren Schichten übereinander und geben jetzt der Plaque eine deutliche Struktur. Die Plaque breitet sich auf der Zahn- oder Metalloberfläche Richtung Saumepithel aus (Abb. 5). Die feste Verbindung der Epithelzellen mit der Unterlage wird aufgebrochen. Die epitheliale Anheftung geht allmählich und teilweise verloren. Die Plaque kann sich tiefer in den subgingivalen beziehungsweise submukösen Raum entwickeln. Die Bakterienpopulation verändert sich in diesem anaeroben Milieu, es kommen von Sauerstoff unabhängig lebende Bakterien opportunistisch auf. Ihnen steht als Barriere zum gingivalen und mukösen Bindegewebe jetzt nur noch das bereits veränderte und im Ausmaß verringerte, permeable Saumepithel gegenüber.
Seitenanfang
Parodontale Entzündung
Nach Plaqueakkumulation im gingivalen Sulkus sickern bakterielle Stoffwechselprodukte und Toxine durch das Saumepithel. Sie tragen dazu bei, dass die desmosomale Verbindungen zwischen den Zellen beschädigt und der epitheliale Zellverband aufgelockert wird. Zusätzlich lösen sie im Bindegewebe erste Reaktionen aus, die eine bevorstehende Infektion abwehren sollen. Kornman und seine Mitarbeiter (1997) haben die Entzündungsprozesse in der Gingiva und deren Folgen auf die Destruktion parodontaler Gewebe übersichtlich dargestellt (Abb. 6). Eine der ersten Reaktionen im gingivalen Bindegewebe ist die lokale Vasodilatation. Dadurch soll eine Konzentration von Abwehrelementen unter dem Saumepithel bewerkstelligt werden. Neben Immunoglobulinen (Antikörper) werden sich immunkompetente Zellen ansammeln und so den Abwehrring festigen. Eine weitere Reaktion ist die Phagozytoseaktivität. Mikrophagen (polymorphkernige Granulozyten) verlassen die Blutgefäße und bewegen sich durch das Saumepithel Richtung Plaque.
Auf dem Weg dahin erfüllen sie phagozytäre Aufgaben. Die Mikrophagen sind kurzlebig, zerfallen nach wenigen Tagen. Dabei werden Enzyme freigesetzt, die wiederum zu Gewebeschäden beitragen und das Saumepithel noch mehr auflockern. Als dritte Reaktion werden Monozyten und Lymphozyten aktiviert. Die Lymphozyten tragen einerseits mit der Bildung von Antikörpern, die Monozyten andererseits mit Phagozytose – sie werden jetzt Makrophagen genannt – zur Abwehr bei. Während ihrer Phagozytoseaktivität werden Zytokine freigesetzt, die weitere Entzündungsreaktionen in deren Gesamtkaskade initiieren oder stimulieren. Am Beispiel der Zytokine kann die Gewebe zerstörende Wirkung der Entzündungsmechanismen besonders gut dargestellt werden (Abb. 7). Prostaglandin E2, Interleukin (IL1b) und Tumor Nekrose Faktor (TNFa) ergießen sich ins Gewebe und schädigen den parodontalen Knochen und das Bindegewebe. Prostaglandin E2 trägt zur Resorption des alvolären Knochens bei.
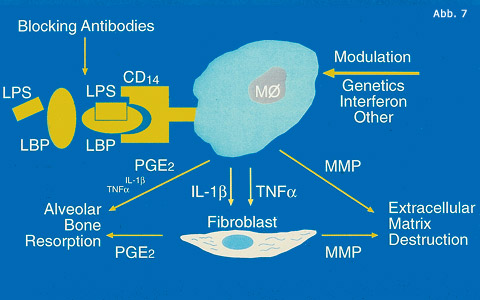
Zusammen mit Interleukin (IL1b) hemmt es nämlich die Osteoblastenaktivität, während die Aktivität der Osteoklasten unvermindert bleibt, ja sogar durch TNFa gefördert wird. Interleukin (IL1b) seinerseits schränkt die Fibroblastenaktivität ein. Es wird kaum mehr neues Bindegewebe gebildet. Schließlich geben die Makrophagen während der Phagozytose auch noch Metalloproteinasen ab, die die Grundsubstanz des Bindegewebes schädigen. Die Aktivität der Makrophagen unterliegt genetischen Faktoren, was zur Erklärung verschiedener parodontalen Reaktionen bei gleich starken Plaqueakkumulationen herangezogen werden kann. Alle diese immungesteuerten Reaktionen tragen als Nebenwirkung der Abwehr gegen die bakterielle Invasion zur primären Schädigung parodontaler Gewebe bei.
Schließlich werden Mikroorganismen, die nach heutiger Auffassung opportunistisch in der subgingivalen Plaque aufkommen, ins Gewebe eindringen und zu dessen Destruktion beitragen. Diese Bakterien sind zwar von Anfang an in der etablierten Plaque vorhanden, aufgrund ihres prozentuell geringen Anteils spielen sie aber noch keine essenzielle Rolle für die parodontale Destruktion. Es sind vornehmlich gramnegative, anaerobisch lebende Opportunisten, die als paropathogene Leitkeime bezeichnet werden. Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis und Prevotella intermedia werden am häufigsten mit Parodontitis in Verbindung gebracht. Gewiss sind auch weitere Keime am Destruktionsprozess beteiligt.
Periimplantäre Entzündung
Die periimplantäre Mukosi-tis wurde tierexperimentell (Berglundh et al., 1991; Berglundh et al., 1992; Ericsson et al., 1992; Abrahamsson et al., 1998) wie auch in Humanstudien (Leonhardt et al., 1992; Lindhe & Berglundh, 2003) untersucht. Sie wird, wie die Gingivitis, ebenfalls durch die Plaque verursacht. Die sich in der Mukosa abspielenden Prozesse sind mit jenen der Gingivitis vergleichbar. Dabei muss einerseits berücksichtigt werden, dass die Blutversorgung der periimplantären Mukosa allein über die supraperiostal verlaufenden Blutgefäße erfolgt, während jene der Gingiva ja auch durch Blutgefäße aus dem parodontalen Ligament gesichert ist. Andererseits ist die Anordnung der Faserbündel im Bindegewebe rund um Implantate komplett anders als in der Gingiva. Sie verlaufen ja vornehmlich parallel zur Implantatoberfläche. Wie gezeigt werden konnte, breitet sich die periimplantäre Entzündung deshalb viel rascher in die tieferen Bindegewebeschichten aus als bei der Gingivitis.
Mit vergleichenden tierexperimentellen Studien (Berglund et al., 1991; Leonhardt, 1992; Lindhe et al., 1992) sowie Humanstudien (Sanz et al., 1999; Review von Mombelli, 1999) wurde dargelegt, dass auch die Prozesse der Periimplantitis mit jenen der Parodontitis zu vergleichen sind. Aber auch hier fiel auf, dass das Fortschreiten der Entzündung in die tieferen Gewebe bei der Periimplantitis in der gleichen Zeiteinheit viel zügiger vorangeht als bei der Parodontitis. Das Fehlen zemento-gingivaler Faserbündel im periimplantären Bindegewebe, die im Parodont nicht parallel, sondern quer zum fortschreitenden Entzündungsprozess verlaufen, wird dafür verantwortlich gemacht. In den ersten Stadien der Parodontitis bleibt der Entzündungsprozess durch diese Bündel auf den suprakrestalen Bereich beschränkt. Bei der Periimplantitis hingegen breitet er sich bis zum marginalen, periimplantären Knochen aus. Es wird eine deutliche Aktivität der Osteoklasten mit entsprechenden Resorptionen am Knochenrand wahrgenommen. Da das Implantat ohne ligamentäre Verbindung direkt im Knochen fixiert ist, sind die Konsequenzen des Knochenverlustes im Vergleich zur Parodontitis auch größer.
Seitenanfang
Verhütung der Periimplantitis
Wie die Gingivitis wird die periimplantäre Mukositis durch die bakterielle Plaque am Implantat verursacht. Die Mukositis ist der Vorläufer der Periimplantitis. Deren Prävention muss sich deshalb auf sorgfältige und konsequente Plaquebekämpfung ausrichten (Mombelli, 1999). Neben der mechanischen Plaqueverhütung und deren Entfernung mittels regelmäßiger, individueller und professioneller Zahnreinigung, hat die chemische Plaquebeherrschung einen festen Platz in der Prävention der periimplantären Mukositis bekommen und somit auch der Periimplantitis. Das bisbiguanide Antiseptikum Chlorhexidin hat sich in einer 0,12–0,2%igen alkoholischen oder wässrigen Lösung als das am häufigsten untersuchte und am effektivsten wirksame Mundspülmittel gegen Plaquebildung und Gingivitis erwiesen (Übersicht bei Addy et al., 1994). Es kann deshalb auch zur Verhütung der periimplantären Mukositis eingesetzt werden. Sein Vorteil gegenüber andern Spülmitteln liegt in der Depotwirkung. Es setzt sich nach dem Spülen in der Mukoproteinschicht der oralen Schleimhaut ab und kann selbst nach 24 Stunden dort noch in Spuren nachgewiesen werden. Die höchsten Restkonzentrationen wurden am Zungenrücken festgestellt. Zwischen den Papillen am Zungenrücken sind – neben andern – die Reservoirs paropathogener Bakterien, die von hier aus die parodontalen Taschen und die periimplantären Gewebe besiedeln. Mit Chlorhexidinspülungen können sie unter Kontrolle gehalten werden. Patienten mit Implantaten müssen in ein straffes Nachsorgeprogramm eingebettet sein. Je nach Risiko, wobei die orale Hygiene des Patienten eine wichtige Rolle spielt, muss die professionelle Zahn- und Implantatreinigung alle drei oder nur alle zwölf Monate erfolgen.
Unterschied zwischen Parodontitis und Periimplantitis
Der wichtigste Unterschied zwischen beiden Erkrankungen liegt in der Ausgangssituation. Während beim Parodont die Gingiva mittels Saumepithel und Bindegewebsfasern, die im Wurzelzement inserieren, fest verbunden ist, besteht beim periimplantären Gewebe die Manschette lediglich aus der dem gingivalen Saumepithel vergleichbaren Epithelverbindung. Die darunter liegenden bindegewebigen Faserbündel sind im Gegensatz zum Parodont mehr oder weniger parallel zum Implantat angeordnet. Sie sind lediglich am Knochen befestigt, in den das Implantat direkt eingebettet ist. Die Blutversorgung erfolgt über die supraperiostal verlaufenden Gefäße. Beim Parodont ist der Zahn über ein reichlich durchblutetes Ligament mit dem alveolären Knochen verbunden.
Der Entzündungsprozess breitet sich aufgrund der verschiedenen Feingewebe-Strukturen bei gleicher Ursache, der Plaque, unterschiedlich aus. Während sich bei der Gingivitis die Entzündung in einer bestimmte Zeiteinheit nur langsam in tiefer liegende Gewebe ausbreitet, geschieht dies in der periimplantären Mukosa schnell. Grund dafür sind die parallel zum Implantat angeordneten bindegewebigen Faserbündel einerseits und die Anordnung der Blutgefäße andererseits. Die in der Gingiva quer zum, nach apikal fortschreitenden Entzündungsprozess liegenden Faserbündel verlangsamen den Prozess. Die Entzündung im periimplatären Gewebe erreicht erheblich schneller den Knochenrand als bei der Gingiva. Es setzt eine rege Aktivität der Osteoklasten mit Knochenresorptionen ein, während in der Gingiva im selben Zeitabschnitt die Entzündungsmerkmale noch auf die suprakrestalen Gewebeabschnitte begrenzt sind und der alveoläre Knochenrand intakt bleibt. Die bakterielle Invasion ins geschädigte Gewebe erfolgt bei der Periimplantitis schneller als bei der Parodontis.
Zusammenfassung und Schlussfolgerung
Ursache der Gingivitis und der periimplantären Mukositis ist die mikrobielle Plaque. Die Entzündungsprozesse in der Gingiva und in der periimplantären Mukosa können mit einander verglichen werden. Der Widerstand der periimplantären Gewebe gegen diese Prozesse ist jedoch geringer als in der Gingiva. Deshalb entwickeln und breiten sich die Entzündungsprozesse in den periimplantären Geweben schneller aus. Haben sie den periimplantären Knochen erreicht, wird die Mukositis zur Periimplantitis. Deren Therapie ist weit schwieriger als jene der Parodontitis. Es sollte deshalb alles daran gesetzt werden, periimplantäre Mukositis und Periimplantitis mithilfe von mechanischen und chemischen Mitteln zu verhüten.
Autor: Prof. Dr. Heinz H. Renggli








