Parodontologie 02.07.2013
Nichtchirurgische Parodontitis- und Periimplantitistherapie
share
Parodontalerkrankungen sind in Deutschland nicht nur weitverbreitet, sondern haben rückblickend betrachtet seit den letzten zwei Dekaden zugenommen. Unter den Erwachsenen leiden fast 53 % und bei den Senioren 48 % unter mittelschweren sowie etwa 21 % respektive fast 40 % unter schweren Parodontitisformen.1
Angemerkt sei, dass der Zeitraum der Datenerhebung im Rahmen der Vierten Deutschen Mundgesundheitsstudie im Jahre 2005 lag. Somit sind die derzeit vorliegenden „aktuellen“ Daten bereits gut acht Jahre alt. Die Fünfte Mundgesundheitsstudie (DMS V) soll gemäß den Haushaltsbeschlüssen vom November 2012 der Vertreterversammlung der Kassenzahnärztlichen Bundesvereinigung und der Hauptversammlung der Bundeszahnärztekammer ab 2013 durchgeführt werden. Es bleibt daher abzuwarten, ob die Parodontalerkrankungen in Deutschland dem allgemeinen Trend der letzten Jahre folgend weiter zunehmen oder aber bereits eine Besserung von prophylaktischen Maßnahmen zu einer verbesserten Mundgesundheit der Deutschen beitragen konnte.
Die Prävalenz der periimplantären Mukositis wird derzeit mit circa 39,4–80 %2, die der Periimplantitis mit circa 8–10 %3–4 aller Implantate angegeben. Die implantatumgebenden Hartgewebe scheinen seltener zu erkranken als die Parodontalen. Da sich jedoch die Prozesse zwischen Parodontitis und Periimplantitis in vielen Punkten ähneln, dürfte eine höhere Prävalenz entsprechend der Parodontalerkrankungen wahrscheinlicher sein. Fundierte wissenschaftliche Erhebungen hierzu wurden noch nicht veröffentlicht. In Anbetracht dieser betrüblichen Zahlen dürfte die Effektivität unserer derzeit verfügbaren prophylaktischen als auch weiterführenden Parodontitis- und Periimplantitis-Therapiemaßnahmen nicht ausreichend sein.
Prophylaxemaßnahmen
Um einer Parodontitis/Periimplantitis oder ihrem Wiederaufflammen vorzubeugen, wird es als wichtig angesehen, eine gründliche Parodontitis-/Periimplantitis-Prophylaxe zu betreiben. Neben dem Putzen mit der Zahnbürste ist auf eine gute Zahnzwischenraumpflege mit Zahnseiden, Interdentalbürsten oder Mundduschen besonderen Wert zu legen. Darüber hinaus sollte auch eine Entfernung von Belägen auf dem Zungenrücken erfolgen. Bei regelmäßigen zahnärztlichen Kontrollen in Verbindung mit einem individuell abzustimmenden Zahnreinigungsintervall können außerdem die von der heimischen Mundhygiene nicht erreichten „Putznischen“ gesäubert und Hilfestellungen bei der häuslichen Mundhygiene gegeben werden.
Mithilfe eines impulsartig abgegebenen Wasserstrahls kann ebenfalls eine Säuberung des Interdentalraums erreicht werden. Die Anwendung ist vergleichsweise einfach, da nur der Applikationsansatz des Geräts von außen, oberhalb der Zahnfleischpapille an den Zahnzwischenraum herangeführt werden muss. Seit vielen Jahren kommerziell erhältlich sind diverse Produktentwicklungen wie etwa der Water Flosser (Waterpik). Seit zwei Jahren ist zudem der Air Floss (Philips) auf dem Markt, wobei ab Juli dieses Jahres eine verbesserte beziehungsweise weiterentwickelte Version erhältlich sein soll. Mit einigen klinischen Untersuchungen konnte belegt werden, dass der Einsatz des Water Flossers zu einer signifikanten Gingivitisreduktion beitragen konnte.5, 6 Eine effektivere Plaqueentfernung, verglichen mit Zahnseide, konnte jedoch klinisch nicht nachgewiesen werden.6 Zum Air Floss sind nach wie vor nur zwei vergleichende klinische Untersuchungen, zwischen Air Floss und Water Flosser, verfügbar. Hierbei zeigte der Water Flosser bessere Ergebnisse hinsichtlich der Plaqueentfernung und der Gingivitisreduktion als der Air Floss.7, 8
Allerdings fehlte in diesen Untersuchungen als Basis eine Probandengruppe, die handelsübliche Zahnseide anwendete, weshalb die Ergebnisse nur eingeschränkten Aussagewert besitzen. Es wäre wünschenswert, wenn weiterführende Untersuchungen auch von anderen Arbeitsgruppen erfolgen würden, um den tatsächlichen Nutzen im Rahmen der heimischen Mundhygiene abschätzen zu können. Das Problem der Interdentalraumhygiene ist daher nach wie vor in den meisten Fällen nicht effektiv gelöst. Kommt eine supra- oder gar infraalveoläre Taschensituation hinzu, ist zumeist nicht einmal partiell die Plaqueentfernung aus solchen Bereichen im Rahmen der heimischen Mundhygiene zu erreichen.
Minimalinvasive, nichtchirurgische Therapiemöglichkeiten
Die nichtchirurgische, präventiv orientierte Behandlung der Parodontitis und Periimplantitis beschränkt sich im Wesentlichen immer noch auf die Reinigung beziehungsweise Dekontamination der freiliegenden mit pathogenen Mikroorganismen besiedelten Zahn- oder Implantatoberflächen. Die biofilmzerstörende Wirkung ist bei allen verfügbaren Verfahren leider primär auf den Zeitpunkt der Anwendung begrenzt. Der nachfolgende und begleitende Einsatz von Antiseptika ermöglicht bedauerlicherweise keine klinisch relevante Verlängerung der Kontaminationsfreiheit. Viele internationale Publikationen zur „Full Mouth Disinfection“ konnten zudem überhaupt keinen klinisch nützlichen Effekt bei der adjuvanten Anwendung von beispielsweise Chlorhexidin-Spüllösungen nachweisen. Wird der Patient aus der Praxis entlassen, kann dieser in der Regel die betroffenen Zahn- oder Implantatoberflächen im Rahmen der täglichen Mundhygiene nicht weiterführend reinigen, sodass in den meisten Fällen eine Neubesiedelung innerhalb kurzer Zeit stattfindet und oft die Ausgangswerte der Keimbelastung vor Therapiebeginn erreicht werden.9–11
Es reicht daher offensichtlich nicht aus, wenn die Patientensituation erst nach Wochen evaluiert und nachbehandelt wird. Da in einer Studie bereits nach einer Woche eine mit der Ausgangssituation vor der Behandlung vergleichbare Bakterienbelastung (für die parodontalpathogenen Keime A.a., F.n., P.g., P.i., T.d. und T.f.) an den betroffenen Parodontien gefunden wurde,9 sollte insbesondere bei aggressivem Parodontitisverlauf eine zeitnahe und sich je nach Bedarf intervallartig wiederholende präventiv orientierte, minimalinvasive Therapie angewendet werden. Nur auf diese Weise kann ein schnellerer Entzündungsrückgang und eine Stabilisierung des betroffenen Parodonts erreicht werden. Die Wahl des zeitlichen Abstands zur wiederholten unterstützenden Parodontitis-/Periimplantitistherapie kann leider nicht allgemeingültig festgelegt werden. Die klinischen, individuellen Entzündungsparameter des Patienten sollten den Therapieabstand definieren. Weiterführende wissenschaftliche Untersuchungen wären wünschenswert, um die möglichst idealen Zeitpunkte für die unterstützende Therapie künftig noch genauer generieren zu können.
Dennoch bleiben insbesondere diejenigen Patienten problematisch, welche trotz guter Mundhygiene eine Parodontitis aufgrund eines partiell kompromittierten Immunsystems entwickeln. Gerade diese Patienten werden langfristig ihre Zähne im Vergleich zum immunologisch Gesunden schneller verlieren und dann den Wunsch nach festsitzendem Zahnersatz äußern. Implantatversorgungen haben hier ein erhebliches Periimplantitisrisiko und somit besteht die große Gefahr, dass die Implantate dem Schicksal der früheren Zähne folgen.12 Zur mechanischen Biofilmentfernung stehen derzeit neben den bekannten Metallküretten für die nichtchirurgische Parodontitisbehandlung auch Plastik- und Titanküretten, speziell modifizierte Arbeitsenden für Ultraschallsysteme, hochenergetische Laserlichtanwendungen, die antimikrobielle Photodynamische Therapie (aPDT) und Pulverstrahlverfahren insbesondere auch für die Periimplantitisbehandlung zur Verfügung.
Mit Plastik- oder Titanküretten wird jedoch nur eine unzureichende Reinigung/Dekontamination der speziell texturierten und durch die Schraubenwindungen schwierig zu erreichenden Implantatoberflächen ermöglicht. Zudem wird das angrenzende Weichgewebe vergleichsweise stark traumatisiert. Ultraschallsysteme, insbesondere mit modifizierten Ansätzen für die Periimplantitisbehandlung optimierte Systeme (z.B. das Vector-System; Dürr Dental, oder das Piezon Master/Implant Cleaning, EMS) können die bakteriellen Biofilme von den texturierten Implantatoberflächen wirkungsvoller entfernen,13 obwohl langfristig betrachtet nur ähnliche Attachmentgewinne im Vergleich zu handinstrumentellem Scaling und Wurzelglätten erzielbar sind.14
CO2-, Dioden- und Er:YAG-Laserlichtsysteme scheinen für die klinische Anwendung zur Dekontamination von Zahn- und Implantatoberflächen ebenfalls geeignet zu sein, da durch die Bestrahlung, eine schonende Instrumentierung der Zahn- und Implantatoberfläche erreicht werden kann.15–17 Bereits bei der Parodontitistherapie konnte gezeigt werden, dass vor allem mit dem Er:YAG-Laser ein schonender Abtrag subgingivaler Konkremente von der Wurzeloberfläche möglich ist18, 19 und zu einem signifikanten Attachmentgewinn führt.20, 21 Darüber hinaus entfernte der Er:YAG-Laser bakterielle Biofilme von texturierten Implantatoberflächen initial deutlich besser als solche, welche mit dem Vector-Ultraschall-System oder mit Handinstrumenten bearbeitet wurden.19 Mit Anwendung des Er:YAG-Lasers verbessern sich die klinischen Entzündungsparameter signifikant gegenüber der klassischen Handinstrumentierung.22
Die antimikrobielle Photodynamische Therapie (aPDT) erreicht ihre dekontaminierende Wirkung über die Lichtaktivierung einer an die Bakterienmembranen angelagerten Farbstofflösung, welche zu einer irreversiblen Schädigung der Bakterienmembranen führt. Bisher gibt es nur wenige klinische Untersuchungen, in welchen die aPDT vorzugsweise als adjuvante Therapieoption zum klassischen Scaling und Root Planing angewendet wurde. Der klinische Benefit scheint fraglich zu sein,23, 24 insofern bleiben aussagekräftige, prospektive Untersuchungen abzuwarten.
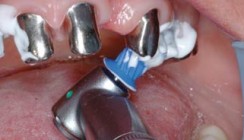
Pulverstrahlgeräte sind bereits seit vielen Jahren im Rahmen der supragingivalen Anwendung, insbesondere bei der professionellen Zahnreinigung, erfolgreich im Einsatz. Die Indikationserweiterung auf subgingivale mit Biofilm belastete Oberflächen wurde mithilfe eines nur wenig abrasiven Glyzin-Pulvers (z.B. Air-Flow powder Perio, EMS) und speziellen Applikatoren möglich (siehe Abb. 1–5). Die Reinigungs- beziehungsweise Dekontaminationswirkung an Implantatoberflächen dieser (circa 20 µm großen) aus der Aminosäure Glyzin bestehenden Kristalle ist erheblich besser im Vergleich zu konventionellen Handinstrumenten und Ultraschallscalern.25–28 Darüber hinaus konnte gezeigt werden, dass das Glyzin-Pulver im Rahmen des Strahlverfahrens keine nachteiligen Effekte auf das umgebende Weichgewebe ausübte. Im Vergleich hierzu führten konventionelle Handinstrumente zu einer erheblichen Traumatisierung der angrenzenden Weichgewebe.22, 29
Die Entwicklung neuer Instrumentenansätze insbesondere für die geschlossene Parodontitis- und Periimplantitistherapie (Perio-Flow Handstück für Air-Flow Master, EMS) ermöglicht nunmehr eine effektive und effiziente Reinigung der Zahn- und Implantatoberfläche bei einer weitestgehend atraumatischen, geschlossenen Vorgehensweise.9, 22, 28 Die Therapiemethode ermöglicht eine drei- bis fünfmal kürzere Behandlungsdauer mit wesentlich weniger Schmerzen, verglichen mit konventionellen Handinstrumenten.9 Allerdings kann auch mit der niedrigabrasiven Pulverstrahltechnik keine anhaltende Keimreduktion erreicht werden. Neben der rein physikalisch-mechanischen Bearbeitung der Implantatoberflächen werden auch chemische Verfahren zur Desinfektion der biofilmbesiedelten Implantat- oder Zahnoberflächen eingesetzt.
Chemische Verfahren allein haben aufgrund der zum Teil nur geringen Durchdringungstiefe des Biofilms und der nur kurzen Effektdauer eine klinisch nicht ausreichende desinfizierende geschweige denn dekontaminierende Wirkung. In der Regel werden deshalb die rein mechanischen Dekontaminationsverfahren in Kombination mit einer chemischen Komponente angewendet (z.B. Chlorhexidinspüllösungen und die Anwendung von Lasern oder Kürettage).
Fazit
Eine initial bessere Dekontaminationsleistung (insbesondere im Rahmen der niedrigabrasiven Pulverstrahl- und Laserlichtverfahren) darf somit nicht darüber hinwegtäuschen, dass bereits unmittelbar nach der Therapie eine Neubesiedelung der gereinigten Zahn- und Implantatoberflächen beginnt und ein Reattachment der periodontalen und periimplantären Gewebe nur in sehr eingeschränktem Maße stattfindet, da eine weiterführende, effektive häusliche Prophylaxe in den betroffenen Bereichen nicht möglich ist. Insofern sollte insbesondere bei aggressivem Parodontitisverlauf eine zeitnahe und sich je nach Bedarf intervallartig wiederholende präventiv orientierte, minimalinvasive unterstützende Therapie zur Anwendung kommen. Nur auf diese Weise kann ein schnellerer Entzündungsrückgang und eine Stabilisierung des betroffenen Parodonts erreicht werden.
Die verfügbaren Therapieverfahren unterscheiden sich erheblich in Bezug auf die Effizienz der Anwendung, den mitunter schmerzvollen Nebenwirkungen für den Patienten und dem initialen Dekontaminationsgrad. Handinstrumente sind zwar kostengünstig, jedoch sehr zeitintensiv in der Anwendung, bei initial nur geringer biofilmentfernender Wirksamkeit und vergleichsweise starken traumatisierenden Effekten auf die angrenzenden Weichgewebe, was für den Patienten nicht nur während der Behandlung sehr unangenehm werden kann. Für die Zukunft wären alternative Therapieverfahren mit einer längerfristigen Wirkung weit über den reinen Anwendungszeitraum hinaus von entscheidender Bedeutung.7
Die Literaturliste zu diesem Beitrag finden Sie hier.