Parodontologie 27.10.2022
Anwendung von nichtinvasivem physikalischem Plasma
Die Wundheilung nach chirurgischen Eingriffen an Weich- und Hartgeweben wird durch eine Vielzahl von Einflussfaktoren bestimmt. Bereits allgemeine, systemische präoperative Bedingungen wie eine unausgewogene Ernährung, Alkohol- und Nikotinkonsum können posttherapeutische Komplikationen hervorrufen.1 Jedoch in viel stärkerem Maße können Wundheilung und Geweberegeneration durch lokale mikrobielle Fehlbesiedlung und Infektionen und zumeist damit assoziierten entzündlichen Prozessen beeinträchtigt werden.
In den letzten Jahren hat sich die Anwendung von medizinisch einsetzbarem physikalischem Plasma als ein Verfahren herausgestellt, das die Wundheilung insgesamt positiv beeinflussen kann.2 Bei physikalischem Plasma handelt es sich um ein hochreaktives und elektrisch leitfähiges Gas, das man auch als den vierten Aggregatzustand bezeichnet. In der Natur kommen physikalische Plasmen in der Sonne, in Polarlichtern oder in Blitzen vor; dies sind jedoch thermische Plasmen mit Temperaturen von vielen Hundert bis zu einigen Tausend Grad Celsius. Für den medizinischen Einsatz wurden Geräte entwickelt, die sogenanntes „kaltes“ physikalisches Plasma erzeugen können. Dieses erreicht Temperaturen nur wenig über der Körpertemperatur des Menschen und führt daher zu keinerlei thermischen Schäden am Gewebe.3 Diese medizinischen Varianten der physikalischen Plasmen werden oftmals als nichtinvasives physikalisches Plasma (Non-Invasive Physical Plasma: NIPP), als kaltes Atmosphärendruckplasma (Cold atmospheric [Pressure] Plasma: CA[P]P) oder auch als gewebeverträgliches Plasma (Tissue Tolerable Plasma: TTP) bezeichnet. Im Folgenden wird die Bezeichnung NIPP genutzt, da diese klar vom (Blut-)Plasma abgrenzt und den gewebeschonenden und nebenwirkungsarmen Charakter einer NIPP-Therapie am besten wiedergibt.
NIPP: Nichtinvasives physikalisches Plasma
Über seinen wundheilungsfördernden Charakter hinaus gilt NIPP als neues therapeutisches Verfahren zur Verringerung der bakteriellen Besiedlung chronischer Wunden.4 Außerdem zeigten sich bei längeren Behandlungszeiten ebenfalls devitalisierende Effekte auf unterschiedliche Tumorzellen.5,6 Hierbei scheinen Krebszellen allgemein sensitiver gegenüber einer NIPP-Behandlung zu reagieren als nicht maligne Zellen von physiologisch gesunden Geweben.7
NIPP-Zusammensetzung
Die Zusammensetzung von NIPP und damit seine biomedizinischen Eigenschaften werden durch das verwendete Trägergas sowie die technischen Spezifikationen des Hochfrequenzgenerators definiert. Viele auf dem Markt befindlichen Geräte arbeiten mit den Edelgasen Argon und Helium.2,8 In der Zahnmedizin sind aber vor allem Geräte etabliert, die NIPP aus der Umgebungsluft erzeugen. Dies hat den Vorteil, dass keine anderen Gase als Luft in die Mundhöhle gelangen können und den Patienten gefährden – auch wenn natürlich die gerade in der Zahnmedizin entsprechend etablierten Absaugvorrichtungen das bei den anderen Geräten austretende Edelgas aus der Mundhöhle entfernen können. Der klinische Einsatz ist aber mit Umgebungsluft-Geräten deutlich erleichtert, da dies die Therapiekosten reduziert und keine Absaug- und Überwachungsvorrichtungen eingesetzt werden müssen.9,10
NIPP-Konsortium
Am Universitätsklinikum Bonn der Rheinischen Friedrich-Wilhelms-Universität Bonn wurde ein interdisziplinäres Konsortium zur Erforschung der Anwendung von NIPP in der Medizin etabliert. Das NIPP-Konsortium ist hauptsächlich in der Zahnklinik und in der Frauenklinik angesiedelt. Hier befinden sich Labore für Materialprüfung, optische Physik, Histologie, Molekular- und Zellbiologie. Die gründliche Analyse molekularer und zellulärer Prozesse einer NIPP-Behandlung führt zur Entwicklung neuer und innovativer Therapieoptionen. Diese werden dann in klinischen Studien – auch in Kooperation mit weiteren Einrichtungen des Universitätsklinikum Bonn – in der Patientenversorgung getestet.
Die Stärke des NIPP-Konsortiums liegt in der Verbindung von grundlagenwissenschaftlicher Expertise und medizinischer Erfahrung. Physiker, Biologen und Kliniker aus vielen Disziplinen arbeiten gemeinsam an der Charakterisierung und Entwicklung innovativer NIPP-Anwendungen für zukünftige Therapien. Dabei verfügen die beteiligten Wissenschaftler über langjährige Erfahrung auf diesem Gebiet, was durch zahlreiche Publikationen belegt wird.
Einen Schwerpunkt bildet der Einsatz von NIPP in der Zahnmedizin. Verschiedene NIPP-Geräte wurden hinsichtlich eines potenziellen Einsatzes bei der Behandlung von Geweben der Mundhöhle untersucht. Dabei standen Analysen von apoptotischen, proliferativen, inflammatorischen, degradativen und Matrix-modulierenden Prozessen im Vordergrund. Es zeigte sich zum Beispiel, dass NIPP zu wachstumsfördernden Effekten bei Gingivazellen, Zementoblasten und Knochenzellen führte.10–16 Die Resultate wurden überwiegend in In-vitro-Modellen mit permanenten Zelllinien gewonnen und anschließend in primärem Material aus Patientenresektaten bestätigt. Ebenfalls von großem Interesse ist die Wirkung von NIPP auf zahnheilkundliche Werkstoffe, wie sie bei Prothesen, Implantaten, Kronen und Brücken eingesetzt werden.
In der klinischen Anwendung zeigt die NIPP-Therapie bei schlecht heilenden intraoralen Wunden eine rasche und sehr gute Wirkung.17 Neben den nichtinvasiven und nahezu schmerzfreien Eigenschaften einer NIPP-Behandlung sind nach aktuellem Kenntnisstand auch nach Langzeitversuchen noch keine unerwünschten Therapiewirkungen beschrieben worden.18 Der vielversprechende Anwendungshorizont von NIPP in der Zahnheilkunde hat daher auch aktuell zu einem ersten Entwurf einer Leitlinie für den Einsatz von NIPP geführt.19
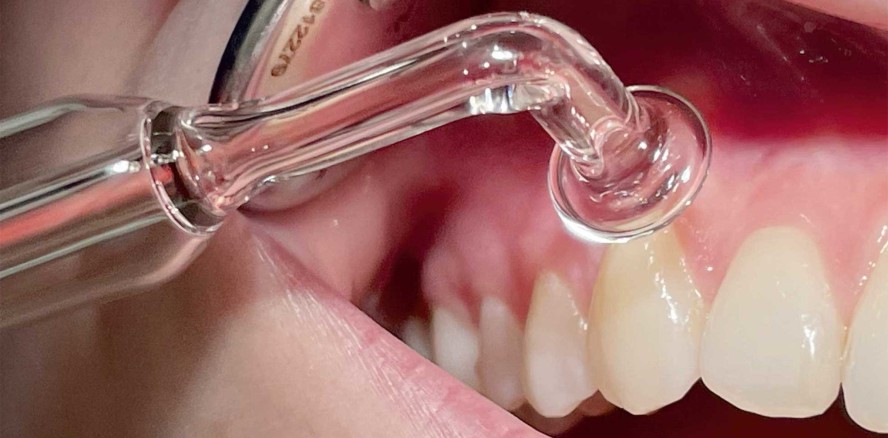
Ein für den zahnärztlichen Einsatz zugelassenes NIPP-Gerät ist das Plasma One (Plasma Medical Systems). Bei diesem Gerät wird das NIPP aus der Umgebungsluft an einer Glassonde generiert (Abb. 1). Für den zahnmedizinischen Einsatz lassen sich Glassonden unterschiedlicher Größe und unterschiedlicher Form nutzen (Abb. 1b und c).
Fazit
Auch wenn anhand der vorgestellten Kasuistiken nicht abgeleitet werden kann, dass die beobachtete Heilung exklusiv auf die Behandlung mit NIPP zurückzuführen ist, konnten wir nach der initialen Behandlung in jeder darauffolgenden Sitzung einen reizfreieren Zustand der entsprechenden Wunden beobachten. Außerdem zeigte sich bei allen Anwendungen eine eindeutige Verbesserung der Lebensqualität der Patienten. Es bleibt an dieser Stelle festzuhalten, dass in Bezug auf die dargestellten Fälle ein weiterer operativer Eingriff, z. B. zum Verschluss der Dehiszenzen, nicht mehr notwendig war. Nach unserer Einschätzung stellt der Einsatz von Kaltplasma eine effektive und kostengünstige Methode dar, die Wundheilung nach zahnärztlich-chirurgischen Eingriffen zu unterstützen.
Fallbeispiele
Fall1:
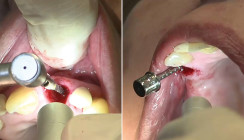
Parodontitis/ Periimplantitis (Abb. 2 a–d und 3 a–c)
Eine adjuvante Anwendung von NIPP bei Parodontitis resultierte in einer beschleunigten Abheilung der behandelten Gewebe: Bei einer 53-jährigen Patientin mit fortgeschrittener PA erfolgte nach initialem subgingivalem Debridement eine NIPP-Behandlung am 2. Tag, am 4. und am 7. Tag nach Erstvorstellung. Nach zehn Tagen exponierten klinisch keine Blutungen mehr und es zeigten sich nur noch marginale Reizungen der Gingiva am Zahnhals. Die Papillen zeigten sich dabei großteils regeneriert.
Ein 64-jähriger Patient mit eingestelltem Diabetes mellitus (Nichtraucher) stellte sich zur Kontrolle der implantatgetragenen Brücke der Unterkieferfront vor. Der Patient klagte darüber, dass sich unter der Brücke immer Essensreste sammeln würden (Abb. 3a und b). Im Zahnfilm stellte sich ein starker Knochenabbau an den beiden Implantatpfeilern der Brücke bis zu 60 Prozent dar (Abb. 3a). Da für den Patienten eine Explantation und Neuversorgung nicht infrage kam, entschieden wir uns für eine manuelle Reinigung und eine NIPP-Behandlung. Die NIPP-Applikation fand am 2. Tag, am 4. und am 7. Tag nach Erstvorstellung statt, nachdem bei der Erstvorstellung eine manuelle Kürettage durchgeführt wurde. Die Wundverhältnisse zeigten sich am Ende der Behandlung, zehn Tage nach Erstvorstellung, deutlich reizfreier, wobei ein beginnender Heilungsprozess des Weichgewebes ersichtlich war (Abb. 3c).
Ähnliche Ergebnisse konnten auch durch eine klinische Studie einer türkischen Arbeitsgruppe bestätigt werden: In einer Split-Mouth-Studie mit 25 Patienten zeigte sich nach konventioneller nichtchirurgischer Parodontitistherapie und nachfolgender adjuvanter Anwendung von Kaltplasma in der Vergleichsgruppe eine Abnahme der parodontalpathogenen Bakterien.20
Fall 2:
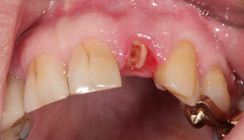
Wundheilungsstörung nach Zahnextraktion (Abb. 4a und b)
Antiinflammatorische Effekte durch NIPP konnten bei der Therapie einer Alveolitis beobachtet werden. Ein 34-jähriger Patient stellte sich 14 Tage nach Extraktion des Zahnes 37 alio loco mit ausstrahlenden Schmerzen vor. In Regio 37 zeigte sich eine Schwellung der Wundränder und ein zerfallenes Wundkoagel (Abb. 4a). Nach der initialen Wundsäuberung erfolgte am darauffolgenden Tag eine Applikation von NIPP. Am 4. Tag nach der Erstvorstellung hatten nach Angaben des Patienten die Schmerzen deutlich nachgelassen. Zusätzlich zeigte sich ein deutlicher Rückgang der Schwellung und eine Neubildung von Fibrin (Abb. 4b). Am 7. Tag erfolgte eine abschließende Kontrolle, wobei für eine weitere Behandlung mit NIPP keine Indikation mehr vorlag.
Fall 3:
Wundheilung/Bisphosphonate (Abb. 5a–f)
Eine 64-jährige Patientin mit Osteoporose und regulärer Einnahme des Bisphosphonats Alendronat stellte sich dreieinhalb Wochen nach Entfernung des Zahnes 44 und anschließender plastischer Deckung (alio loco) in unserer Klinik vor. Das Bisphosphonat war zwar unmittelbar vor der OP pausiert worden, dennoch hatte sich im Rahmen des Wundheilungsprozesses eine Dehiszenz von ca. 1 x 3 mm Durchmesser gebildet (Abb. 5a und b). Um die Bildung einer medikamentenassoziierten Osteonekrose des Kieferknochens zu verhindern, begannen wir, die Wunde zweimal wöchentlich mit NIPP zu behandeln. Im Verlauf von 5 Wochen kam es zum vollständigen epithelialen Verschluss der Wunde (Abb. 5c–e), die auch in den sich daran anschließenden klinischen Nachkontrollen stabil blieb (Abb. 5f).
Ähnliche Effekte durch NIPP konnten wir bei einem 63-jährigen Patienten mit Wundheilungsstörungen nach Zahnextraktion und anschließender plastischer Deckung bei Zustand nach multiplem Myelom und Einnahme des Bisphosphonats Zoledronat beobachten, wo es unter regelmäßiger Anwendung von NIPP innerhalb von 5 bis 7 Wochen zu einem vollständigen Verschluss aller dehiszenten Alveolen kam.10
Fall 4:
Periimplantitis mit Knochenaugmentation (Abb. 6a und b)
Zusätzlich zu den wundheilungsfördernden und desinfizierenden Eigenschaften von NIPP sind auch oberflächenaktivierende Eigenschaften beschrieben. So steigert die Applikation von NIPP die Oberflächenhydrophilie z. B. von Implantaten.21 Dies könnte auch die Einheilung im nachfolgenden Fall begünstigt haben:
Ein 67-jähriger Patient (Nichtraucher) stellte sich mit einem vertikalen Knochendefekt in Regio 22/23 vor, den wir uns entschieden, regenerativ zu behandeln (Abb. 6a). Initial erfolgten im Zeitraum von 10 Tagen – am 2. Tag, am 4. und am 7. Tag nach Erstvorstellung – NIPP-Applikationen zur Reduktion der bakteriellen Besiedlung im künftigen Operationsgebiet. Nach dieser Vorbehandlung fand der regenerative Eingriff statt, bei dem nach Kürettage Knochenersatzmaterial eingebracht wurde. Nach 3 Monaten zeigten sich klinisch entzündungsfreie Verhältnisse und eine gute Adaptation des Ersatzmaterials zwischen Zahn und Implantat (Abb. 6b).
Diese Beiträge basieren auf den Angaben der Hersteller und spiegeln nicht die Meinung der Redaktion wider.
Autoren: Dr. Benedikt Eggers, Priv.-Doz. Dr. Dr. Matthias B. Stope, Dr. Roland Röcker, Prof. Dr. Dr. Alexander Mustea und Prof. Dr. Dr. Franz-Josef Kramer
Dieser Beitrag ist unter dem Originaltitel „Zur Anwendung von nichtinvasivem physikalischem Plasma in der Zahnmedizin“ in der ZWP Zahnarzt Wirtschaft Praxis erschienen.
Ein Literaturverzeichnis finden Sie hier zum Download.