Implantologie 13.02.2013
Langzeiterfolg von Implantatversorgungen – Therapiekonzepte
share
In unserer Prophylaxearbeit begegnen wir fast täglich Patienten mit festsitzenden oder bedingt abnehmbaren Suprakonstruktionen auf Implantaten. Diese für den Patienten sehr komfortablen Versorgungen stellen höchste Ansprüche an eine adäquate Pflege und Reinigung. Der Langzeiterfolg von Implantatversorgungen hängt im Wesentlichen von der konsequenten Pflege, häuslich und professionell, ab.
Die Motivation und Instruktion des Patienten zu einer guten häuslichen Mundhygiene, das professionelle Debridement der Oberflächen von Implantaten und Aufbauteilen sowie eine konsequente Kontrolle zur Vermeidung periimplantärer Infektionen soll Aufgabe und Ziel des speziell ausgebildeten zahnärztlichen Fachpersonals (ZMP,ZMF, DH) sein. Dies kann nur mit einem ausgeklügelten Prophylaxekonzept erreicht werden. Das gesamte zahnärztliche Team ist in der Pflicht, dem Patienten mit all seinem Können und Wissen zur Seite zu stehen. Ziel dieses Artikels ist es, die Frage zu klären, welche Instrumente, Materialien und Verfahren geeignet und effektiv zur Beseitigung des pathogenen Biofilms an Implantaten sind. Außerdem wird erläutert, welche Instrumente vermieden werden sollten, um die Implantatoberflächen schonend zu bearbeiten. Der Artikel soll Grundlage für Diskussionen des bisherigen Vorgehens der Prophylaxefachkräfte bei Implantatpatienten in der Praxis bieten. Zur Aufgabe des zahnärztlichen Behandlungsteams gehört bei der regelmäßigen Kontrolle (drei bis sechs Monate, je nach Indikation) die Früherkennung von Krankheitszeichen der periimplantären Gewebe. Es werden zwei Stadien der Erkrankung unterschieden. Während die Mukositis eine reversible Entzündung der Weichgewebe ohne Knochenabbau ist, wird die Periimplantitis als Infektion des Hart- und Weichgewebes beschrieben.1 Die Mukositis muss immer ernst genommen werden, denn der Übergang von Mukositis zu Periimplantitis ist fließend. Insbesondere Patienten mit vorausgegangener Parodontitis sollen ein potenziell höheres Risiko für periimplantäre Erkrankungen haben.
Es ist bekannt, dass eine Streuung von Mikroorganismen aus periimplantären Infektionsgebieten im gesamten Organismus ein großes allgemeinanamnestisches Risiko hervorruft – ein Umstand, der von größter Wichtigkeit für die Intensität unserer Arbeit ist. Für die erfolgreiche Prävention periimplantärer Entzündungen an implantatgetragenem Zahnersatz ist demnach ein schlüssiges Behandlungskonzept, das sich aus verschiedenen Komponenten zusammensetzt, entscheidend:
1. Befundung
2. Diagnostik
3. Aufklärung, Motivation und Instruktion
4. Therapie
5. Recall
Ungeachtet der Bedeutung von Befund, Diagnose und Aufklärung beschäftigt sich dieser Artikel mit dem Bereich „Therapie“ und deren derzeitig gängigen Möglichkeiten. Ziel der Instrumentierung an Implantaten ist die komplette Entfernung von dentalem, pathologischen Biofilm und harten Ablagerungen (Zahnstein, Konkremente) sowie die Wiederherstellung eines entzündungsfreien Ausgangszustandes der periimplantären Gewebe. Dies sollte schonend für das periimplantäre Weichgewebe sein und unter Berücksichtigung der empfindlichen Oberflächen von Implantaten und der Suprakonstruktionen erfolgen. Eine Vergrößerung der Oberfläche durch Einbringen von Rillen, Kanten oder Titanabplatzungen sollte unter allen Umständen vermieden werden. Zur Dekontamination der Oberflächen kommen mechanische und/oder chemische Verfahren infrage. Das CIST-Konzept von Lang et al. zur systematischen und kontinuierlichen Vorbeugung und Behandlung periimplantärer Erkrankungen beschreibt vier Behandlungsschritte, die abhängig vom Diagnoseverlauf bei den Kontrolluntersuchungen in einer definierten Reihenfolge angewendet werden sollten:
A Mechanische Reinigung
B Antiseptische Behandlung
C Antibiotische Behandlung
D Regenerativer oder resektiver Eingriff
Im weiteren Verlauf werden ausschließlich die Behandlungsschritte A und B besprochen.
A Mechanische Reinigung (Dekontamination)
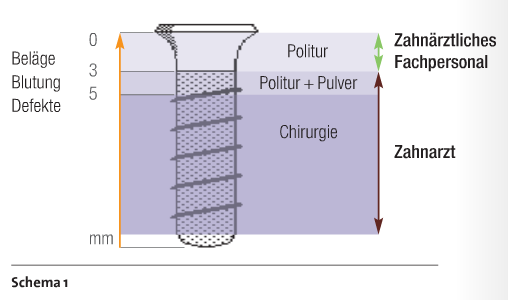
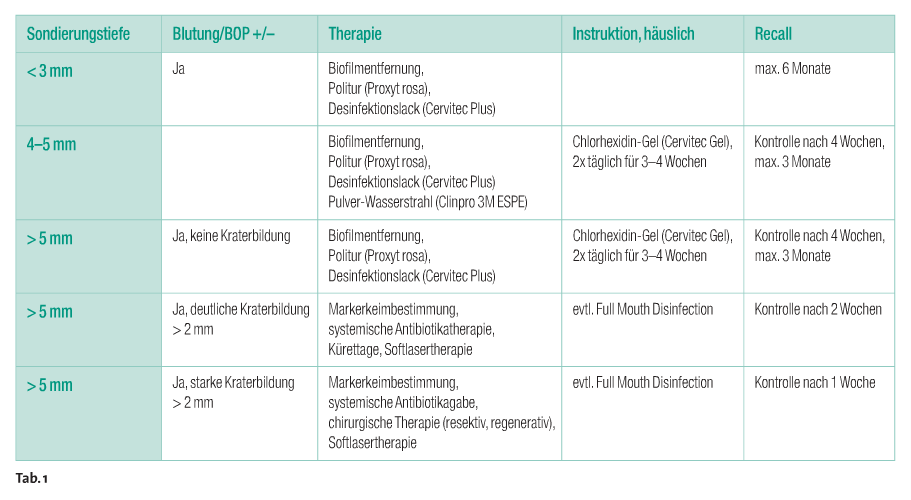
Der gründlichen Dekontamination der gesamten (infizierten) Oberfläche ist wohl die größte Sorgsamkeit zu widmen. Allein die Beseitigung von Debris in den Makrowindungen des Implantatgewindes ist sicherlich – egal mit welchem der zur Verfügung stehenden Materialien und Verfahren – eine Herausforderung. Die Form des Implantats ist dabei weniger ausschlaggebend. Schwierig ist es, die Mikrooberflächen beschichteter und auch geätzter Implantate zu dekontaminieren. Sowohl bei den maschinellen als auch bei den manuellen Verfahren gibt es verschiedene Materialien und Formen. Eine weitere Schwierigkeit stellt bei einer bestehenden Periimplantitis die Art des Defektes dar. Es ist ausschlaggebend, wie gut der Entzündungsherd erreicht werden kann. Gerade hier ist die Auswahl des geeigneten Instruments entscheidend über Erfolg oder Misserfolg. Bezüglich der Defektmorphologie muss es klare Richtlinien vom Behandler an das zahnärztliche Fachpersonal geben. So sollte aus diesen Vorgaben hervorgehen, wann die Prophylaxefachkräfte den Patienten nur zum Recall einbestellen können und wann weitere Diagnostik (DVT, ST-Index) oder gegebenenfalls eine chirurgische Intervention nötig ist (Schema 1). Die Tabelle 1 gibt einen Überblick zu möglichen Behandlungsstrategien. Zur Feststellung der Sondierungstiefen am Implantat muss darauf geachtet werden, dass periimplantäre Gewebe nicht sondiert, sondern bestenfalls intentionell „angetippt“ werden. Dies gilt nur im Falle einer Blutung.
Materialien
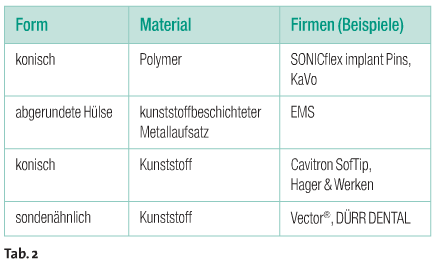
Instrumente aus Karbon, Kunststoff oder Titan, oder auch Teflonbeschichtungen stehen zur Wahl. Während Stahlinstrumente gar nicht zur Verwendung kommen sollten, können rotierende Instrumente auf beschichteten Implantatoberflächen bedingt verwendet werden. Schall- und ultraschallgestützte Instrumentierung sowie ultraschallaktivierte Partikelverfahren (Vector®) sollte allerdings der Vorzug gegeben werden (Tab. 2). Pulver-Wasserstrahl-Verfahren sind sicherlich am vielversprechendsten, möglicherweise in Kombination mit der antimikrobiellen Photodynamischen Therapie. Manuelle Verfahren können mit Scaler (supragingival), Spezial- und Universalküretten (Langer, Columbia) oder Spezialflosse erfolgen. Sowohl beim manuellen als auch maschinellen Verfahren gibt es neben den Materialien zusätzliche Unterschiede in der Ausführung und im Design.
Maschinelle Verfahren
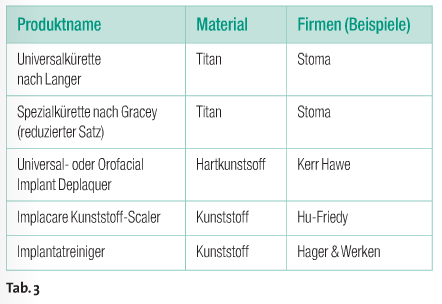
Für unebene Bereiche, wie freiliegende Gewinde (bei offenem Vorgehen), sollte die Reinigung mit einem Pulver-Wasserstrahl-Gerät (PWS) und anschließender Detoxikation mit z.B. Zitronensäure durchgeführt werden. Die Anwendung von Glycinpulver (Clinpro, 3M ESPE) hat den Vorteil, dass sich das verbleibende Pulver auflöst. Die Gefahr einer Luftembolie bei PWS-Anwendung und dem damit verbundenen Weichteilemphysem sollte durch ein vorsichtiges und kontrolliertes Vorgehen vermieden werden. Es ist zu empfehlen, ausschließlich unter Sicht zu arbeiten. Manuelle Verfahren Kunststoffscaler und -küretten haben den Vorteil, dass sie als Einmalprodukte angeboten werden (Tab. 3). Erfahrungsgemäß können jedoch Überstände (Abb. 1) bei der Herstellung an den Arbeitsenden verbleiben. Dies kann zu Verletzungen führen, weshalb die Spitzen vor dem Gebrauch kontrolliert werden sollten. Zu bedenken ist eine mögliche Spanbildung am Instrument sowie an der Implantatoberfläche selbst. Momentan kann noch keine klare Aussage dazu gemacht werden, ob sich diese Späne im Gewebe ablagern und zu Inflammationen führen. Studien hierzu sind in Arbeit. Diese sollen klären, bis zu welchem Grad die Oberfläche poliert werden kann und welche Art von Schleif- oder Poliermittel dabei der Vorzug zu geben ist. Carbonfaserinstrumente sollten ebenfalls als Einmalinstrumente verwendet werden. Laut Hersteller ist eine chemisch-thermische Desinfektion und anschließende Sterilisation möglich. Diskutiert wird in Fachkreisen jedoch, ob bei der porigen Oberfläche tatsächlich eine hundertprozentige Sterilität erreicht werden kann. Um sicherzugehen, dass keine Restkeime auf dem Instrument sind und um langfristig Kosten zu sparen, hat sich in unserer Praxis und in verschiedenen Universitätskliniken der Einsatz von Titaninstrumenten durchgesetzt (Abb. 2). Die zunächst kostspielige Anschaffung amortisiert sich durch eine hohe Langlebigkeit und hygienische Sicherheit. Ein Aufschleifen ist mit einem Keramikschleifstein möglich. Dies ist nur erforderlich, um die bei häufiger Benutzung auftretende Veränderung der Grundform des Instruments wieder herzustellen.
Bei den oben genannten instrumentellen Möglichkeiten der Bearbeitung von Implantatoberflächen gibt es folgende Gefahren:
– Titantätowierungen, ähnlich wie Amalgamtätowierungen, können durch den invasiven Einsatz der Instrumente hervorgerufen werden. Insbesondere bei der Bearbeitung mit Stahlinstrumenten kann es zu Titanabplatzungen kommen (Abb. 3 bis 5).
– Polierkörperanteile oder Reste von Kunststoff- oder Karboninstrumenten können im marginalen Bereich des periimplantären oder lymphatischen Gewebes verbleiben. Theoretisch kann dies zu potenziellen, unerwünschten biologischen Effekten führen. Jedoch hält die Literatur bisher keine gesicherten Hinweise bereit.
Therapeutische Politur
Die therapeutische Politur beinhaltet die Entfernung von weichen Belägen supra- und subgingival mit geeigneten Polierkörpern und Pasten. Die Politur dient der Forderung nach möglichst hundertprozentiger Plaquefreiheit.
1. Polierpasten und Polierhilfsmittel
Jede Art der Politur geht – je nach Schleifkörperbeschaffenheit – mit einer Abtragung von Oberfläche (z.B. Zahnhartsubstanz, Aufrauung) einher. Um den Abtrag auf ein Minimum zu reduzieren und einen möglichst hohen Politureffekt zu erhalten, muss bei der Auswahl der Polierpasten indikationsbezogen vorgegangen werden. Im Falle der Implantatoberflächen muss unterschieden werden, welcher Teil poliert werden soll – ob beispielsweise der Implantatpfosten und die Suprakonstruktion oder eventuell freiliegende Implantatgewinde. Grobkörnige Pasten sind kontraindiziert. Zur Anwendung kommen möglichst feine Pasten (Proxyt 7/Ivoclar Vivadent, Super Polish/Kerr Hawe), um einen Hochglanz der Oberflächen zu erzielen (Abb. 6). Grundsätzlich sollten Polierpasten folgende Kriterien erfüllen:
– hohe Reinigungseffizienz,
– geringe Abrasivität und
– hohe Polierwirkung.
Geeignete Polierkörper gibt es inzwischen in großer Auswahl. Hierbei sollte auch die allgemeine Anamnese des Patienten beachtet werden. Liegt zum Beispiel eine Latexallergie vor, sollte beim Polierkörper die latexfreie Variante verwendet werden. Im Allgemeinen sollte ein Polierkörper flexibel und weich sein (Vorteil: Biofilmentfernung bis zu 2mm im Sulkus) und mehrere Kammern haben, um die Polierpaste halten zu können.
Darüber hinaus ist bei der Politur auf Folgendes zu achten:
– eine nur kurze Kontaktzeit (max. zwei bis drei Sekunden) des Polierkörpers mit dem Implantat bzw. der Suprakonstruktion,
– eine Polierrichtung von Winkellinie zu Winkellinie und von Polierabschnitt zu Polierabschnitt,
– eine Umdrehungszahl pro Minute (=rpm: rotations per minute) zwischen 5.000 und 8.000rpm und
– einen nur leichten Andruck gegen die Implantatfläche von circa 100 bis 150 Pond (die Ränder des Napfes biegen sich leicht auf).
2. Politur der Okklusalverschraubung
Mithilfe von Polierbürsten aus Nylon können die Okklusalflächen von Verschraubungen gereinigt werden.
3. Politur der Implantat- und Zahnzwischenräume
Zur Politur der Implantat- und Zahnzwischenräume stehen verschiedene maschinell betriebene Interdentalbürsten zur Verfügung, die zusätzlich mit Polierpaste oder CHX-Gel bestückt werden können. Außerdem wird unter Brückengliedern, Geschieben, Stegen und um Implantatkronen mit dickem Spezialfloss, wahlweise auch mit Polierpaste oder CHX-Gel gereinigt und geglättet (Abb. 7).
4. Politur (Reinigung) der Zunge
Zwischen 60 bis 80 Prozent der Keime in der Mundhöhle werden der Zunge zugeschrieben. So sollte ein wesentlicher Bestandteil der Mundhygiene auch und gerade die Zunge betreffen. Eine professionelle Zungengrundreinigung (Abb. 8) ist obligat und muss fester Bestandteil jeder Prophylaxesitzung sein.
Durchführung:
– Weiche Nylon-Polierbürste mit CHX-Gel bestücken,
– niedertouriges Polierwinkelstück aufsetzen,
– Gazetuch(7,5 x 7,5cm) befeuchten,
– Zunge des Patienten herausstrecken lassen und mithilfe der Gaze halten (nicht ziehen oder drücken),
– mit leichtem Druck im vorderen Drittel der Zunge serpentinartige Bewegungen auf der Zunge durchführen,
– zwischendurch den gelösten, im Gel gebundenen Zungenbelag entfernen,
– erneut Bürste mit CHX-Gel bestücken und das mittlere sowie hintere Drittel bearbeiten und
– den Vorgang so lange wiederholen, bis die Zunge belagfrei ist.
B Antiseptische Behandlung
Die chemische Dekontamination kann mittels Chlorhexidindigluconatpräparaten (CHX) in Form von 0,1 bis 0,2% Lösungen, Gel 1% oder Lack), Zitronensäure, Natriumchlorid, Phosphorsäure, Kupfer-Kalziumhydroxid (Cupral®/Humanchemie)* oder sulfonierten Phenolen und Schwefelsäure (Biofilm-Remover/HybenX®)** erfolgen. CHX zählt als Antiseptika zu den gebräuchlichsten Wirkstoffen. Es ist in seiner Wirkung intensiv und ausgesprochen stark. Die Spülung des periimplantären Defekts sollte mindestens eine Minute drucklos, intermittierend durchgeführt werden. Hierfür sind die aus der Endodontie bekannten Kanülen mit lateralem Austritt und abgerundetem Ende (Firma B. Braun) geeignet. Ebenfalls die Anwendung von in CHX (0,2%) und isotonischer Kochsalzlösung getränkten Gazestreifen, die im Wechsel eingebracht werden, ist wirkungsvoll. Dies gilt insbesondere für titanplasmabeschichtete und sandgestrahlte bzw. säuregeätzte Oberflächen. Bei der anschließenden Anwendung eines Lackes (Cervitec plus-Lack®, Ivoclar Vivadent) haben wir den Vorteil der synergetischen Wirkung von CHX 1% und Thymol 1% zu einer Desinfektionslösung von rund 10% für die Dauer von nachgewiesen drei Monaten (siehe Studien zu Cervitec-Lack).2,3 Die Anwendung schließt sich an die professionelle Reinigung und Politur an. Interessant an dieser Stelle ist die Anwendung eines Wirkstoffkomplexes auf Sulfat- und Schwefelbasis. Durch Penetrieren des dentalen Biofilms mit dem Dentalfluid HybenX wird dem Biofilm das Wasser entzogen (Dehydrierung) und die Bakterien verlieren ihr Habitat (Lebensraum). Gleichzeitig kommt es zum Kollaps der Matrix und der Ablösung des Biofilms. Das Einbringen des Dentalfluids erfolgt mit einer Spülspritze. Nach einer Einwirkzeit von maximal 20 Sekunden wird es mit Wasser ab- und ausgespült. Die Anwendung kann sowohl vor als auch nach dem maschinellen bzw. manuellen Scaling erfolgen (Abb. 9). In unabhängigen US-Studien konnte eine erkennbare Verringerung der Plaque und Biofilmneubildung innerhalb 90 Tagen nachgewiesen werden. Cupral® (Humanchemie) liegt als wasserhaltige Paste vor und ist in der Kategorie der Breitbandtherapeutika einzugliedern. Seine Wirksamkeit gegenüber Aerobiern, Anaerobiern, Pilzen und deren Sporen ist aufgrund des hohen pH-Wertes von >12 und der hohen Anzahl von Cu-Ionen gegeben. Zur Behandlung von parodontalen und periimplantären Taschen wird z.B. ein Retraktionsfaden (Gr.1, 2) mit der Salbe bestückt. Der Faden wird in die Tasche eingebracht und der Tascheneingang z.B. mit Reso-Pac® (Hager & Werken) verschlossen. Für zwei bis drei Tage bleibt diese Einlage in der Tasche, bevor sie entfernt oder gegebenenfalls ausgetauscht wird (Abb. 10).
Für die Anwendung chemischer Verfahren gilt in der Regel: Biofilm „aufreißen“. Auch der beste Wirkstoff hat in der Regel keine Chance, wenn die komplexe Struktur des Biofilms vorher nicht zerstört wurde – entweder mit maschinellen und/oder manuellen oder chemischen Verfahren. In der professionellen und auch häuslichen Anwendung hat sich die Bestückung eines Spezialfloss (meridol®) mit CHX-Gel 1% bewährt. Das Implantat kann damit umschlungen werden und schonend auch unterhalb der Gingivagrenze gereinigt werden.
Therapiemöglichkeiten mit Softlaser
Eine weitere moderne Variante stellt die antimikrobielle Photodynamische Therapie (aPDT) dar. Es handelt sich hierbei um ein Softlaserverfahren, bei dem durch photochemischen Prozess die Keimabtötung erreicht wird. Eine lichtaktive Farbstofflösung (Photosensitizer: Phenothiazinchlorid) wird in die Tasche eingebracht, diese diffundiert in den Biofilm und lagert sich an den Bakterienzellwänden an. Nun wird mit einem Softlaser der Farbstoff aktiviert. Es entstehen Oxidationsmittel (Singulett-Sauerstoff), die irreversible Schäden an der Bakterienmembran hinterlassen. Diese Behandlung ist für den Patienten schmerzfrei. Auch hier muss vor der Durchführung der aPDT ein sinnvolles Biofilmmanagement durchgeführt werden (maschinell/manuell).
Zusammenfassung
Die Behandlung periimplantärer Strukturen, der Implantatoberfläche und der Suprakonstruktion erfordert ein hohes Wissen im Umgang mit Instrumenten, Materialien und Verfahren. Wie in allen anderen Bereichen der Behandlungen ist es der „Meistereffekt“, der darüber entscheidet, ob die Therapie minimalinvasiv, schonend, effektiv und damit erfolgreich ist.




















