Parodontologie 18.03.2015
Parodontalbehandlung nicht ohne Nachsorge
share
Häufig hört man von Patienten, aber auch von Kollegen die Aussage, dass eine Parodontalbehandlung zwar nach der Behandlung gute Ergebnisse aufgewiesen habe,1 dass aber spätestens nach zwei Jahren wieder die Ausgangsbefunde vorliegen würden. Auf Nachfrage zeigt sich dann, dass keine Nachsorge betrieben wurde. Entweder wurde dem Patienten die Sinnhaftigkeit nicht deutlich (gemacht), es lag eine mangelnde Compliance vor, die Kosten waren den Patienten zu hoch oder das vereinbarte Recall wurde schlicht als lästig empfunden.
Dabei ist bekannt, dass bei einer effektiven Mundhygiene – bis auf wenige Ausnahmen – das Risiko, ein Parodontitisrezidiv zu entwickeln, recht gering ist. Wird diese jedoch nicht betrieben bzw. in einem adäquaten Recall mit Reinstruktion und Remotivation kontrolliert, kommt es schnell zu einer bakteriellen Besiedlung der Oberflächen und einer erneuten manifesten Entzündung, in deren Verlauf das epitheliale Attachment, das durch die systematische Parodontitistherapie gewonnen wurde, wieder verloren geht. Aus dem Saumepithel entsteht das Taschenepithel bzw. Taschenbildung mit Attachmentverlust.2 Die Nachsorge hat nun zum Ziel, dies zu verhindern, wobei sich die UPT-Intervalle nach der Gefährdung des Patienten, dem sog. Parodontitisrisiko und der Beherrschung der Zahnpflege durch den Patienten richten. Bewährt hat sich die Bestimmung des individuellen Parodontitisrisikos nach Ramseier und Lang3 sowie Land und Tonetti4; denn das Parodontitisrisiko steigt mit der Anfälligkeit des Patienten für Parodontitis, da sowohl auf Bindegewebe- und Knochenstoffwechsel die immunologische Reaktion von den prädisponierenden Faktoren abhängt (Tab. 1).5
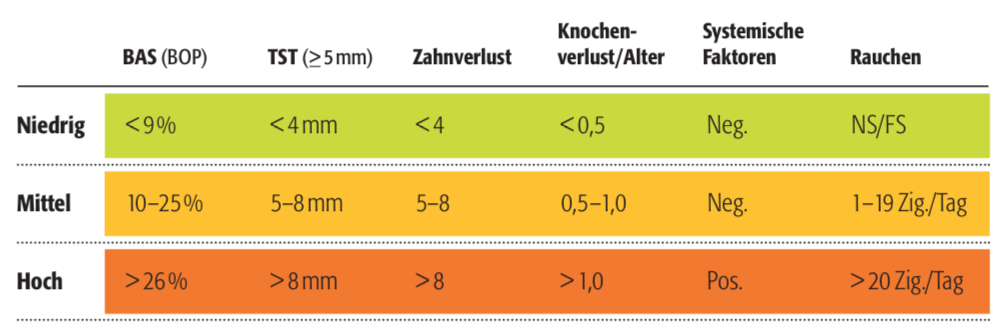
Tab. 1: Risikofaktoren und deren Wert für die Risikobestimmung des Patienten nach Lang und Tonetti.
Risikoanalyse
In der Risikoanalyse werden sechs Parameter berücksichtigt:
- 1. Bluten auf Sondieren (BAS) oder Bleeding on Probing (BOP)
- 2. Anzahl der Taschen mit Sondierungstiefen ≥ 5 mm
- 3. Anzahl der verlorenen Zähne (ohne Weisheitszähne)
- 4. Prozentueller Knochenverlust in Relation zum Alter des Patienten gemessen an der ausgeprägtesten Stelle eines Molaren
- 5. Systemisch/genetische Erkrankungen
- 6. Umweltfaktoren wie Rauchen
Verändert der Patient seine individuelle Mundhygiene und/oder seinen Nikotinkonsum, kommen systemische/genetische Erkrankungen hinzu (Anamnese mindestens ein Mal jährlich aktualisieren!), so ändert sich das individuelle Risikoprofil und die Zeitabstände zwischen zwei UPT-Terminen werden entsprechend angepasst. Da noch nicht alle Faktoren, die die Parodontitis beeinflussen, bekannt sind, spielt auch die Beurteilung durch einen erfahrenen Parodontologen eine entscheidende Rolle.
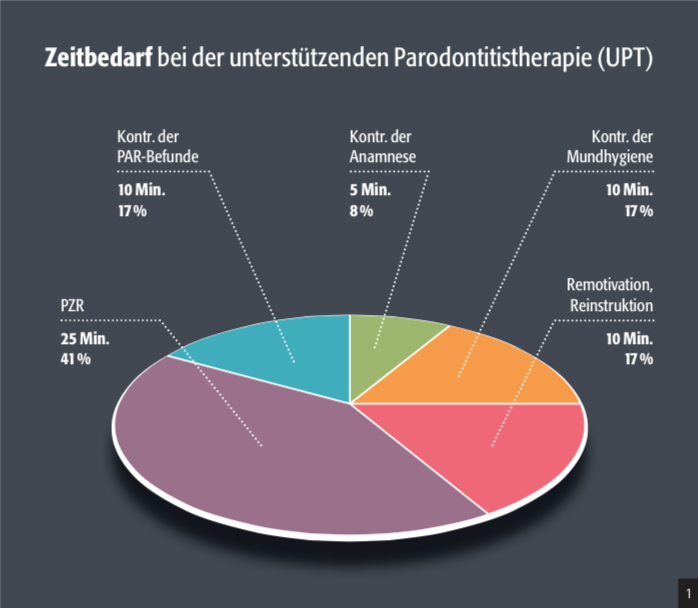
Die folgenden Maßnahmen werden im Rahmen der UPT regelmäßig durchgeführt:
- Kontrolle der individuellen Mundhygiene
- Remotivation und Reinstruktion
- Professionelle Zahnreinigung
- Kontrolle der Parodontalbefunde
- Evtl. subgingivale Instrumentierung
- Weiterführende Therapie
- Vor- und Nachbereitung des Arbeitsplatzes (Abb.1)
Aufgrund der großen Bedeutung der Mundhygiene wird dieser besondere Aufmerksamseit gewidmet. Zur Beurteilung der individuellen Mundhygiene kann ein einfacher Index wie der API (Approximalraum Plaque-Index), bei dem die Plaque im Approximalraum dichotom eingetragen wird, verwandt werden.6 Genauer ist beispielsweise der PCR (Plaque Control Record).7 Um spezifische Schwachstellen aufzuzeigen, ist besonders das Anfärben des bakteriellen Zahnbelages mittels Relevatoren zur Remotivation und Instruktion geeignet. Die Auswertung der Blutungsneigung zeigt den Entzündungszustand und damit die über einen längeren Zeitraum erhöhte mikrobielle Plaquebesiedlung.8 Prozentangaben erleichtern dem Patienten den Vergleich.
Zur PZR (professionellen Zahnreinigung) gehört neben der vollständigen Entfernung aller harten und weichen supragingivalen und gingivalen Zahn- und Wurzelbelägen, eingeschlossen die Reinigung der Zahnzwischenräume, das Entfernen des Biofilms und die abschließende Politur mit Polierpasten abfallender Abrasivität mit Fluoridierung. Die Entfernung von Zahnverfärbungen wie Raucher- oder Teebelägen haben in erster Linie eine kosmetische Bedeutung.
Die Durchführung der UPT kann zum großen Teil durch eine dafür ausgebildete Praxismitarbeiterin erfolgen, aber der Zahnarzt hat regelmäßig die Parodontalerkrankung zu beurteilen und die Anamnese zu besprechen. Dabei sollte nicht vergessen werden, dass veränderte Medikationen oder weitere Erkrankungen häufig nur nach gezielter Fragestellung zugegeben werden. Keinesfalls reicht eine regelmäßige PZR alleinig aus. In einem Recallsystem, bei dem die Messungen des Attachmentverlustes nicht nachgemessen werden, nimmt die Parodontitis unvorhersehbar zu.9
Hat die Kontrolle der Parodontalbefunde ergeben, dass eine umfangreiche subgingivale Instrumentierung oder eine weiterführende Therapie notwendig sind, so empfiehlt es sich, dafür einen weiteren Termin zu vereinbaren. Patienten, die bereits im Zusammenhang mit der Parodontitisbehandlung ein subgingivales Scaling und eine Wurzelglättung mit Handinstrumenten erfahren haben und sich nun regelmäßig im Recall befinden, laufen Gefahr, dass durch die wiederholte Instrumentierung viel Zahnsubstanz abgetragen wird.
Ultraschall- und Pulverstrahlgeräte
Da in der unterstützenden Therapie das Ziel verfolgt wird, die subgingivale Plaque10 zu beseitigen, vorausgesetzt, dass eine adäquate aktive Parodontitistherapie mit Reinigung der harten mineralisierten Auflagerungen durchgeführt wurde, werden nun die weichen subgingivalen Beläge entfernt. Hier empfiehlt sich daher der Einsatz spezieller Ultraschallgeräte (Vector®, DÜRR DENTAL AG, Bietigheim-Bissingen) oder Pulverstrahlgeräte mit besonderem Pulver (EMS® Air Flow S1, EMS, Nyon, Schweiz), mit denen der sog. Biofilm, d.h., die vitale Plaque entfernt werden kann. Zur Entfernung von Zahnstein und Konkrementen sind diese Geräte allerdings nicht geeignet. Wegen der hohen Abrasivität des aus Natriumhydrogenkarbonat bestehenden Pulvers der Pulverstrahltechnik, die der Entfernung extrinsischer Zahnverfärbungen dient, wird dieses Pulverwasserstrahlgerät nicht bei freiliegenden Wurzeloberflächen und im subgingivalen Bereich, zumal darüber hinaus die Gefahr einer Emphysembildung besteht, eingesetzt. Das minimalabrasive Pulver aus Glycin ist hingegen sehr gut zur schonenden subgingivalen Plaqueentfernung aus Taschen bis zu 5 mm Tiefe geeignet.11 Zudem übt das Strahlverfahren keine negativen Effekte auf das umgebende Weichgewebe aus. Grimm konnte zeigen, dass mit der oben genannten ebenfalls schonenden Ultraschalltechnik ähnliche Ergebnisse zu erzielen sind.12
Therapie bei Furkationsbeteiligung
Furkationsbeteiligte Zähne stellen eine besondere Herausforderung dar. Dabei kommt dem Ausmaß der Furkationsbeteiligung (FI–FIII) eine besondere Bedeutung zu. Sie zu sondieren und diagnostizieren oder röntgenologisch darzustellen, ist häufig schwierig. Noch schwieriger ist es, sie entsprechend zu reinigen oder zu therapieren. Akzessorische Kanäle, die in den Furkationsbereich münden, können blind enden, aber auch Verbindungen zum lateralen Parodont aufweisen.10 Es ist vorstellbar, dass die Ausgänge den Bakterien genügend Volumen zur Ausbildung bzw. Unterhaltung einer entzündlichen Läsion im Furkationsbereich bieten.
Lokale Antiseptika und Antibiotika
Bei bakteriell entzündlichen Erkrankungen des Zahnhalteapparates kann im Zusammenhang mit supra- und subgingivalem Debridement eine systemische Antibiotikagabe sinnvoll sein. Systemische Antibiotika haben den Vorteil, auch Infektionsnischen zu erreichen. Die Indikation im Rahmen der UPT wäre bei Parodontitiden, die trotz vorangegangener Therapie progrediente Attachmentverluste aufweisen, gegeben. Im Recall kommen jedoch bevorzugt lokale Antibiotika bei Patienten mit einzelnen persistierenden oder rezidivierenden Taschen mit Sondierungstiefen ab 5 mm und BOP – meist in Kombination mit der mechanischen Instrumentierung – zum Einsatz. Damit wird eine hohe Wirkstoffkonzentration, ohne den Gesamtorganismus zu belasten, erreicht. Auch ist hier das Risiko der lokalen Antibiose im Gegensatz zur systemischen Gabe mit Sensibilisierungs- und Resistenzbildung sowie systemischen Nebenwirkungen gering.
In der Tasche führt jedoch die hohe Umsatzrate zu einer raschen Reduktion von subgingival applizierten Antiseptika oder Antibiotika. Daher wurden stabile subgingivale Depots entwickelt, aus diesen wird kontinuierlich und in wirksamer Konzentration das Antibiotikum bzw. das Antiseptikum abgegeben. Die Darreichungsform sollte einfach und das Material biologisch abbaubar sein. Ein solcher biologisch abbaubarer Medikamentträger ist der PerioChip® (Dexxon Ltd, Hadera, Israel; Vertrieb Dexcel Pharma, Alzenau) (Abb. 2). Der aus Gelatineglutaraldehyd-Polykondensat, Glyzerin, gereinigtem Wasser und 34%igem Chlorhexidinbis (D-Glukonat) bestehende Chip wird mit einer zahnärztlichen Pinzette appliziert. Zwei Stunden nach der Insertion beträgt die CHX-Konzentration in der Sulkusflüssigkeit etwa 2007 μg/ml. Bis zum fünften Tag sinkt die Konzentration auf ca. 1.400 bis 1.900 μg/ml ab. Da die Konzentration nach sieben Tagen noch bei 125 μg/ml liegt, kann von eine Minimalen Inhibitorischen Konzentration (MIC 90) verschiedener Parodontopathogene über eine Woche ausgegangen werden.13 Meyle et al. konnten in ihren Untersuchungen zum PerioChip® zeigen, dass die zusätzliche Verwendung des PerioChips® zum subgingivalen Scaling und zur Wurzelglättung die klinischen Ergebnisse in Bezug auf die mikrobiologischen Parameter und klinischen Zeichen einer Parodontitis verbesserten.14 Bei Nachsorgepatienten führte die zusätzliche Applikation zu einer kontinuierlichen Sondierungstiefenreduktion.15 Da schwerlich an allen erkrankten parodontalen Taschen im Rahmen der antiinfektiösen Therapie PerioChips® eingebracht werden können, empfiehlt sich das Verfahren insbesondere bei der Nachsorge/UPT, bei Vorliegen einzelner Restinfektionen auch im Furkationsbereich. Auch wenn die Wirksamkeit des Chlorhexidins mit höchster Evidenz nachgewiesen wurde, kann es doch zu unerwünschten Nebenwirkungen kommen. Hier sind Parodontalabszesse, wenn auch selten, zu nennen.
Gemäß der Stellungnahme der Deutschen Gesellschaft für Zahn-, Mund- und Kieferheilkunde sollten nur solche Antibiotika lokal appliziert werden, die in geeignete Trägersubstanzen eingebettet für die parodontale Tasche und die dort vorherrschenden Bedingungen entwickelt worden sind. Auch hier ist die Hauptindikation bei persistierenden bzw. rezidivierenden Taschen von UPT-Patienten nach Entfernung des Biofilms. Für ein 14%iges Doxycyclin-Gel konnte sowohl ein zusätzlicher klinischer Effekt zur nicht chirurgischen Parodontitistherapie als auch eine ausreichende Pharmakokinetik über einen Zeitraum von einer Woche nach Einbringen des Gels gezeigt werden.16
Doxycyclin und Minocyclin, beides Tetracyclinderivate, entfalten nicht nur eine antimikrobielle Wirkung, sie hemmen vielmehr auch die Bildung von Matrix-Metalloproteinasen, inhibieren die Knochenresorption und wirken sich damit positiv auf die Reaktion des Wirtsgewebes aus.17 Jedoch sollte man nicht unreflektiert ein lokales Antibiotikum in die Taschen einbringen, da eine flächendeckende Anwendung verstärkt systemisch wirkt und zu Resistenzen sowie zu oxidativem Stress in den Körperzellen des Wirtes führen kann.
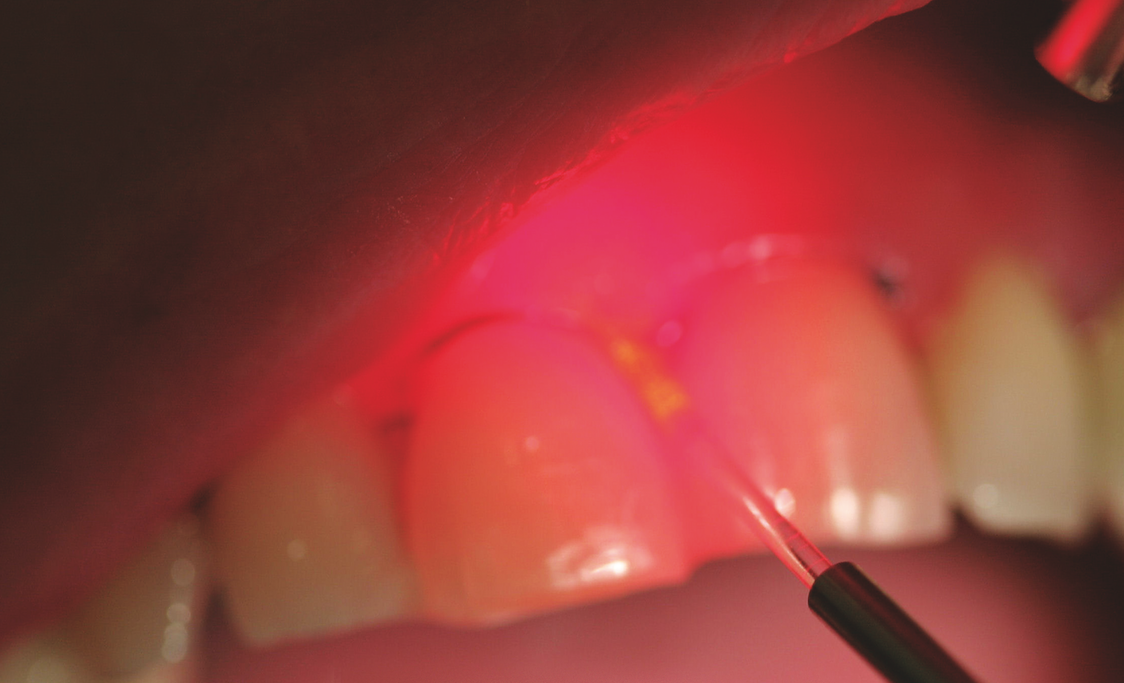
Abb. 3: Bei der aPDT werden Mikroorganismen mittels Photosensibilisator und Laser abgetötet.
Die antimikrobielle Photodynamische Therapie (aPDT)
Zur Elimination des verursachenden Biofilms stehen unterschiedliche lichtbasierende Verfahren zur Verfügung. Eine Therapie des selektiven Abtötens von Mikroorganismen in der parodontalen Tasche mittels antimikrobieller Photodynamischer Therapie funktioniert wie folgt: Ein Photosensibilisator bindet sich an die Zielzelle und wird mit Licht einer passenden Wellenlänge aktiviert. Dadurch entstehen Singulett-Sauerstoff und weitere hochreaktive Sauerstoffspezies, die toxisch unter anderem auf Bakterien,18,19 wahrscheinlich vornehmlich auf die zytoplasmatische Membran,20 wirken. Als Lichtquelle eignen sich Laser niedriger Leistungsdichte, die ein Licht liefern, das auf das Absorptionsmaximum des Photosensibilisators abgestimmt ist.21 Da der Singulett-Sauerstoff nur eine kurze Lebensdauer hat, findet die photodynamische Reaktion nur in nächster Nähe zum Photosensiblisator statt, wirkt also deutlich lokal begrenzt und ist daher nebenwirkungsarm. Nach der Entfernung aller Auflagerungen – die aPDT trägt keine mineralisierten Auflagerungen ab – kann die Photodynamische Lasertherapie als adjunktive Maßnahme angewendet werden. Dazu wird der Photosensibilisator direkt in die parodontale Tasche eingebracht, die optische Faser wird in die Tasche plaziert, und anschließend wird der Photosensiblisator aktiviert (Abb. 3). Als Photosensibilisatoren kommen in erster Linie die Phenothiazinfarbstoffe Toluidinblau O und Methylenblau zum Einsatz, da beide grampositive und gramnegative parodontopathogene Keimen inaktivieren können.22, 23
Klinische Studien
Obwohl etliche Studien zur aPDT vorliegen, so gibt es noch begrenzte Evidenz aus randomisierten kontrollierten Studien. Häufig ist die Patientenzahl zu gering oder der Beobachtungszeitraum zu kurz. Eine Fünf-Jahres-Studie mit 70 Patienten zur Überprüfung des klinisches Effektes der aPDT nach dem HELBO®-Verfahren an 1.683 Zähnen zeigte einen signifikanten Rückgang der parodontopathogenen Keimbelastung, geringere Sondierungstiefen und eine verringerte Blutungsneigung.24 Die Autoren bestätigen mit ihrer Untersuchung die Wirksamkeit des Therapieansatzes nach dem HELBO®-Verfahren. Da aber Art, Konzentration und Darreichung des Photosensitivers, die Lichtquelle, Wellenlänge etc. variieren, können die Ergebnisse nicht ohne Weiteres auf andere photodynamische Therapiesysteme übertragen werden. Da die momentane Datenlage noch nicht ausreichend – wenn auch vielversprechend – ist, gilt es weitere Studien abzuwarten, ehe die aPDT als Alternative von antibiotisch wirksamen Substanzen gesehen werden kann, zumal noch nicht gesichert ist, ob die aPDT klinisch in der Lage ist, parodontopathogene Keime wie Porphyromonas gingivalis oder Aggregatibacter actinomycetemcomitans zu hemmen.21
Zusammenfassung
Um die parodontale Situation langfristig stabil zu erhalten, muss sich an die aktive Therapiephase eine lebenslange Betreuung des Patienten in Abhängigkeit von der Risikoeinschätzung anschließen. In diese Langzeitbetreuung ist das gesamte Team eingebunden: die Dentalhygienikerin, aber auch der Zahnarzt sichern erst gemeinsam mit dem Patienten den langfristigen Behandlungserfolg, handelt es sich doch um eine chronische Erkrankung. Bei konsequenter UPT kann ein langfristiger Erfolg der parodontalen Behandlung stabilisiert und der Verlust von Zähnen verhindert werden. Zur Therapie einzelner Rezidive können die oben genannten Materialien und Techniken dienen. Auch die Zusammenhänge von Parodontitis und Allgemeinerkrankung verpflichten zur lebenslangen Nachsorge.
Hier gibt es die vollständige Literaturliste










