Prophylaxe 16.11.2015
Patienten unter Tumortherapie: Intensive Betreuung der Mundhöhle
share
Teil 1
Viele Tumortherapien haben einen Einfluss auf die Mundhöhle und ihre verschiedenen Gewebe und Funktionen. Die Komplexität der Therapien und ihrer Risiken und Nebenwirkungen nehmen immer mehr zu. Für eine Zahnarztpraxis, in der oft nur wenige Patienten pro Jahr von einer Tumorerkrankung betroffen sind (und dann noch mit jeweils einer anderen), und wo häufig nur wenig Informationen durch die onkologischen Behandler ankommen, ist dies eine besondere Herausforderung. Die vorliegende Artikelserie soll einen Überblick über besondere Probleme der zahnärztlichen Behandlung onkologischer Patienten geben und für das gesamte Team eine Sensibilisierung bezüglich potenzieller Probleme schaffen.
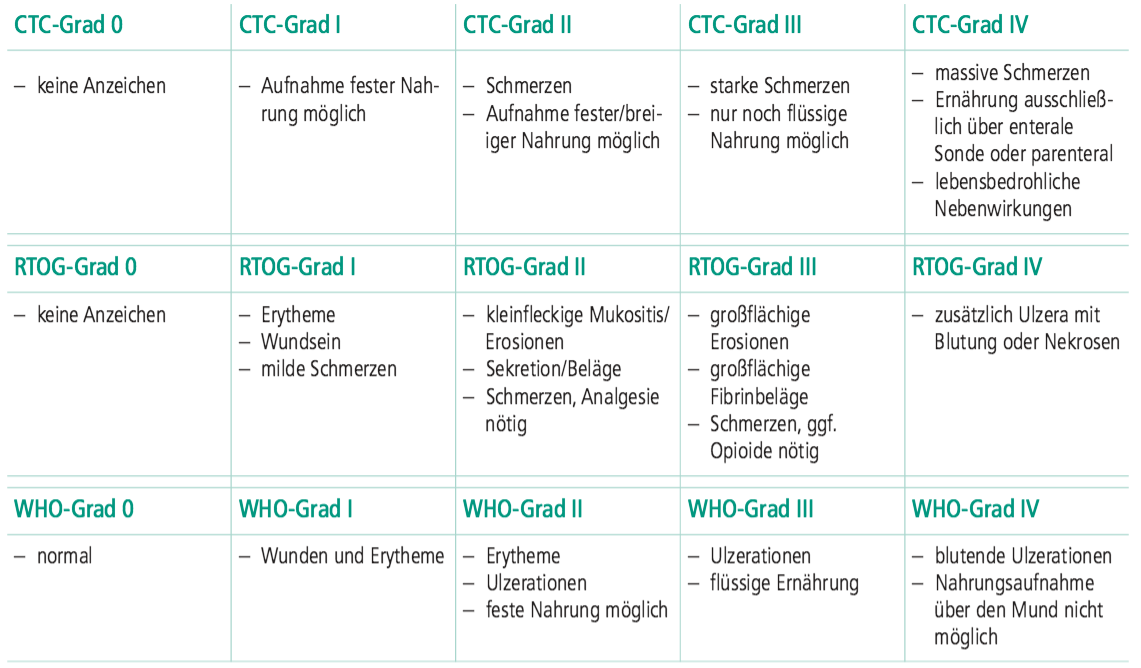
Kopf-Hals-Tumoren (Abb. 1) werden häufig primär operiert. In Frühstadien reicht die alleinige Operation des bösartigen (= malignen) Tumors, in fortgeschrittenen Stadien folgt der Operation eine adjuvante Radiochemotherapie zur Prophylaxe des Lokalrezidivs (Durchführung einer Strahlentherapie mit zeitgleicher Chemotherapie zur Vorbeugung des Wiederauftretens der Erkrankung im primär befallenen Bereich). Diese sollte elf Wochen nach der Operation abgeschlossen sein und beinhaltet meist ca. 30 Bestrahlungen (27–33 Termine, an jedem Wochentag, möglichst ohne Unterbrechung). In sehr fortgeschrittenen oder inoperablen Fällen erfolgt eine primäre, also alleinige, Radiochemotherapie ohne Operation. Ab und an kann dies auch in Frühstadien zur Heilung bei gleichzeitigem Organerhalt eingesetzt werden, z.B. bei manchen Formen von Kehlkopfkrebs. Diese primäre Therapie ist dann aggressiver, es werden höhere Dosen über einen längeren Zeitraum gegeben, womit das Risiko für Nebenwirkungen der Therapie steigt. Die primär wirksame Komponente in dieser Therapie ist die Bestrahlung; die begleitende Chemotherapie wird zur Radiosensibilisierung eingesetzt, also um die Zellen empfindlicher gegen Bestrahlung zu machen. Die Wirkung der Bestrahlung beruht auf dem Abtöten von Tumorzellen. Das Risiko für das Wiederauftreten wird relevant gesenkt. Wie hoch der jeweilige Prozentsatz ist, hängt vom individuellen Risiko ab. Da mit dem Wiederauftreten häufig eine schlechte Prognose verbunden ist, eine Tumorheilung im zweiten Anlauf weniger wahrscheinlich, das Risiko für Fernabsiedlungen jedoch deutlich höher ist, wird durch die adjuvante Therapie auch das Gesamtüberleben verlängert. Auf diesem Hintergrund nimmt man bei der Therapie auch das Risiko ausgeprägter akuter Nebenwirkungen und eben auch klinisch relevanter Spätfolgen in Kauf.
Nebenwirkungen der Bestrahlung
Man unterscheidet frühe und späte Strahlenfolgen. Als früh bezeichnet man alles, was während oder 90 Tage nach Beginn einer Bestrahlung auftritt. In der Regel sind dies Effekte an Geweben mit hoher Zellteilungsrate – d.h. Haut und Schleimhäute. Spätfolgen entstehen über einen anderen Mechanismus meist in anderen Geweben – Knochen, Bindegewebe, Funktionsgewebe. Diese können entweder als Folge schwerer akuter Nebenwirkungen (consequential late effects) oder aber auf dem Boden langsam fortschreitender, davon unabhängiger Gewebsveränderung auftreten (Fibrose, Endothelproliferation, Gefäßrarefizierung, Vernarbung, verminderte Mikrodurchblutung). Nebenwirkungen werden klassifiziert, wobei verschiedene Systeme angewendet werden (Tab. 1). In der Strahlentherapie etabliert ist die Klassifikation der RTOG/EORTC.
Während der Bestrahlung und in den Wochen danach stehen also Haut und Schleimhaut im Vordergrund. An Gesicht und Hals rötet sich die Haut (Grad I), später lösen sich kleine trockene Bereiche ab und es können sich Krusten bilden (Grad II; Abb. 2). Bei weiterer Verschlechterung, insbesondere durch Reibung oder viel Feuchtigkeit (z.B. um ein Tracheostoma herum) kann es zu flächigen, feuchten, offenen Stellen kommen (Grad III), die im Einzelfall auch bluten (Grad IV). An der Schleimhaut entsteht das, was wir orale Mukositis (OM) nennen. Dabei sind die Veränderungen klinisch ähnlich: Rötung (Grad I), kleine wunde Stellen, oft mit Fibrinbelag (Grad II), oder großflächige Wunden mit diesen Belägen (ab 3 cm2, Grad III; Abb. 3) und ggf. Blutung (Grad IV). Fibrinbeläge müssen von Belag durch Superinfektionen wie Candida abgegrenzt werden (Abstrich, klinischer Eindruck). An der Gingiva finden sich diese Veränderungen seltener, meist ist es eher die sogenannte Glattflächenmukositis, die im Vordergrund steht.
Als Nebeneffekt führen diese Veränderungen zu Schmerzen, die bei jedem Schleimhautkontakt (Speichelschlucken, Trinken, Essen, Husten, Zähneputzen, Mundspülen) zunehmen. Der Geschmackssinn ist bereits früh stark beeinträchtigt, regeneriert sich aber i.d.R. nach der Behandlung allmählich wieder. Der Zeitverlauf ist hier unterschiedlich und kann mehrere Monate betragen. Häufig kommt es zu einer begleitenden Mundtrockenheit (Xerostomie). Diese ist unangenehm und kann für eine Verschlechterung der Nahrungsaufnahme sorgen, besonders in Kombination mit den anderen Reaktionen. Der Patient schläft schlechter, es bilden sich Krusten und Borken im Mund, die bei der Entfernung schmerzen können. Die Mundtrockenheit ist heute überwiegend auf die akute Phase reduziert. Moderne Bestrahlungstechniken (intensitätsmodulierte Strahlentherapie, IMRT) haben dazu geführt, dass die früher unvermeidbare chronische Xerostomie deutlich seltener ist. Dennoch verändern sich häufig auch langfristig Zusammensetzung und Konsistenz des Speichels, was wiederum Einfluss auf die Zahngesundheit hat. Zähne, die eine relevante Dosis erhalten, d.h. im oder nahe dem primären Zielgebiet liegen, erleiden durch die Bestrahlung ebenso wie Knochen eine Verminderung ihrer Mikrodurchblutung. Auch wenn man sich das in der Regel nicht bewusst macht, so sind Zähne auch von einer guten Durchblutung abhängig, und nach Bestrahlung sind sie für alle schädigenden Reize viel anfälliger, was auch an der indirekten Wirkung der veränderten Speichelzusammensetzung liegt. Daher wurde der Begriff Strahlenkaries geprägt. Nach einer Bestrahlung kann es im Langzeitverlauf auch bei guter Mundhygiene zu einer rasch fortschreitenden, schwersten Karies kommen. Sie entsteht wie andere Karies auch, kann aber den geschwächten Zahn viel stärker und schneller zerstören.
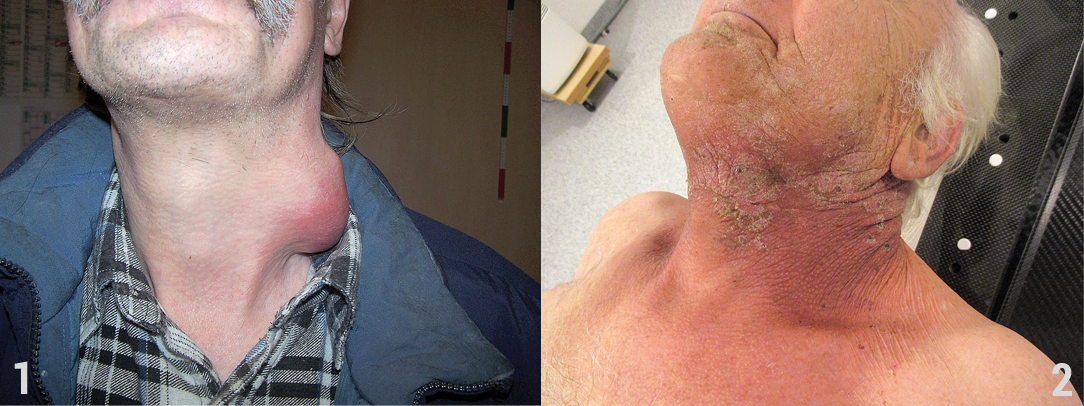
Abb. 1: Patient mit Halslymphknotenmetastase. – Abb. 2: Hautreaktion Grad II.
Die Zähne sind über die Wurzeln unmittelbar im Kieferknochen verankert. Nun erleidet der Kieferknochen durch Bestrahlung die gleichen Veränderungen der Mikrozirkulation (Durchblutung über sehr kleine Gefäße) wie andere Gewebe. Der Unterkiefer scheint dabei durch seine spezielle Blutversorgung besonders anfällig für Schäden zu sein. Dringen dann im Langzeitverlauf Keime ein (z.B. auf dem Boden kariös zerstörter Zähne oder nach unvorsichtigen Manipulationen an Gingiva und/oder Knochen), kann es zu einer sogenannten infizierten Osteoradionekrose kommen. Dabei handelt es sich um ein gefürchtetes Krankheitsbild, bei dem der Knochen nach und nach zerstört wird, operativ entfernt werden muss und die jeweils angestrebten plastischen Deckungsverfahren durch besonders schlechte Wundheilung gekennzeichnet sind. Diese Zusammenhänge haben dazu geführt, dass Patienten mit Radio(chemo)therapie bei Kopf-Hals-Tumoren heute einem standardisierten Betreuungskonzept zugeführt werden, in dem der Zahnarzt und die zahnärztlichen Assistenzberufe eine wichtige Rolle spielen.
Ablauf einer Strahlentherapie
Patienten werden fast immer durch die operierende Abteilung in der Strahlentherapie vorgestellt. Häufig werden sie zuvor in einer interdisziplinären Konferenz thematisiert (Tumorboard), in der auch das Therapiekonzept festgelegt wird. Beim Erstgespräch erhält der Patient sehr viele Informationen. Hier ist oft eine Wiederholung der wichtigen Punkte im Verlauf der Vorbereitungen und Durchführung der Therapie nötig. Der erste Termin sollte möglichst früh stattfinden, um die nachfolgenden Schritte zeitgerecht organisieren zu können.
Jeder Patient sollte vor Beginn der Bestrahlung zahnärztlich kontrolliert werden. Dabei vergessen Ärzte oft, dass auch ein zahnloser Mund kontrolliert werden muss – retinierte Zähne können ebenso langfristig ein Problem sein wie unbehandelte Kieferveränderungen, die man klinisch nicht sieht. Dennoch werden zahnlose Patienten nur selten den prätherapeutischen Weg zum Zahnarzt finden. Welche Schritte bei der prätherapeutischen Zahnsanierung nötig sind, findet sich im nächsten Abschnitt.
Wenn der Patient nach der Zahnbehandlung wiederkommt, wird eine Maske angefertigt. Diese dient der Fixierung der Lagerung – eine auf Millimeter genaue Applikation von Strahlung ist nur möglich, wenn sich das Zielgebiet nicht bewegt. Das Material wird in warmem Wasser eingeweicht und dann individuell angepasst, ggf. unter Einsatz von Mundkeil und Schleimhautretraktoren. Mit der Maske wird dann ein Planungs-CT durchgeführt, in dem der Strahlentherapeut Zielgebiet und Risikoorgane definiert, woraufhin der Medizinphysikexperte in der Strahlentherapie den Bestrahlungsplan erstellt. Bei der ersten Bestrahlung erfolgt die präzise Einstellung des Plans am Patienten. Dazu werden verschiedene bildgebende Verfahren genutzt – in der Regel spezielle CT-Einheiten, die direkt am Bestrahlungsgerät angebracht sind.
Von nun an kommt der Patient täglich zur Bestrahlung. Er erhält erneut schriftliche und mündliche Erläuterungen, wie eine optimale Pflege aussieht. Er wird immer wieder auf die notwendige Pflege hingewiesen, Fragen werden beantwortet, die Mundhöhle wird inspiziert und Nebenwirkungen, wenn nötig, behandelt. In manchen Abteilungen wird ein Low-Level-Laser prophylaktisch zur Reduktion der oralen Mukositis angewendet.
Alle Maßnahmen zielen darauf hin, eine Bestrahlungspause möglichst zu vermeiden, da diese den Therapieerfolg kompromittiert. Im Vordergrund stehen dabei die Motivation zur Pflege, die Behandlung von Superinfektionen und Entzündung der Haut sowie eine effektive Schmerztherapie. Dabei beginnt man mit topischen Analgetika, dennoch sind häufig systemische Morphine nötig.
Nach Ende der Bestrahlung heilen die akuten Nebenwirkungen langsam ab. Nach sechs Wochen geht es den Patienten deutlich besser, der Geschmack kommt langsam wieder, die Mundtrockenheit ist gebessert, Haut und Schleimhaut sind nur noch etwas gerötet. Ab hier beginnt auch die onkologische Nachsorge, die immer unter Einbindung der Radioonkologen erfolgen sollte. Gewebsveränderungen finden sich jedoch tendenziell lebenslang, und hier liegt in der Langzeitbetreuung die besondere Verantwortung des zahnmedizinischen Teams.
Zahnärztliche Sanierung der Mundhöhle vor Therapie
Die zahnärztliche Sanierung der Mundhöhle ist schon bei der Planung einer Bestrahlung oder einer kombinierten Radiochemotherapie so früh wie möglich notwendig. Ein Patient mit entzündungsfreiem Mund und gepflegten Zähnen oder gut sitzenden Prothesen wird wesentlich weniger unter einer oralen Mukositis leiden. Eine gute Kooperation aller beteiligten Fachdisziplinen ist dabei unerlässlich. Bei der klinischen und radiologischen Untersuchung (OPG) der Mundhöhle ist besonders zu beachten, dass keine langwierigen oder aufwendigen Behandlungen begonnen werden, die zu einer Verzögerung der onkologischen Therapie führen könnten.
Zähne, die der vollen Strahlendosis ausgesetzt werden und bereits bisher nicht ausreichend gepflegt wurden, sollten entfernt werden, um spätere Probleme zu vermeiden. Bei Brückenpfeilern oder Klammerzähnen (auch bei Implantaten) sind Vor- und Nachteile einer Entfernung sorgfältig abzuwägen. Kariöse erhaltungswürdige Zähne sollten konservativ versorgt, Wurzelbehandlungen mit unsicherem Erfolg möglichst nicht begonnen werden. Spitze Kanten an Zähnen und Zahnersatz sollten geglättet, tief zerstörte, beherdete oder gelockerte Zähne und solche, die voraussichtlich nicht länger als neun Monate symptomfrei bleiben werden, sollten entfernt werden. Nicht entzündete, retinierte (impaktierte) Zähne, die allseits von Knochen umgeben sind, können belassen werden. Nach der Zahnentfernung und ggf. auch anderen OPs sollten scharfe Knochenkanten geglättet (modellierende Osteotomie) und die Wundränder gut adaptiert bzw. eine plastische Deckung der Mukosa realisiert werden, um eine rasche Heilung zu ermöglichen. Bei vorgesehener Bestrahlung ist es ratsam, individuelle Fluoridierungsschienen anzufertigen, um den Zahnschmelz mittels eines gering sauren Fluoridgels (nicht unter pH 5,5; Fluorid ca. 5.000 ppm) täglich zu härten (Anwendung am besten abends für ca. fünf bis zehn Minuten nach dem Zähneputzen). Diese Schienen sind bis ans Lebensende und nicht nur bis zum Ende der Radiotherapie zu tragen. Keinesfalls sollten diese Schienen während der Bestrahlung im Mund sein.
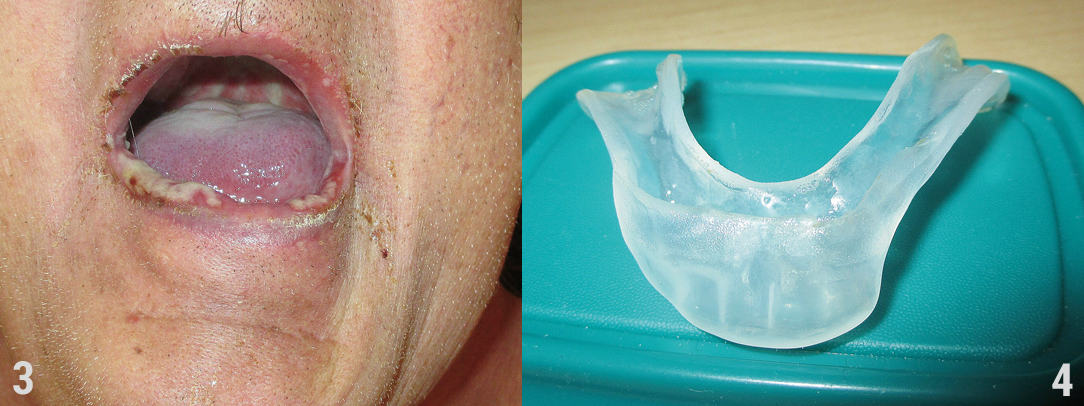
Abb. 3: Schleimhautreaktion Grad III. – Abb. 4: Zahnschienen zum Schutz vor Streustrahlung in Metall – sogenannte Schleimhautretraktoren.
Anders verhält es sich bei den mindestens drei Millimeter dicken Silikonschienen, die angefertigt und bei der Bestrahlung getragen werden sollen, wenn Metall in der Mundhöhle in Kontakt zur Schleimhaut steht (Abb. 4). Durch die hochenergetische Bestrahlung entstehen in Metall (Stifte, Füllungen, Implantate) Sekundärelektronen mit einer Reichweite von unter drei Millimetern. Werden sie nicht abgefangen, kann die Dosis an der Schleimhaut um mehr als 200 Prozent erhöht sein und so deutlich mehr Nebenwirkungen verursachen. Sowohl bei Zähnen als auch bei Implantaten ist gegebenenfalls eine Parodontaltherapie erforderlich. Zahnstein muss entfernt und Taschentiefen sollten gemessen und dokumentiert werden. Ganz allgemein sollten Entzündungen behandelt werden, weil sie sich unter der späteren Therapie wesentlich verschlechtern können. Dies gilt ebenso für schon bestehende Schleimhauterkrankungen, wie z.B. Lichen planus, Herpes simplex oder Papillomvirusbefall. Prothesenfibrome müssen entfernt werden.
Tab. 1: Klassifikationssysteme für Nebenwirkungen an der Mundschleimhaut – Radiation Therapy Oncology Group (RTOG), Common Toxicity Criteria (CTC), World Health Organization (WHO).
Nach Überprüfen der herausnehmbaren Teil- oder Vollprothesen auf guten Sitz, folgt die Behandlung bestehender Druckstellen und gegebenenfalls eine weichbleibende Unterfütterung. Eventuelle Klammern und die Klammerzähne sollten einen stabilen Halt gewährleisten. Muss eine Prothese neu angefertigt werden, so eignet sich leicht zu bearbeitender Kunststoff am besten, damit beim Auftreten von Druckstellen jederzeit eine Korrektur erfolgen kann. Die Prothesen dürfen während der Strahlentherapieserie nur bei Beschwerdefreiheit kurzzeitig zum Essen oder in Gesellschaft getragen werden, keinesfalls dauerhaft im Tagesverlauf oder während des Schlafes (Einlegen in eine milde Desinfektionslösung). Der Zahnarzt sollte den Zustand des Mundes prätherapeutisch genau dokumentieren und mit dem Radiotherapeuten/Onkologen die Kontrollintervalle festlegen. Zahnärztliche Probleme während oder unmittelbar nach der Radio- und/oder Chemotherapie müssen individuell gelöst werden. Hier geht es darum, schwerwiegende Folgen (z.B. Kiefernekrose, Sepsis) und Therapieunterbrechungen zu vermeiden oder, wenn unvermeidbar, die Unterbrechung zu verkürzen. Es empfiehlt sich auch eine Abschlusskontrolle mit Röntgenuntersuchung. Von höchster Wichtigkeit ist die genaue Aufklärung des Patienten und seiner Angehörigen/Pflegenden über die durchzuführenden Maßnahmen und deren Sinn. Eine zusätzliche Anleitung durch eine ausgebildete Mundhygieneassistentin ist gerade am Anfang sehr wertvoll. Die Mitarbeit des informierten Patienten ist für den Langzeiterfolg ganz entscheidend.
Zahnärztliche Betreuung nach der Strahlentherapie
Wichtig ist vor allem, dass Patienten regelmäßig einbestellt werden und auch, dass die Nicht-Zahnärzte im Rahmen der onkologischen Nachsorge (Radioonkologen und Onkologen, ggf. auch HNO-Ärzte) mit auf den Zahnstatus und das zahnärztliche Recall achten. Alle Maßnahmen, die in der Mundhöhle üblicherweise zu Verletzungen der Schleimhaut führen (Parodontalbehandlung, intensive Reinigung u.ä.) sind in der Regel durch problemlose, rasche Heilung gekennzeichnet. Ein Patient nach Strahlentherapie hat aber zumeist eine völlig veränderte Mundhöhlenökologie, sodass neben der höheren Verletzlichkeit auch eine schlechtere Heilung besteht, die bei allen Maßnahmen bedacht werden muss. Für Eingriffe sollte fast immer eine antibiotische Prophylaxe erfolgen, bei Zahnentfernungen möglichst eine primär plastische Deckung durchgeführt werden, und jeder Beginn von Karies sollte intensiv behandelt werden, da mit einer raschen Progredienz zu rechnen ist. Freiliegender Knochen muss grundsätzlich immer behandelt, mindestens aber kurzfristig kontrolliert werden – eine Selbstheilung ist nicht zu erwarten. Entscheidend in der Nachsorge ist auch die intensive Motivation des Patienten zur Mundhygiene.
Informationsquellen Die Mundhöhle ist ein Bereich, der in der Krebstherapie eine besondere Rolle spielt. Daher gibt es auch viele Arbeitsgruppen, die sich mit diesem Thema beschäftigen. Die Deutsche Gesellschaft für Radioonkologie (DEGRO) hat eine Arbeitsgemeinschaft Nebenwirkungen-Supportivtherapie AG NW-Suppo), die in der Betreuung von Kopf-Hals-Patienten einen ihrer Schwerpunkte hat. Die Deutsche Krebsgesellschaft (DKG) hat eine Arbeitsgemeinschaft für Supportivtherapie (ASORS). Es gibt die Multinationale Gesellschaft für Supportivtherapie bei Krebs (MASCC) und die Internationale Gesellschaft für Mund-Onkologie (ISOO). Seit Kurzem gibt es nun auch eine europäische Arbeitsgruppe (EOCC), die sich mit der praktischen Umsetzung von Leitlinien und dem Thema Schulungen auseinandersetzt. Diese sind alle im Internet zu finden. Die meisten Informationen gibt es auf der Homepage der ASORS unter www.onkosupport.de. Ein Merkblatt in praktischem Kitteltaschenformat ist bestellbar unter mucositis@nw-suppo.de. |