Parodontologie 02.11.2016
Parodontale Diagnostik – Sind Sonde und Röntgenbild obsolet?
share
Die fünfte deutsche Mundgesundheitsstudie (DMS V) zeigt eine deutliche Abnahme der Prävalenz schwerer Parodontitis. Trotz der positiven Entwicklung bei der parodontalen Gesundheit bleibt, nach Bewertung der DG PARO, eine hohe Behandlungslast in Deutschland von über elf Millionen parodontal schwer Erkrankten. Diese Zahl verdeutlicht, dass parodontale Erkrankungen durch regelmäßige Screenings als solche möglichst frühzeitig identifiziert und behandelt werden müssen. Der folgende Artikel erläutert angeratene diagnostische Maßnahmen und zu dokumentierende Befunde, um daraus die entsprechenden therapeutischen Schritte einzuleiten.
Die parodontale Diagnostik beginnt bereits mit der allgemeinen Anamnese. Hier sollte ein besonderes Augenmerk auf Allgemeinerkrankungen gelegt werden, die einen Einfluss auf parodontale Erkrankungen nehmen. So können systemische Erkrankungen, wie der Diabetes mellitus, bei dem auch eine bidirektionale Wirkung bestätigt wurde (Engebretson and Kocher 2013), kardiovaskuläre Erkrankungen, Bluterkrankungen, genetische Erkrankungen, Infektionserkrankungen sowie hormonelle Einflüsse die parodontale Gesundheit beeinträchtigen. Weiterhin spielt das Raucherverhalten eines Patienten eine Rolle. Bei Rauchern ist im Vergleich zu Nichtrauchern in Abhängigkeit vom Ausmaß des Rauchens das Risiko, an einer Parodontitis zu erkranken, um das Sechsfache erhöht (Tomar und Asma 2000). Zudem sprechen Raucher schlechter auf die Parodontitistherapie an (Tonetti 1998). Daher sollte jedem Patienten die Teilnahme an einem Raucherentwöhnungsprogramm empfohlen werden. Auch andere Faktoren wie Stress oder Alkoholabusus können sich negativ auf die parodontale Gesundheit auswirken. In der speziellen Anamnese wird auf die subjektiven Beschwerden des Patienten wie Mundgeruch, Zahnfleischbluten, Zahnlockerung, Zahnwanderung oder Schmerzen eingegangen. Weiterhin wird der Patient über vorherige Parodontitistherapien und parodontale Nachsorgebehandlungen befragt. Diese Informationen fließen später in die Prognoseeinschätzung mit ein.
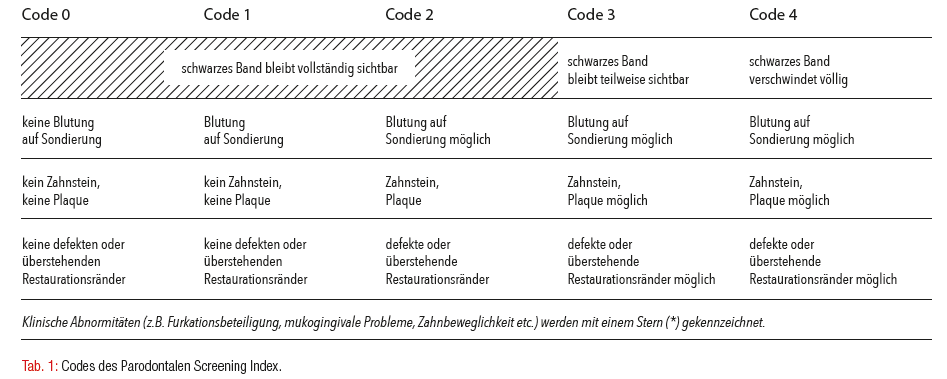
Parodontaler Screening Index
Im Rahmen der regulären zahnärztlichen Kontrolle ist der Parodontale Screening Index (PSI) eine schnelle, einfache und effektive Methode, um eine parodontale Behandlungsbedürftigkeit zu identifizieren (Tab. 1). Bei dem gesetzlich versicherten Patienten kann der PSI nur alle zwei Jahre abgerechnet werden. Dennoch ist es empfehlenswert, bei Patientengruppen mit einem erhöhten Risiko für parodontale Erkrankungen diesen Schnelltest häufiger durchzuführen und bei Auffälligkeiten die entsprechenden weiterführenden diagnostischen und therapeutischen Schritte einzuleiten. Als diagnostisches Mittel zur Überprüfung des parodontalen Behandlunsgerfolgs oder während der unterstützenden Parodontitistherapie ist der PSI ungeeignet und ersetzt nicht die Erhebung eines vollständigen Attachmentstatus.
Attachmentstatus
Sollten beim PSI die Codes 3 oder 4 gemessen werden, erfolgt die Aufnahme eines kompletten Attachmentstatus. Hier werden die wichtigsten parodontalen Befunde dokumentiert. Dies sollte sorgsam durchgeführt werden, da sich nur so der Verlauf einer Parodontitis hinsichtlich des Therapieerfolgs sowie rekurrierender Bereiche bei der unterstützenden Parodontitistherapie identifizieren lässt. Die erhobenen Daten werden in ein Formblatt oder in digitale Befundbögen, die eine spezielle Software voraussetzen, eingetragen (Abb. 1a und b). Dies ermöglicht, das Attachmentlevel vor und nach der Therapie sowie im Laufe der unterstützenden Parodontitistherapie miteinander zu vergleichen und rekurrierende Problemstellen leichter ausfindig zu machen.
Wesentliche klinische Parameter beim Attachmentstatus sind die Sondierungstiefen als Distanz zwischen der marginalen Gingiva und dem Taschenboden sowie Rezessionen als Abstand zwischen der Schmelz-Zement-Grenze bzw. bei überkronten Zähnen dem Restaurationsrand und der marginalen Gingiva.
Optimalerweise werden beide Parameter an sechs Messstellen pro Zahn erhoben und ergeben zusammen den klinischen Attachmentverlust parodontal erkrankter Zähne. Der Behandlungsbedarf lässt sich durch die erhöhten Sondierungswerte und die Prognose der Zähne durch das verbleibende Restattachment abschätzen. Daher ist es nach wie vor unerlässlich, die Sondierungstiefen und Rezessionen exakt zu bestimmen.
Die Sondierung sollte mit einer starren Metallsonde erfolgen (Abb. 2a und b). Das Sondierungsergebnis ist abhängig von der Breite der Sonde (empfohlen wird ein Durchmesser von 0,6 mm), der Sondierungskraft (0,5 N/cm2) (Garnick und Silverstein 2000) und der korrekten Einschubrichtung der Sonde entlang der Zahnachse unter ständigem Zahnkontakt ab. Vor dem Sondieren ist es sinnvoll, sich einen Überblick über die Zahnanatomie und eventuelle subgingivale Konkremente zu machen, um Fehlsondierungswerte zu vermeiden.
Die Dokumentation der Blutungspunkte auf Sondierung (BoP, Bleeding on Probing) (Lang, Adler et al. 1990) ist ein wichtiger Bestandteil des vollständigen Attachmentstatus. Die Blutung sollte 30 Sekunden nach dem Sondieren festgehalten werden. Blutung auf Sondierung ist ein wichtiger klinischer Parameter, da sie als ein Maß für die Entzündungsaktivität einer parodontalen Tasche am Taschenboden dient und ein wichtiger prognostischer Faktor ist. Der BoP besitzt eine hohe Spezifität (im gesunden parodontalen Zustand ist keine Blutung nachweisbar) und eine relativ geringe Sensitivität. Dieser Aspekt ist besonders im Rahmen der unterstützenden Parodontitistherapie zu beachten, da das Ausbleiben einer Sondierungsblutung mit hoher Wahrscheinlichkeit auf eine stabile Situation hindeutet. Ein positiver BoP scheint allerdings ein unzuverlässiger Prädiktor für weiteren Attachmentverlust zu sein (Lang, Adler et al. 1990; Renvert and Persson 2002). Bei Rauchern muss bezüglich des Ausbleibens der Sondierungsblutung besonders Acht gegeben werden. Durch die bei Rauchern verschlechterte periphere Mikrozirkulation kann trotz entzündlicher Prozesse am Taschenboden eine Sondierungsblutung ausbleiben.
Bei einer fortgeschrittenen Parodontitis ist meist der interradikuläre Knochen mehrwurzeliger Zähne abgebaut. Daher ist die Messung der Furkationsbeteiligung ebenfalls ein Bestandteil des Attachmentstatus. Je nach Wurzelkonfiguration und Zahnstellung kann der Furkationsbereich für die Sondierung schwer zugänglich sein. Um dem gekrümmten Verlauf der Furkation folgen zu können, wird eine gebogene Sonde verwendet (Abb. 3). Die Einteilung der Furkationsbeteiligung teilt sich in vier Grade ein (Hamp, Nyman et al. 1975) (Tab. 2).
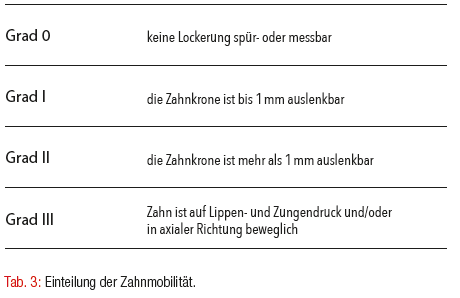
Weiterhin ist die Mobilität der Zähne zu testen und in vier Grade einzuteilen (Tab. 3). Eine Zahnlockerung kann Ausdruck eines stark vorangeschrittenen Attachmentverlustes sein, aber auch durch funktionelle Überbelastung verursacht werden. Dies sollte mithilfe des funktionellen Befundes überprüft werden. Die funktionelle Untersuchung ist von Bedeutung, da bekannt ist, dass Zähne mit okklusalen Diskrepanzen initial höhere Sondierungstiefen aufweisen (Nunn and Harrel 2001) und unbehandelt die Progression einer Parodontitis gefördert wird (Harrel and Nunn 2001). Entgegen anderslautenden historischen Annahmen, ist eine Malokklusion allein aber kein auslösender Faktor für parodontale Läsionen (Glickman 1963). Zusätzlich werden im Attachmentstatus die Zahnlockerungen und eventueller Pusaustritt eingetragen.
Röntgenbefunde
Ein wichtiges diagnostisches Mittel stellt nach wie vor neben den klinischen Befunden der Röntgenbefund dar. Um das knöcherne Attachment beurteilen zu können, sind aktuelle Röntgenbilder nötig. Hierbei ist ein Orthopantomogramm nur bedingt aussagekräftig. Durch technisch bedingte Unschärfe und Überlagerungen vor allem im Frontzahnbereich ist das Knochenniveau nicht immer eindeutig erkennbar. Daher kann das Orthopantomogramm mit zusätzlichen Zahnfilmen ergänzt oder grundsätzlich ein Röntgenstatus mit Zahnfilmen in Paralleltechnik angefertigt werden. Beurteilt wird der prozentuale Knochenabbau, gemessen als Distanz zwischen der Schmelz-Zement-Grenze bzw. den Restaurationsrändern und dem Limbus alveolaris. Eine korrespondierende parodontale Tasche ist bei einem gleichmäßigen horizontalen Knochenabbau als supraalveolär zu bezeichnen.
Weiterhin können vertikale Knocheneinbrüche gut analysiert werden. Hier erfolgt die Messung von der Schmelz-Zement-Grenze bis zum Boden des intraossären Defektes, also dem Bereich, an dem der Defekt in den Parodontalspalt übergeht. Eine parodontale Tasche bezeichnet man hier als intraalveolär. Oftmals lässt sich bereits röntgenologisch anhand der Radiotransluzenz feststellen, ob ein einwandiger oder mehrwandiger Knochendefekt vorliegt.
An mehrwurzeligen Zähnen kann der interradikuläre Knochenabbau beurteilt werden, was klinisch häufig schwierig ist. Hier kann gegebenenfalls zusätzlich eine exzentrische Aufnahme angefertigt werden. Von diagnostischem Wert ist hierbei das Vorhandensein des sogenannten Furcation Arrow, einer dreieckigen radiologischen Struktur im interradikulären Bereich als ein Indikator für das Vorhandensein einer Furkationsbeteiligung des Grades II oder III (Abb. 4).
Zum zusätzlichen Informationsgewinn bezüglich der Defektkonfiguration kann die Anfertigung eines digitalen Volumentomogramms in Betracht gezogen werden. Besonders bei furkationsbefallenen Zähne kann die dreidimensionale Darstellung des interradikulären Knochens ziemlich exakt dargestellt werden (Walter, Weiger et al. 2010). Allerdings sollte dabei die zusätzliche Strahlenbelastung der Patienten berücksichtigt werden. Daher kann die Anfertigung eines digitalen Volumentomogramms zur ausschließlichen parodontalen Diagnostik nicht uneingeschränkt empfohlen werden.
Wenn durch die spezielle Anamnese bekannt wurde, dass der Patient bereits zuvor in parodontaler Behandlung war, ist es sinnvoll, alte Befunde und Röntgenbilder zur Einschätzung der Krankheitsprogression anzufordern.
Weiterführende diagnostische Mittel
Zusätzlich gibt es eine Vielzahl weiterführender diagnostischer Tests, welche die klinische Diagnostik ergänzen. Diese Tests analysieren die Ausschüttung von Entzündungsmolekülen, genetische Besonderheiten des Patienten oder bestimmen das vorherrschende bakterielle Spektrum. Allerdings ist die Durchführung dieser Test nicht zwangsläufig von zusätzlichem Nutzen oder bewirkt eine therapeutische Konsequenz. Nach wie vor ist die parodontale Sonde und die Anfertigung von Röntgenbildern der Standard in der parodontalen Diagnostik. Auf dieser Basis kann eine sorgfältige Interpretation der Befunde und die dementsprechende Therapieplanung erfolgen. Mitte der 1990er-Jahre wurden genetische Tests populär, allen voran der Interleukin-1-(IL-1-)Test, um das Parodontitisrisiko vorherzusagen. Als Hintergrund wurde vermutet, dass es aufgrund des Polymorphismus infolge der Infektion mit parodontalen Bakterien zu einer überschießenden Produktion dieses Entzündungsmoleküls kommt und im Folgenden der parodontale Knochen vermehrt abgebaut wird. Allerdings konnte in aktuelleren Studien eine Assoziation eines Polymorphismus im IL-1 Gen (oder anderer postulierter Kandidatengene) mit der aggressiven Parodontitis nicht bestätigt werden (Fiebig, Jepsen et al. 2008; Schaefer, Bochenek et al. 2013). Das Vorliegen spezieller genetischer Risikofaktoren beeinflusst zwar nicht das therapeutische Vorgehen, kann allerdings eine Auswirkung auf das Nachsorgeintervall ausüben.
Mit weiteren diagnostischen Testverfahren kann chairside der aktuelle Entzündungsstatus einer Zahnfleischtasche bestimmt werden. Dies kann beispielsweise über die Sulkusflüssigkeitsfließrate erfolgen, bei der die Menge an Sulkusflüssigkeit mit einem Filterpapierstreifen innerhalb einer Zeiteinheit bestimmt und mithilfe eines speziellen Messgeräts (Periotron, Oraflow, New York, USA) ausgewertet wird. Die Menge an produzierter Sulkusflüssigkeit nimmt mit dem Schweregrad der parodontalen Entzündung zu.
Weiterhin können Kollagenasen, wie die Matrix-Metalloproteinase-8 (MMP-8), die beim entzündlichen Abbau parodontaler Strukturen freigesetzt werden, nachgewiesen werden. Ein ELISA-basierte Schnelltest ist kommerziell erhältlich, allerdings nur unzureichend wissenschaftlich belegt. Der Mehrwert der erlangten Informationen ist kritisch zu betrachten. Schließlich ist ein aktiver Entzündungsstatus klinisch simpel durch Blutung und Taschenbildung erkennbar (Meisel and Eickholz 2015).
Die sicherlich am häufigsten durchgeführte weiterführende Diagnostik stellt die mikrobiologische Analyse der subgingivalen Bakterienbesiedlung dar. Hierbei werden Proben der subgingivalen Plaque entnommen und diese durch molekularbiologische Methoden, wie die Polymerase-Kettenreaktion oder DNA-Sonden, analysiert. Seltener erfolgt die Bakterienidentifikation durch Kultivierungsverfahren. Der therapeutische Mehrwert einer solchen Keimbestimmung ist jedoch zu hinterfragen (Fernandez y Mostajo, Zaura et al. 2011). So wird beispielsweise eine adjuvante systemische Antibiose bei schwerer chronischer oder aggressiver Parodontitis empfohlen, unabhängig vom nachgewiesenen Bakterienspektrum. Der Wirkstoffcocktail aus Metronidazol und Amoxicillin hat sich hierbei am besten zur Reduktion der Taschentiefen bewährt (Sgolastra, Petrucci et al. 2012; Keestra, Grosjean et al. 2015; Keestra, Grosjean et al. 2015; Zandbergen, Slot et al. 2016). Interessanterweise ist die Wirkstoffkombination unabhängig vom subgingivalen Keimspektrum effektiv (Cionca, Giannopoulou et al. 2010; Mombelli, Cionca et al. 2013). Jedoch kann die mikrobiologische Testung im Einzelfall zur Bestätigung des klinischen Befundes oder zur Verlaufskontrolle durchgeführt werden.
Die vollständige Literaturliste gibt es hier.