Implantologie 04.04.2016
Periimplantitis: Behandlungskonzept mit Hyaluronsäure und Laserlicht
share
Dentale Implantate sind heute eine von den Patienten weithin akzeptierte und gewünschte Therapie zur Restauration teilbezahnter und unbezahnter Kieferabschnitte.1 Damit wird diese Therapieoption immer öfter im zahnärztlichen Behandlungsalltag umgesetzt. Alleine in Deutschland schätzt man ca. eine Million Implantatinsertionen pro Jahr.
Ein weltweit sich abzeichnender Trend und ausgeprägter Wunsch vieler Patienten ist der festsitzende und implantatgetragene Zahnersatz. Auch die Ansprüche an Ästhetik sind heute so hoch wie nie zuvor. Als Folge dieser Entwicklung wird aber auch die Häufigkeit der Periimplantitis, d. h. der Infektion des periimplantären Gewebeareals, mehr und mehr steigen. Damit ist klar, dass periimplantäre Erkrankungen den praktizierenden Zahnarzt und nicht nur den Implantologen künftig in zunehmendem Maße beschäftigen werden.
Die Voraussetzung für die Entwicklung geeigneter Protokolle zur Prävention und Therapie der periimplantären Erkrankungen ist selbstverständlich eine umfassende Kenntnis ihrer Ätiologie, Pathogenese und Epidemiologie. Der Großteil der frühen klinischen Studien beurteilte die Qualität des Behandlungsergebnisses anhand der Überlebensraten, also des physischen Verbleibens des Implantats in der Mundhöhle. Anfänglich führten die Autoren Implantatverluste eher auf mechanische Zwischenfälle als auf biologische Ursachen zurück. Viele Referenten und Autoren sehen auch im Verbleiben von Kleberesten im subgingivalen periimplantären Bereich eine der Hauptursachen für periimplantäre Entzündungen. Dies kann jedoch nicht ohne Vorbehalt bestätigt werden und bedarf weiterer Ausführungen. Heute rückt die Bedeutung des Gesundheitsstatus der periimplantären Gewebe für das Implantatüberleben zunehmend in den Fokus.
Rein mechanisch können wir das Problem nicht angehen, geschweige denn lösen. Vielmehr sollten wir versuchen, die Biologie, die allem zugrunde liegt, und möglichst die Kommunikation der Zellen, aber auch der Mikroorganismen in ihrem hochkomplexen Biofilm etwas besser zu verstehen. Auch wenn die Implantatbehandlung generell als höchst erfolgreich gilt, treten häufig periimplantäre Infektionen auf, die als periimplantäre Mukositis und Periimplantitis bezeichnet werden. Dabei handelt es sich ebenso wie bei den parodontalen Erkrankungen um entzündliche Krankheiten infektiösen Ursprungs, die anfangs zum Verlust von kollagenen Fasern in den Weichgewebsstrukturen und schließlich zum Verlust des stützenden Knochens am Implantat führen. Bei der periimplantären Mukositis ist die Entzündung definitionsgemäß auf die periimplantäre Mukosa begrenzt, während sie bei der manifesten Periimplantitis auch den periimplantären Knochen einbezieht. Für positive Langzeitergebnisse von Implantaten sowie zur Prävention und Behandlung von oralen Infektionen müssen diese Krankheiten zellbiologisch verstanden und kontrolliert werden. Das bedeutet, für eine langfristig erfolgreiche Therapie von Periimplantitis und Parodontitis ist das Verständnis der zugrunde liegenden mikrobiologischen und genetischen Aspekte sowie deren Verzahnung untereinander eine wichtige Voraussetzung.2

Die verfügbaren epidemiologischen Daten legen nahe, dass einer von fünf Patienten, der mit dentalen enossalen Implantaten versorgt ist, im Laufe der Zeit eine Periimplantitis entwickeln wird. Oft weisen Patienten mit Implantaten schon nach vier bis fünf Jahren post implantationem eine periimplantäre Mukositis auf. Derzeit gibt es aber nur begrenzte wissenschaftliche Daten zur Behandlung periimplantärer Erkrankungen. Die meisten Behandlungsverfahren orientieren sich an der Parodontitistherapie, was grundsätzlich nicht falsch ist. Das wichtigste therapeutische Ziel ist die Infektionskontrolle. Hierzu kann auch eine Anpassung des Zahnersatzes gehören, wenn dessen Form eine adäquate häusliche Mundhygiene und die professionelle Reinigung der Implantatoberfläche von Biofilm und Kalkablagerungen behindert. Bei fortgeschrittener Periimplantitis kann ein chirurgisches Vorgehen indiziert sein, um den Biofilm zu beseitigen. Im Rahmen solcher chirurgischen Eingriffe kann gegebenenfalls auch eine regenerative Behandlung erfolgen, um verlorenen Knochen zu ersetzen. Noch basieren die therapeutischen Interventionen bei der Periimplantitis überwiegend auf klinischer Erfahrung, da zuverlässige wissenschaftliche Daten in vielen Bereichen fehlen. Allerdings ist die Forschungsaktivität auf diesem Gebiet gegenwärtig hoch und kontinuierlich werden neue Erkenntnisse gewonnen, sodass zukünftig mit klareren Richtlinien für die Behandlung dieser Krankheiten zu rechnen ist. Für die Prävention von periimplantärer Mukositis und Periimplantitis sind die Frühdiagnostik mit einer Parodontalsonde, mit aMMP-8-Screeningtests und die Evaluation des Gesundheitsstatus der periimplantären Gewebe essenziell. Eine frühe Diagnosestellung ermöglicht eine frühe Intervention, die dann klinisch effektiv sein kann. Werden jedoch die Frühzeichen verkannt, ist eine komplexere Therapie erforderlich, deren Ergebnisse dann weniger vorhersagbar sind. Anzeichen und Symptome von periimplantären Infektionen wurden u.a. von Schwarz und Becker 2007 beschrieben (Tab. 1).3
Ätiologie und Pathogenese
Dass die Anwesenheit von Mikroorganismen für die Entwicklung periimplantärer Infektionen eine essenzielle Voraussetzung darstellt, ist in der Literatur gut belegt.1,2 Heute weiß man, dass gleich nachdem ein Implantat gesetzt worden ist, sich Glykoproteine aus dem Speichel an die zur Mundhöhle hin exponierten Titanoberflächen der Implantate oder Abutments anlagern. Diese Glykoproteinschicht wird dann von Mikroorganismen kolonisiert. Kurze Zeit nach der Implantation bildet sich so eine subgingivale Mikroflora, in der Peptostreptococcus micros, Fusobacterium nucleatum und Prevotella intermedia dominieren. Periimplantäre Erkrankungen sind durch eine überwiegend gramnegative, anaerobe Mikroflora gekennzeichnet, wie sie in ähnlicher Form bei Parodontitis zu beobachten ist. Für die Periimplantitis wurden hohe Konzentrationen parodontalpathogener Keime wie Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythia und Treponema denticola nachgewiesen. Ferner legen Studien nahe, dass die Mikroflora bei periimplantären Erkrankungen oft auch Fusobacterium nucleatum und Actinomyces-Spezies sowie Staphylococcus aureus und Enterokokken enthält. Staphylococcus aureus besiedelt auch andere Fremdkörper und führt beispielsweise auch an Hüfttransplantaten zu Komplikationen. Titan scheint die Ansiedlung von S. aureus zu begünstigen, der sich häufig auch an dentalen Implantaten findet. Die Weichgewebsmanschette am Implantat setzt sich zusammen aus einer epithelialen und einer bindegewebigen Anheftung. Die epitheliale periimplantäre Mukosa, bestehend aus oralem Gingivaepithel, oralem Sulkusepithel und nicht keratinisiertem Saumepithel, entspricht weitgehend dem epithelialen Zahn-Mukosa-Kontakt. Die bindegewebige Anheftung an das Implantat erfolgt über in den marginalen Knochen inserierende Faserbündel, welche sich implantatnah, parallel und zirkulär zu dessen Oberfläche anordnen. Das supraalveoläre Bindegewebe ist im Unterschied zu dem den Zahn umgebenden Bindegewebe sowohl zell- als auch gefäßarm. Dies führt zu verminderten Abwehrmechanismen gegen bakterielle Einflüsse am Implantat. Periimplantäre Entzündungen können sich folglich schneller ausbreiten als vergleichbare Entzündungen des parodontalen Halteapparats. Fehlende Desmodontalstrukturen beschränken die Abwehrfähigkeit des Wirtsorganismus einzig auf die Gefäßproliferation innerhalb der marginalen Weichgewebsmanschette, was zu einer gesteigerten Ausprägung der klinischen Entzündungszeichen der marginalen Weichgewebe führt. Wahrscheinlich besteht ein Zusammenhang zwischen der zum Zeitpunkt der Implantation in der Mundhöhle vorhandenen Mikroflora und dem sich auf Implantaten entwickelnden Biofilm. In diesem Sinne können beim Teilbezahnten parodontale Taschen an natürlichen Zähnen als Reservoir für Mikroorganismen fungieren, die dann zügig die neu gesetzten Implantate besiedeln.
Die Periimplantitis: Eine durch Infektion verursachte entzündliche Erkrankung
Die Implantate werden nach dem Inserieren oder nach der Freilegung bei zweizeitigem Vorgehen sehr rasch von oralen Mikroorganismen kolonisiert. Sie werden von einer ähnlichen Mikroflora besiedelt wie die natürlichen Zähne. Parodontal erkrankte Zähne können als Reservoir für pathogene Mikroorganismen fungieren. Parodontal erkrankte Zähne sollten unbedingt vor einer Implantation behandelt werden. Aufgrund der möglichen Übersiedlung der pathogenen Mikroflora aus parodontalen Läsionen auf neu gesetzte Implantate ist eine Implantation bei einer aktiven Parodontalerkrankung kontraindiziert.
Die periimplantäre Mukosa um Titanimplantate hat viele Gemeinsamkeiten mit den gingivalen Geweben um natürliche Zähne. Wie die Gingiva bildet auch die periimplantäre Mukosa eine manschettenartige Barriere, die an der Oberfläche des Titanabutments anhaftet. Die periimplantäre Mukosa ist ein keratinisiertes orales Epithel, dessen Kollagenfasern auf Höhe des krestalen Knochens beginnen und parallel zur Implantatoberfläche verlaufen. Genau wie an natürlichen Zähnen verursacht die Akkumulation bakterieller Plaque in Kontakt mit der periimplantären Mukosa eine Entzündung und vergrößert die klinische Sondierungstiefe am Implantat. Nach längerem Kontakt mit dentaler Plaque weitet sich die periimplantäre Läsion nach apikal aus, ohne von Kollagenfasern eingekapselt zu sein, wie dies bei der Parodontitis der Fall ist. Das entzündliche Infiltrat kann sich bei der Periimplantitis in die Tiefe bis an den Alveolarknochen, unter Umständen sogar bis in die Markräume ausdehnen, während es bei Parodontitis durch einen etwa 1 mm breiten, nicht entzündeten Bindegewebssaum vom Knochen getrennt bleibt. Das könnte auch das unterschiedliche Ausmaß und die Konfiguration der Knochendefekte bei periimplantären Entzündungen erklären.
Diagnostik mit zahnärztlicher Sonde und Röntgenbild
Die Sondierungsblutung als dasjenige klinische Zeichen, das eine Mukositis bestätigt, betrifft bis zu 90 Prozent der Implantate in Funktion.3 Die Definition von Periimplantitis ist leider nicht immer dieselbe. In der Literatur wird der Begriff Periimplantitis noch recht uneinheitlich gebraucht. Auf einer aktuellen Konsensuskonferenz kam man überein, dass die Definition der Periimplantitis als entzündliche Läsion, die zum Knochenverlust führt, akzeptabel ist, dass die diagnostischen Kriterien jedoch alles andere als eindeutig sind. So sollte beispielsweise berücksichtigt werden, dass es während der Einheilung von Implantaten zu einer Knochenremodellierung kommt, wobei der am weitesten koronal gelegene periimplantäre Knochen verloren gehen kann. Dieser physiologische Umbau dauert bis zu einem Jahr und ist nicht als pathologischer Vorgang zu betrachten. Aus klinischer Sicht sollte das Knochenniveau zum Zeitpunkt der prothetischen Versorgung als Referenzwert für spätere radiologische Veränderungen der Knochenhöhe festgelegt werden. Erst zu diesem Zeitpunkt sollte das Referenzröntgenbild angefertigt werden, das dann zur vergleichenden Bewertung des periimplantären Knochenverlustes dient. Bei radiologischem Knochenverlust von 2 mm gegenüber den Ausgangswerten in Kombination mit Blutung und/oder Pusaustritt beim Sondieren ist die Diagnose einer Periimplantitis gerechtfertigt. Bei sofortbelasteten Implantaten ist eine Röntgenaufnahme nach einjähriger Belastung als Referenz für spätere Röntgenbilder geeignet. In Abbildung 1 wird beispielhaft ein extrem fortgeschrittener periimplantärer Knochenabbau 21 Jahre nach Implantatinsertion in einer 2-D-Panoramaübersichtsaufnahme gezeigt. In den meisten Fällen geben Zahnfilm- und Panoramaschichtaufnahmen ausreichende Informationen zu der periimplantären Knochensituation. 3-D-Röntgengeräte der älteren Generation sind oft wegen der Metallartefakte und damit verbundener Aufhärtungsartefakte ungeeignet. Erst durch die Technologie der Metallartefaktreduktion (MAR-Funktion, beispielsweise beim OP300 Maxio von KaVo (in Zusammenarbeit mit der Fa. Instrumentarium Dental) lässt sich auch dreidimensional die Implantatumgebung begutachten.
Periimplantäre Mukositis und Periimplantitis: Häufige Komplikationen
Die periimplantäre Mukositis wird beschrieben als das Vorhandensein einer reversiblen entzündlichen Reaktion in der periimplantären Mukosa, ohne Anzeichen von periimplantärem Knochenverlust, vergleichbar mit der Gingivitis. Periimplantitis wird beschrieben als das weitere Fortschreiten der Plaqueakkumulation und damit das Übergreifen der bakteriellen Entzündung auf den periimplantären Knochen, gekennzeichnet durch entzündlich bedingte Knochendestruktion. Sie wird als Pendant zur Parodontitis gesehen. Etwa vier von fünf Implantatpatienten haben eine periimplantäre Mukositis. Nach zehn Jahren entwickelt einer von fünf Patienten eine Periimplantitis. Besonders häufig ist Periimplantitis bei Rauchern, bei Patienten mit schlechter Mundhygiene und bei Patienten, die bereits einmal an Parodontitis erkrankt waren.1 Implantate mit rauer Oberfläche lagern bei Exposition gegen die Mundhöhle mehr Plaque an als glatte Implantate. Es steht zu erwarten, dass die Periimplantitisprävalenz durch den zunehmenden Ersatz von extrahierten Zähnen durch Implantate und die Verwendung von mäßig rauen Oberflächen in Zukunft steigen wird.
Lasereinsatz in der Therapie periimplantärer Entzündungen
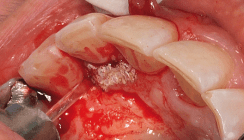
In unserer Klinik hat sich der Lasereinsatz in der Parodontologie und zur Bekämpfung periimplantärer Infektionen klinisch bewährt. Das hohe bakterizide Potenzial des Laserlichtes im Gingivalsulkus und angrenzendem Weichgewebe ist hier ein großer Vorteil, was auch andere Autoren wie Ben Hatit et al. 1996, Coffelt et al. 1997 und Moritz et al. 1997, um nur einige zu nennen, beschrieben haben.4–6 Dringend zu beachten ist allerdings die Wirkung der unterschiedlichen Laserlichtwellenlängen auf die verschiedenen Implantatoberflächen. So verbietet es sich, einen Neodymium-YAG-Laser in der Nähe oder an der Oberfläche von Titanimplantaten zu verwenden. Der Nd:YAG-Laser zerstört die Implantatoberfläche und kann diese auch makroskopisch sichtbar aufschweißen. Dagegen ist der Er:YAG-Laser denkbar gut für die Verwendung in unmittelbarer Nähe von Titanimplantaten, insbesondere auch zum Säubern und Dekontaminieren der Implantatoberfläche, geeignet.7 Der Er:YAG-Laser wurde bereits 1974 von Zharikov et al. als Festkörperlaser mit einer Wellenlänge von 2.940 nm im nahen bis mittleren Infrarotbereich vorgestellt.8 Die Besonderheit dieser Wellenlänge liegt in der Tatsache, dass sie mit der maximalen Absorption in Wasser übereinstimmt und sogar 15 Mal größer als die des CO2-Lasers ist. Je nach Auswahl der physikalischen Laserparameter durch den Behandler (damit sind Laserleistung, Fokus-Gewebe-Abstand, Applikationszeit, Pulsrate und Energiedichte gemeint), ergeben sich im lebenden Gewebe unterschiedliche biologische Vorgänge. Bei der thermomechanischen Ablation beruht das Prinzip des Abtrages von biologischem Gewebe darauf, dass der Anteil des im Gewebe enthaltenen Wassers bei Absorption von sehr kurzen Laserlichtpulsen einen sprungartigen Übergang vom flüssigen in den dampfförmigen Aggregatzustand erfährt. Begleitet durch die schnelle Expansion des Wassers entsteht hierbei kurzzeitig ein genügend hoher Druck, um Hart- und Weichgewebesubstanz effektiv wegzusprengen und damit in gewünschter Weise abzutragen. In den Abbildungen 2 bis 4 werden zunächst die Entfernung von entzündlichem Weichgewebe mit flexibler 300-Mikrometer-Faser und danach die Säuberung und Dekontaminierung der Implantatoberfläche sowie die Ablation des infizierten periimplantären Knochens mit speziell angeschrägtem Saphirmeisel (Abb. 6) eines Er:YAG-Lasergerätes beispielhaft dargestellt. Die benötigten Parameter wie Pulsfrequenz und Energie lassen sich bei den meisten modernen Lasergeräten bequem per Touchscreen einstellen (Abb. 7). Aber das optimale Ergebnis einer systematischen Periimplantitistherapie besteht nicht nur in der Beseitigung des inflammatorischen Prozesses, sondern auch in einer Begünstigung der biologischen Regeneration der periimplantären Strukturen. Aus diesen Überlegungen und der geschilderten Problemstellung heraus wurde in unserer Praxis ein klinisch Erfolg versprechendes Therapiekonzept unter Einbeziehung von Hyaluronsäure erprobt und entwickelt.
Aufbau, Wirkungsprinzip und Eigenschaften von Hyaluronan
Hyaluronsäure (Synonym Hyaluronan) ist ein physiologischer, extrazellulärer, ubiquitärer Bestandteil des Bindegewebes in der Mundschleimhaut und vor allem der Gingiva.9,10 Der Nachweis von Hyaluronsäure im Ligamentum parodontale und umgebenden Gewebe des Parodontium zeigt deren strukturelle Bedeutsamkeit.11–13 Hyaluronsäure gehört zu den Mukopolysacchariden und befindet sich im Extrazellularraum als interstitielle Grundsubstanz. Hyaluronsäure besitzt eine regulierende Funktion bei der Organisation der extrazellulären Matrix und ihrer Bestandteile.14 Dabei bildet das Hyaluronsäurenetzwerk eine der Voraussetzungen für den Stoffaustausch und dient als Barriere gegen das Eindringen fremder Substanzen.
Was macht die Hyaluronsäure im Kampf gegen Periimplantitis so interessant?
Hyaluronsäure besitzt antiinflammatorische, antiödematöse und zusätzlich als Radikalfänger protektive Effekte sowie eine antibakterielle Wirkung, was sich klinisch als bakteriostatischer Effekt bemerken lässt.15 Außerdem trägt sie entscheidend zu Prozessen der Wundheilung bei. Dabei interagiert das Glykosaminoglykan mit der extrazellulären Matrix bei der Regeneration parodontaler Strukturschädigungen.15,16 Die Fähigkeit der Hyaluronsäure zur Beschleunigung der Osteogenese wurde mehrfach diskutiert. Sie reicht von der Hemmung der Zellaggregation bis hin zu osteoinduktiven Effekten hochmolekularer Hyaluronsäure in Röhrenknochen von Ratten.17,18 Die Stimulation durch Wachstumsfaktoren (basic fibroblast growth factor, FGF-2) führte in Zellen des Parodonts von Menschen zur vermehrten Expression von Hyaluronsäuresynthetasen (HAS1- und HAS2-mRNA) und damit zur verstärkten Synthese hochmolekularer Hyaluronsäure. Als effektive Therapieergänzung hat der Autor das bereits publizierte „Liebaugs Hyaluronic Acid Concept in Periodontitis“ entwickelt. Hierbei hat sich die Anwendung von Hyaluronsäure, die explizit für dentale Applikation zugelassen ist, als tragender Bestandteil etabliert. Dieses klinisch erfolgreiche Konzept wurde nun zur Bekämpfung periimplantärer Infektionen modifiziert (Liebaugs Laser and Hyaluronic Acid Concept in Periimplantitis [LLHA Concept]) und zeigt in einer Pilotstudie positive klinische Ergebnisse.
Laser and Hyaluronic Acid Concept in Periimplantitis
Bei der Therapie periimplantärer Infektionen sollte grundsätzlich eine zur systematischen Parodontaltherapie analoge Vorgehensweise, bestehend aus systemischer Phase, hyaluronsäureunterstützter Hygienephase, laser- und hyaluronsäuregestützer Regenerationsphase, einer je nach Verlauf zusätzlich notwendigen laser- und hyaluronsäuregestützen chirurgischen (korrektiven) Phase und letztendlich der hyaluronsäuregestützen Erhaltungsphase, eingehalten werden. In der schematischen Darstellung (Abb. 8) wird der Ablauf einer systematischen Therapie periimplantärer Infektionen, wie sie in unserer Klinik durchgeführt wird, dargestellt. Anamnese, Diagnostik und Befund bilden die Grundlage für unser weiteres Vorgehen. Daraus resultiert zunächst eine vorläufige Diagnose und es kommt möglicherweise zu einer Akutbehandlung oder einer planbaren systemischen Phase. Diese beinhaltet:
- professionelle Implantat- und Zahnreinigung
- Optimierung der individuellen Mundhygiene
- parodontale Vorbehandlung (HA-gestützt)
- systemische, interdisziplinäre Behandlung
- Abklärung der Compliance
Primär muss, um einer Progression der Erkrankung entgegenzuwirken, durch eine kausal gerichtete Therapie die pathogene Mikroflora reduziert werden. Die Entfernung subgingivaler Konkremente sowie des bakteriellen Biofilms von Titanimplantaten wird jedoch durch verschiedenste Implantatoberflächenmodifikationen erschwert. Auch die prothetischen Aufbauten und Suprakonstruktionen erschweren oft den Zugang zu den infizierten Oberflächen. In diesem Zusammenhang wird neben der mechanischen Entfernung des Biofilms zusätzlich eine Dekontamination oder Konditionierung der exponierten Implantatoberfläche gefordert, um die Entfernung von Bakterien und deren Lipopolysaccharide von der mikrostrukturierten Implantatoberfläche zu optimieren. Hierfür kann man einen nichtchirurgischen von einem chirurgischen Therapieansatz unterscheiden. Bewährt hat es sich in unserem Therapiekonzept, dass wir dem chirurgisch korrektiven Therapieschritt möglichst immer eine nichtchirurgische Vorbehandlung vorangehen lassen. Durch gezielten Laser- und Hyaluronsäureeinsatz wird so die klinische Gesamtsituation für die chirurgische Intervention verbessert. Die Nutzung von Er:YAG-Laser und Hyaluronsäure sind bei resektiven oder regenerativen Verfahren (gesteuerte Knochenregeneration, GBR) in unserer Klinik obligatorisch. In den Abbildungen 2 bis 5d sind einige wichtige Therapieschritte unseres LLHA-Konzeptes beispielhaft dargestellt. Circa 13 Monate nach Beginn der Periimplantitistherapie ist das ehemals gelockerte Implantat 37 wieder klinisch fest und man findet unter dem Brückenglied 36 sogar einen Knochenzuwachs, der sich durch die GBR-Technik mit Nutzung von Knochenersatzmaterial erklären lässt. Prinzipiell vermuten wir auch hier eine regenerationsfördernde Wirkung der Hyaluronsäure, die jedoch in weiteren Studien bewiesen werden müsste.
Die Entfernung des Biofilms als vorbereitende Maßnahme für resektive oder regenerative Verfahren sowohl nichtchirurgisch als auch unter Sicht nach Mobilisation eines Mukoperiostlappens muss immer erfolgen. In diesem Zusammenhang sollte jedoch beachtet werden, dass für die Therapie periimplantärer Infektionen bisher keine kritischen Sondierungstiefen definiert worden sind, anhand derer eine Entscheidungsfindung für nichtchirurgische oder chirurgische Therapieansätze getroffen werden könnte. Deshalb entscheiden wir uns oft für den schonenden Weg einer anfänglich Photodynamischen Therapie, kombiniert mit der Instillation eines Hyaluronsäurepräparates. Mit PERIOSYAL FILL der Firma TEOXANE haben wir ein klinisch gut einsetzbares Mittel zur Verfügung, welches sowohl in die Taschen instilliert als auch mit Spezialkanülen in das periimplantäre Weichgewebe injiziert werden kann. In den Abbildungen 10 bis 11c ist ein solches Fallbeispiel exemplarisch und nur zum besseren Verständnis dargestellt. Die subjektiven Patientenbeschwerden wie Rötung, erhöhte Blutungsneigung sowie ein Lockerungsgefühl der natürlichen Zähne 41 bis 33 mit Implantat 34 hatten den Patienten von selbst in die Implantatkontrollsprechstunde geführt. Eine sofort begonnene PZR und hyaluronsäuregestütze Therapie (Abb. 9 und 10), wie im LLHA-Concept beschrieben, hatten klinisch rasch zur Besserung geführt und konnten 13 Monate nach Beginn der Periimplantitistherapie sowohl klinisch (Abb. 11a) als auch röntgenologisch (Abb. 11c) zufriedenstellend beurteilt werden. Abbildung 11a zeigt einen klinisch reizlosen fibrösen Gingivaring, ohne Blutungsneigung, am Implantathals 34. Der Patient befindet sich derzeit in der unterstützenden Periimplantitistherapie bzw. Erhaltungsphase mit halbjährlicher Hyaluronsäureinstillation.
An dieser Stelle sei explizit darauf hingewiesen, dass nur Hyaluronsäurepräparate intraoral eingesetzt werden dürfen, die für diese Applikation eine Zulassung haben. Bei allen Therapiekonzepten sind eine adäquate Plaquekontrolle durch den Patienten sowie ein suffizientes Recallsystem in der Erhaltungsphase Grundvoraussetzung für eine erfolgreiche Therapie. Im Rahmen der Reevaluation muss immer wieder neu über den weiteren Therapieweg oder das Schicksal der betroffenen Implantate entschieden werden. Für eine erfolgreiche Periimplantitistherapie ist gleichermaßen wie für eine Parodontitistherapie ein systematischer Behandlungsablauf unerlässlich.15
Fazit
In unserer Praxis hat sich seit über 20 Jahren die Anwendung verschiedener Lasergeräte mit unterschiedlichen Wellenlängen zur Unterstützung oder Durchführung antientzündlicher Therapien bewährt. Die sofortige bakterizide Wirkung von Laserlicht geeigneter Wellenlänge bei der Behandlung entzündeter Zahnfleischtaschen, der periimplantären Mukositis bis hin zur manifesten Periimplantitis mit Knochendefekt einerseits, aber auch die immer mehr beachtete Biostimulation der Streustrahlung andererseits, führen zu klinisch besseren Heilungsergebnissen. Mit der Einführung der Hyaluronsäure in unser komplexes Behandlungskonzept erwarten wir langfristig eine biologisch erklärbare Verbesserung und Beschleunigung der periimplantären Geweberegeneration im Knochen und im Weichgewebe.
Die Literaturliste finden Sie hier.