Implantologie 07.11.2016
3-D-Augmentation mit simultaner Implantation
share
Einsatz einer natürlichen Stammzellressource
Für eine prothetisch orientierte Implantatplanung stehen heute 3-D-Röntgen- und Planungssysteme zur Verfügung, die das verfügbare Knochenangebot in Relation zum vorgesehenen Zahnersatz exakt darstellen. Wenn das verfügbare Knochenangebot keine sofortige Implantation zulässt, kann eine Knochenblocktransplantation indiziert sein. Anhand der vorliegenden Falldokumentation werden DVT-gestützte Planung, 3-D-Blockfräsung, Entnahme und Transplantation des stammzellhaltigen subepithelialen Bindegewebetransplantats, die Sofortimplantation mit drei Implantaten sowie der postoperative Wundheilungsverlauf nachvollziehbar dargestellt.
Die enossale Implantologie des stomatognathen Systems ist heute ein integraler Bestandteil der zahnärztlich-prothetischen Versorgung in Deutschland (Micheelis et al. 2005). Eine wissenschaftliche Anerkennung der Implantologie durch die Deutsche Gesellschaft für Zahn-, Mund- und Kieferheilkunde erfolgte 1982 (Strassburg 1983). In der aktuellen wissenschaftlichen Stellungnahme „Implantologie in der Zahnheilkunde“ der DGZMK von 2005 wurde das Indikationsspektrum für Zahnimplantate bei ausreichend vorhandenem oder aufgebautem Knochen auf alle denkbaren zahnärztlich-prothetischen Indikationsklassen ausgeweitet. So können heute Implantate auch dann indiziert sein, wenn durch alternative prothetische Versorgungsformen funktionell vergleichbare Ergebnisse erzielbar wären (DGZMK 2005).
Für eine erfolgreiche Implantatversorgung ist eine vorherige Diagnostik und Planung unumgänglich. Hierbei ist es heute Konsens, zunächst eine prothetische Planung durchzuführen, von der ausgehend die optimalen Implantatpositionen evaluiert und festgelegt werden (Ellis et al. 2007). Steht am geplanten Implantationsort kein ausreichendes Knochenangebot zur Verfügung, so wird eine Augmentation des Knochens beziehungsweise eine Rekonstruktion des Alveolarfortsatzes notwendig (DGZMK 2013).
Ursachen für hart- und weichgewebliche Defekte und Defizite im Bereich des Kiefers können traumatisch bedingt, durch entzündliche und andere pathologische Prozesse verursacht oder angeboren sein (Foitzik et Merten 1999). Auch tritt infolge des Zahnverlustes eine Inaktivitätsatrophie und durch Prothesendruck eine Druckatrophie ein, welche zu einer vollständigen Resorption des knöchernen Alveolarfortsatzes führen können.
In einer konsensusgestützten S2-Leitlinie der DGZMK werden vier Defektkategorien beschrieben, aus denen unterschiedliche Indikationsklassen für Knochenaugmentationen als präimplantologisch lagerverbessernde Maßnahmen abgeleitet werden (DGZMK 2012, Klein et Al-Nawas 2011):
- mehrwandiger horizontaler Defekt,
- einwandiger horizontaler Defekt,
- vertikaler Defekt,
- Alveolarkammdefekt im Bereich der Kieferhöhle.
Für eine prothetisch orientierte Implantatplanung stehen heute 3-D-Röntgen- und Planungssysteme zur Verfügung, die das verfügbare Knochenangebot in Relation zum vorgesehenen Zahnersatz exakt darstellen und eine Übertragung auf den chirurgischen Situs ermöglichen. Das verfügbare Knochenangebot kann in allen relevanten Ebenen ausgemessen und notwendige Knochenaufbaumaßnahmen im Vorfeld erkannt und simuliert werden. Wenn das verfügbare Knochenangebot in der horizontalen und/oder vertikalen Dimension keine sofortige Implantation zulässt, kann eine Knochenblocktransplantation indiziert sein. Den Goldstandard bildet das autologe Knochentransplantat, welches intra- oder extraoral gewonnen werden kann. In jedem Falle ist eine Knochenentnahme mit einer zusätzlichen Belastung für den Organismus und mit zusätzlichen Risiken und möglichen Komplikationen verbunden. Die verfügbare Menge des Knochentransplantates ist in Abhängigkeit von der Entnahmestelle begrenzt. Der Einsatz allogener Knochenblöcke vermeidet eine Knochenentnahme am Körper des Patienten und damit verbundene Risiken und Komplikationen. Kleinere, insbesondere drei- und zweiwandige Defekte können im Sinne der gesteuerten Knochenregeneration mit Barrieremembranen und verschiedenen Arten von partikulärem Knochen- und Knochenersatzmaterial allein oder in Kombination versorgt werden (Mellonig et Nevins 1995). Die gesteuerte Knochenregeneration eignet sich jedoch nicht, um größere, einwandige horizontale, vertikale oder kombinierte Defekte, Kontinuitätsunterbrechungen der Kiefer oder Osteoplastiken außerhalb der Kieferkontur durchzuführen (DGZMK 2012). Hierzu sind Knochentransplantate in Blockform notwendig, da nur so eine adäquate Form- und annähernde Volumenstabilität während der Einheilzeit gewährleistet wird.
Die begrenzte Verfügbarkeit autogener Transplantate kann zudem insbesondere bei sehr großen Defektgeometrien, bei Rekonstruktion beider Kiefer oder nach fehlgeschlagener Augmentation, in der Anamnese eine Einschränkung darstellen. Aus den genannten Gründen macht es medizinisch Sinn, nach Alternativen zu suchen, die eine dreidimensionale knöcherne Augmentation größerer Defekte ohne Knochenentnahme am Körper des Empfängers ermöglichen.
Allogene Knochentransplantate werden von Leichen oder lebenden Spendern gewonnen und durch Gewebebanken bereitgestellt. Unter dem Begriff des knöchernen Allotransplantats wird jedoch eine Vielzahl unterschiedlich aufbereiteter Materialien zusammengefasst.
Man unterscheidet:
- gefriergetrockneten Knochen, FDBA,
- demineralisierten gefriergetrockneten Knochen, DFDBA,
- bestrahlten Knochen,
- lösungsmittelkonservierten Knochen ad modum OsteoGraft® (Esser 2016).
Der Einsatz von allogenen Knochenblöcken ist in der Literatur gut dokumentiert. Dies belegen Esposito et al. (2009) im Rahmen einer systematischen Cochrane-Studie sowie eine systematische Literaturübersichtsarbeit aus 2010 (Waasdorp et Reynolds 2010). In neuester Zeit werden der Einsatz adulter ektomesenchymaler Stammzellen, welche aus parodontalen Strukturen (Arnold et al. 2010, Grimm et al. 2011), als mesenchymale Stammzellen aus Knochenmarkaspirat aus dem Becken (Sauerbier et al. 2013, Marx et Tursun 2013) oder als adulte, ektomesenchymale Stammzellen aus dem subepithelialen Bindegewebe des Gaumens gewonnen werden (Widera et al. 2007, Grimm et al. 2014 a–c) in klinischen und tierexperimentellen Studien untersucht.
Zielstellung
In der vorliegenden Falldarstellung eines 72-jährigen Patienten, der mit einer einseitig verkürzten Oberkieferzahnreihe und dem Wunsch einer festsitzenden, implantatgetragenen Versorgung vorstellig wurde, war ein Knochenblocktransplantat indiziert. Als Augmentationsverfahren kam daher die vertikale Auflagerung eines allogenen Knochenblockes zum Einsatz. Allogene Knochentransplantate entstammen dem Organismus eines anderen Individuums der gleichen Spezies und werden bereits seit Jahren erfolgreich in der Augmentationschirurgie eingesetzt. Das hier verwendete Material (OsteoGraft® Corticospongiosa Block, Argon Dental) gestattet die Bearbeitung mithilfe der 3-D-Blockfräsung auf der Grundlage einer präoperativen DVT-Aufnahme zur exakten Adaptation an die Implantatloge.
Zeitgleich mit der allogenen Knochenblockauflagerung wurde ein subepitheliales Bindegewebetransplantat aus dem Gaumen verpflanzt. Das subepitheliale Bindegewebe des Gaumens bildet eine natürliche Ressource für „neural crest stem cells“ (NCSCs) und kann somit als natives Stammzellreservoir fungieren. Mit der Sofortimplantation von drei Implantaten (K3Pro Rapid, Argon Dental) durch den transplantierten Block unter Nutzung einer „full-guided“-Bohrschablone (Implant Solutions) konnte der Eingriff im linken OK-Seitenzahngebiet mit ausgezeichneter Primärstabilität abgeschlossen werden.
Material und Methode
Das Implantatsystem
Das hier vorgestellte Implantatsystem (Konus K3Pro, Argon Dental) zeichnet sich durch eine bakteriendichte Verbindung auf krestaler und subkrestaler Ebene mit einem geringen Austrittsprofil aus dem Sulkus aus. Das „Rapid“ Schneidgewinde mit einer 0,1 %igen Gewindesteigung zur Erhöhung der Primärstabilität verfügt im apikalen Bereich über ein Kompressionsgewinde zur Knochenverdichtung, das in diesen Patientenfall dazu verwendet wird, eine hohe Verbindung zum stammzelltragenden allogenen Knochenersatzmaterial zu erreichen. Dieses Gewindedesign mit der speziellen Oberfläche (OsteoActive®) bewirkt eine schnelle und sichere Einheilung sowie einen direkten Widerstand gegen vertikal und horizontal einwirkende okklusale Kräfte (Abb. 1).
Allogenes Knochenersatzmaterial (KEM)
In Deutschland sind allogene Zell- und Gewebetransplantate als Arzneimittel reguliert und zulassungspflichtig, d. h. die Herstellung, die biologische Sicherheit und die klinische Anwendung unterliegen der ständigen Kontrolle der deutschen Behörden. Das allogene Knochenersatzmaterial (OsteoGraft®) ist durch das Deutsche Institut für Zell- und Gewebeersatz (DIZG) als Arzneimittel für humane Gewebetransplantate zugelassen. Das System zur Gewährleistung der biologischen Sicherheit der Gewebetransplantate des DIZG besteht aus:
- umfangreichen Kriterien zur Spenderauswahl,
- einem umfassenden, die Anforderungen der EU-Richtlinie 23/2004 weit übersteigenden serologischen Spenderscreening, das vier Virus-Genom-Untersuchungen einschließt,
- der Anwendung eines validierten Verfahrens zur Entfernung/Inaktivierung von Viren, Bakterien und Pilzen und
- Inprozess- und Endkontrollen am Transplantat.
Das DIZG und die Argon Dental Vertriebsgesellschaft, Bingen am Rhein, sind nach DIN EN ISO 13485 zertifiziert und folgen dem Ethical Code und den Qualitätsstandards der European Association of Tissue Banks (EATB). Schau et al. (2014) sowie Grimm et al. (2014) konnten eine gute Verträglichkeit der „neural crest stem cells“ (NCSCs) mit der Oberfläche des allogenen Knochenersatzmaterials (Abb. 2) in einer Studie mit verzögerter Implantation nach vertikaler und horizontaler allogener Blockaugmentation feststellen.
Das subepitheliale Bindegewebe als natürliche Stammzellressource
In Grundlagenstudien wurde die Effektivität von „neural crest stem cells“ (NCSCs) zur alveolären Knochenregeneration untersucht. Als Ausgangsmaterial diente humanes subepitheliales Bindegewebe, das aus dem Gaumen entnommen wurde (Abb. 3). Danach wurden die „palate-derived neural crest stem cells“ (palNCSCs) isoliert und ex vivo expandiert. Als Resultat wurde eine Population von Sphäroid-Kulturen erhalten. Diese Dentosphären sind nicht adhärente dreidimensionale Zellcluster und ähneln den in In-vitro-Kulturen muriner, neuraler Stammzellen beobachteten „Neurosphären“ (Cluster von adulten neuronalen Stammzellen [NSZ]). Die nachfolgende Charakterisierung der palNCSCs mittels Polymerase-Kettenreaktion (PCR) ergab die Expression von stammzellrelevanten Markermolekülen, wie Nestin und Sox-2. Die PCR-Ergebnisse wurden durch Durchflusszytometrie sowie Immunhistochemie verifiziert (Abb. 4).
Hämatopoetische Stamm-/Progenitorzellen (HSPZ) spezifische Markermoleküle, wie CD133, CD34 und CD45, konnten mittels Real Time-PCR in palNCSCs nachgewiesen werden (Widera et al. 2009). Zusätzlich fanden wir in dieser Zellpopulation hohe Expressionen von Sox-2, Klf2, Oct-3/4 und c-Myc.
Ein weiteres Charakteristikum von Stammzellen ist deren Befähigung zur Differenzierung. Hier konnten wir für die nach unseren Methoden isolierten und expandierten neuronalen Stammzellen zeigen, dass sie in Gegenwart geeigneter Differenzierungsmedien sowohl in die neuronale Linie als auch in die osteogene Linie differenzieren können (Abb. 5).
Der „Proof of Principle“ erfolgte im Tier, wobei als Modellsystem die athymische Ratte ausgewählt wurde. Hierzu wurden die palNCSCs auf Kollagenschwämmen in formkongruente „critical-size bone defects“ und in parodontale Defekte am ersten Rattenmolaren in der Mandibula transplantiert. Die histologische Analyse in einer Zeitreihe bis zu acht Wochen nach der Operation zeigte eine Neuorganisation knöcherner und parodontaler Gewebestrukturen. So konnte neuformierter Knochen, ein neues parodontales Ligament und neugebildetes Zement in der experimentellen Kerbe histologisch nachgewiesen werden (Abb. 6).
Parallel zum oben beschriebenen Proof of Principle wurde untersucht, ob palNCSCs auf Implantatoberflächen kultiviert werden können (Abb. 7). Hierzu wurden Dentosphären mit Accutase verdaut und die Einzelzellsuspension nachfolgend auf keramischen Probekörpern für bis zu sieben Tage kultiviert. Es konnte beobachtet werden, dass palNCSCs sowohl als Einzelzellen als auch als Zellcluster auf der Oberfläche wuchsen. Die qualitative Auswertung erfolgte durch konfokale Laser-Scanning-Mikroskopie. Hierzu wurden die palNCSCs mit dem Vitalfluoreszenzfarbstoff CellTracker Green gefärbt und nachfolgend mit 4 % Paraformaldehyd fixiert (Keeve et al. 2014).
Stem Cell Homing
„Stem Cell Homing” ist ursprünglich als ein Prozess der Migration von hämatopoetischen Stammzellen aus Blutgefäßen durch Transendothelisierung und anschließender Wanderung durch die Gefäßwand betrachtet worden. Hier wird das Stem Cell Homing als aktive Rekrutierung von endogenen „neural crest stem cells” (NCSCs), einschließlich von Knochen-Progenitorzellen, die in ein spezifisches anatomisches Kompartiment, hier die periimplantäre Knochenloge, migrieren, definiert. Stem Cell Homing unterscheidet sich damit von den osteokonduktiven Wirkungen von KEMs. Allerdings benötigt man für das Stem Cell Homing eine aktiv von dem KEM unterstützte Rekrutierung der NCSCs. Das verwendete allogene Trägermaterial zeigt eine neue Gerüstcharakteristik (Gosau et al. 2015), die durch eine weitergehende Aktivierung mit bioaktiven Cues (Osteo Barrier Gel®) als Zellaktivierungsmaterial mit einem Plasmamembranproteinenträger, der eine Natriumhyaluronat-Lösung enthält, sich als hochkompatibel mit den palNCSCs erwiesen hat.
Das Stem Cell Homing bietet eine Reihe von Vorteilen gegenüber der Stammzelltransplantation für Knochenaugmentationen. Das induzierte „Homing” von endogenen wirtsspezifischen Stammzellen löst die wichtigsten wissenschaftlichen, technischen, kommerziellen und regulatorischen Probleme, die mit einer Stammzelltransplantation verbunden sind, wie die potenzielle Kontamination, übermäßige Kosten, Immunorejektion, Pathogentransfer und die gegenwärtig noch unzulängliche Ausbildung klinisch tätiger Zahnärzte, um die notwendigen zellulären Prozesse „chair side” durchzuführen.
Histologische Analyse der Empfängerregion
Mittels einer speziell entwickelten schonenden Biopsie-Technik mit einem Trepandurchmesser von 2 mm wurden drei Knochenareale histologisch analysiert, siehe auch Abb. 14:
- der native Knochen des Empfängerareals
- der nicht resorbierte Anteil des Knochenblockes
- der neugebildete Knochen
Die histologische Analyse erfolgte am nicht demineralisierten Knochen mittels der Technovit 9100 New-Einbettungsmethode (Heraeus Kulzer) als eine Polymethyl-Methacrylat-(PMMA-)basierte Technik in Übereinstimmung mit Willbold und Witte (2010). Die demineralisierten Knochenschnitte wurden mit verschiedenen Färbungen und polarisationsoptisch auf die periimplantäre Knochenregeneration untersucht.
DVT-gestützte 3-D-Planung
Für eine prothetisch orientierte Implantatplanung stehen heute 3-D-Röntgen- und Planungssysteme zur Verfügung, die das verfügbare Knochenangebot in Relation zum vorgesehenen Zahnersatz exakt darstellen und eine Übertragung auf den chirurgischen Situs ermöglichen. Für unsere Fallpräsentation (Abb. 8) wurden 3-D-Röntgen- und Planungssysteme von coDiagnostiX verwendet. Das verfügbare Knochenangebot konnte in allen relevanten Ebenen ausgemessen und notwendige Knochenaufbaumaßnahmen im Vorfeld erkannt und simuliert werden (Abb. 9–11).
In der vorliegenden Falldarstellung eines 72-jährigen Patienten, der mit einer einseitig verkürzten Oberkieferzahnreihe und dem Wunsch einer festsitzenden, implantatgetragenen Versorgung vorstellig wurde, war ein Knochenblocktransplantat mit stammzellunterstützter Augmentation zur sofortigen Implantation mit drei Implantaten unter Nutzung einer „full-guided“-Bohrschablone indiziert. Der hier verwendete Cortikospongiosa-Chip (OsteoGraft®, Argon Dental) wurde mithilfe der 3-D-Blockfräsung anhand der präoperativen DVT-Aufnahme und computergestützten Blockgestaltung passgenau hergestellt.
3-D-Blockfräsung
Die Produktlinie des hier verwendeten Knochenersatzmaterials lässt sich sowohl für Bi- und Tricorticalis-Blöcke für die Auflagerungsosteoplastik als auch für die Femur-Knochenspan-Technik zum Einsatz für die Schalentechnik manuell bearbeiten oder mit maschineller 3-D-Fräsung einsetzen. In dem vorliegenden Patientenfall wurde eine maschinelle 3-D-Blockfräsung mit einem kortikospongiösen Block unter Einsatz der Parallel-Fräsmaschine (OsteoGRAPH™, Argon Dental) vorgenommen. Die passgenaue Fräsung erfolgt auf der Grundlage eines Kunststoffduplikates, das aus der 3-D-Rekonstruktion des DICOM-Datensatzes der DVT-Aufnahme gefräst und dann in der Fräsmaschine als „eins-zu-eins“-Parallelfräsung steril hergestellt wird (Abb. 12).
Ergebnisse
Allogene Blockaugmentation
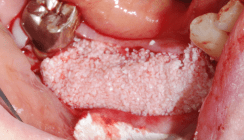
Die Knochenblockauflagerung erfolgte in lokaler Leitungs- und Infiltrationsanästhesie. Auch die Schleimhaut des Gaumens wurde mit einer Injektion im Bereich des linken Foramen palatinum und am Foramen incisivum anästhesiert. Nach leicht palatinal verschobener krestaler Schnittführung wurde ein voller Mukoperiostlappen mobilisiert und die Knochenoberfläche gründlich kürettiert und von anhaftendem Weichgewebe befreit. Der vorgefertigte gefräste Knochenblock wurde parallel dazu in steriler physiologischer Kochsalzlösung gewässert und anschließend durch Trimmen der spongiösen Unterseite des Blocks mit rotierenden Instrumenten exakt an die Oberfläche des ortsständigen Lagerknochens angepasst. Eine hohe Kontaktrate und ein spaltfreier Sitz des Knochenblocks stellen wesentliche Erfolgsfaktoren der Blockaugmentation dar. Scharfe Kanten des allogenen Knochenblocks wurden anschließend sorgfältig geglättet und die Randbereiche mit allogenem Granulat (OsteoGraft®, Argon Dental) aufgefüllt. Über die vorgefertigte „full-guided“-Bohrschablone wurden die drei Implantate direkt durch den Block osseointegriert. Eine minimalinvasive Zugangserweiterung der Implantatloge mit einem gesplitteten Mukosalappen im Bereich des harten Gaumens ermöglichte die Entnahme eines subepithelialen Bindegewebetransplantats. Dieses subepitheliale Bindegewebetransplantat wurde nach Aktivierung mit einem Gel (Osteo Barrier Gel®, Argon Dental) in direktem Kontakt über dem knöchernen Augmentat platziert. Dieses Gel ist ein ideales Stammzell-Aktivierungsmaterial, das als Plasmamembranproteinenträger eine Natriumhyaluronat-Lösung enthält. Natriumhyaluronat spielt eine essenzielle Rolle bei der lokalen Zellproliferation, Migration und Adhäsion und unterstützt in unserem Fall das „Stem Cell Homing” für eine optimale Osteogenese. Das gesamte Wundgebiet wurde mit einer gepinten Epiflex-Membran komplett abgedeckt. Anschließend erfolgte der Wundverschluss nach Periostschlitzung und plastischer Untertunnelung mittels fortlaufender Naht (Prolene 5/0). Die Nahtentfernung erfolgte nach 14 Tagen.
Prothetik
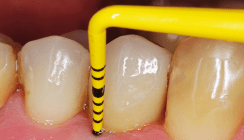
Nach vier Monaten komplikationsfreier geschlossener Einheilzeit erfolgte die Eröffnung des augmentierten Areals über eine identische Schnittführung und die Implantatfreilegung. Die Suprakonstruktion wurde mit zementierten, verblockten Kronen ausgeführt (Abb. 13).
Histologie
Die Histo-Analyse der nicht dekalzifizierten Knochenschnitte (Abb. 14) zeigt eine überzeugende periimplantäre Knochenneubildung: die Trepanbiopsie (5-fache Vergrößerung, Toluidin-Färbung) zeigt vitalen neugebildeten spongiösen Knochen mit einer trabekulären Architektur als Ausdruck einer initialen induktiv bedingten Knochenneubildung das augmentierte Knochenareal zeigt nach viermonatiger Einheilzeit (5-fache und 10-fache Vergrößerung, Toluidin-Färbung) eine Neoformation von Trabeculae (T), die sich zwischen dem „stem cell-supported bone substitute” deutlich hervorhebt die TRAP-Färbungen zeigen den osteoklastären Anteil an der Knochenneubildung
Die polarisationsoptischen Darstellungen verweisen auf die Neubildung im Faserknochenbereich als Ausdruck einer regenerativ-(osteoinduktiv-)bedingten Knochenregeneration, die allein von einem allogenen KEM nicht geleistet werden kann (Abb. 15).
Diskussion und Schlussfolgerungen
Die Arbeitsgruppe um Chaushu und Nissan von der Universität Tel-Aviv publizierte in der jüngeren Vergangenheit zahlreiche Daten über allogene Knochenblockaugmentationen und anschließende Implantatversorgungen bei Patienten mit atrophischen Unterkiefern, traumatischem Zahnverlust oder Nichtanlage von Zähnen (Chaushu et al. 2010, Nissan et al. 2011, 2011/2, 2011/3, 2011/4). Sie berichten über hohe Erfolgsquoten allogener Knochenblöcke von 92 % und Implantatverlustraten von 4,4 % (Chaushu et al. 2010) sowie über Block- und Implantatüberlebensraten von über 90 % in der anterioren Maxilla (Nissan et al. 2011/3, 2011/4) bzw. Blocküberlebensraten von 79 % in der atrophischen lateralen Mandibula (Nissan et al. 2011/2). In der zitierten Arbeit wurden gefriergetrocknete und zudem rein-spongiöse allogene Knochenblocktransplantate verwendet. Eigentlich wäre zu erwarten gewesen, dass durch das Fehlen einer bedeckenden Kompakta eine stärkere Resorption des marginalen Knochens im Vergleich zu kortikospongiösen auto- oder allogenen Knochentransplantaten, insbesondere in der initialen Belastungsphase, eintritt.
Im Gegenteil scheint es, dass in der Untersuchung von Nissan und Mitarbeitern nicht nur die Knochenabbauraten sehr gering, sondern zudem die Schwankungsbreiten deutlich kleiner sind. Offenbar ist zudem kein einziges der 85 untersuchten Implantate nach durchschnittlich 37 Monaten von einem Knochenabbau über 1 mm betroffen.
Nissan et al. beschreiben in der Diskussion ihrer Studie die Tatsache, dass die bukkale Knochenwand an den Implantaten bei Insertion stets 2 mm oder breiter war. Untersuchungen von Spray et al. (2000) zufolge korreliert eine bukkale Knochenwand breiter als 1,8 mm bzw. 2 mm mit geringeren periimplantären Knochenabbauraten unter Funktion. Die Breite der bukkalen Knochenwand wurde von uns in der vorliegenden Falldarstellung hingegen nicht dokumentiert.
Chaushu et al. (2010) berichten über Komplikationen, die in Zusammenhang mit Kieferkammaugmentationen mit allogenen, spongiösen Knochenblöcken aufgetreten sind. Es wurden 101 Patienten mit 137 allogenen Spongiosablöcken versorgt und 271 Implantate inseriert. Ein teilweiser Verlust des Augmentats trat in 7 % der Fälle, ein Totalverlust in weiteren 8 % der Fälle auf. 4,4 % der Implantate gingen verloren. Ähnliche Beobachtungen stellten auch Keith et al. (2006) in ihrer prospektiven Multicenterstudie zum Einsatz des allogenen Puros®-Blocks an. Dieses Knochenmaterial ist vergleichbar mit dem eingesetzten, prozessierten DIZG-Knochenmaterial.
Amorfini und Mitarbeiter (2013) kommen zu dem Schluss, dass allogene Spongiosablöcke bei der Augmentation von Kieferkämmen zu einer vergleichbaren knöchernen Regeneration führen, wie die standardmäßige GBR mit autogenem Knochen. Die zusätzliche Beimischung von rhPDGF-BB hatte einen positiven Effekt auf die Weichgewebeheilung. Keine der genannten Publikationen ermittelte jedoch den Langzeiterfolg von Implantaten nach allogener Knochenblocktransplantation, insbesondere nicht über das erste Jahr hinaus.
Die hier vorliegende Untersuchung stellt nach derzeitigem Wissensstand (Grimm et al. 2015) erstmals eine Falldarstellung mit systematisch erhobenen histologischen Werten für den marginalen Knochenabbau nach „Stem Cell Homing“-unterstützter allogener Knochenblockaugmentation dar. Der Effekt des subepithelialen Bindegewebetransplantats als natürliche Stammzellressource für die Knochenregeneration kann nur in einer randomisierten Vergleichsstudie und auf histologischer Ebene abschließend bewertet werden. Diese Patientenbeobachtungsstudie ist jetzt als multizentrische Vergleichsstudie von einem interdisziplinären Fo-Team (Argon Dental) gestartet wurden.
Zusammenfassend kann aus dieser Falldarstellung geschlussfolgert werden, dass das „Stem Cell Homing” auf der Grundlage der neural crest stem cells (NCSCs) eine vielversprechende Bereicherung periimplantärer Augmentationsmethoden in Verbindung mit einer Sofortimplantatversorgung darstellt. Die eingesetzten Materialien (Konus K3Pro Rapid Implantatsystem, OsteoGraft-Produktsystem, Argon Dental) unterstützen mit systemimmanenten Eigenschaften das „Stem Cell Homing”.
Danksagung
Wir bedanken uns für die Durchführung der Knochenhistologie bei Prof. F. Witte und seinem Team vom Institut für Regenerative Medizin an der Charité in Berlin und bei ZTM Andreas Scherberich für die Herstellung der Implantatsuprakonstruktionen und bei ZT Bernhard Zierer für die 3-D-Blockfräsung.
Eine vollständige Literaturliste kann beim Autor angefordert werden.
Co-Autor: Dr. med. dent. M. A. Vukovic