Prophylaxe 18.10.2018
Target des nichtinstrumentellen Biofilmmanagements
share
Fusobacterium nucleatum
In der Praxis der modernen Dentalhygiene und des Präventionsmanagements liegt der Schwerpunkt auf dem Biofilmmanagement. Bisher bestand der Goldstandard der Dentalhygiene und der Prävention vor allem in der mechanischen Instrumentation der Zahn- und Wurzeloberfläche im Sinne des supra- und subgingivalen Scaling and Root Planing. Doch im Zuge tieferer Erkenntnisse in die Ätiopathogenese parodontaler Erkrankungen entfernt sich der Fokus von der rein mechanischen Reinigung und richtet sich im Sinne eines Biofilmmanagements auf innovative Strategien aus.
Hinsichtlich der Komplexität der Biofilmentstehung bietet sich ein weites Spektrum an denkbaren Strategien, um den Entstehungsprozess sowie die Struktur und die Pathogenität der Biofilme zu beeinflussen. Im Sinne der Minimalinvasivität zur Reduktion der Patientenmorbidität werden neue supportive Methoden entwickelt und eruiert, um schließlich in der Praxis evidenzbasiert angewandt werden zu können. Hierauf begründet sich das steigende Interesse an nichtinstrumentellen Strategien zum Management von oralen Biofilmen. In den letzten beiden Jahrzehnten erlangten natürliche Wirkstoffe, die sowohl antibakterielle als auch antiinflammatorische Eigenschaften besitzen, Aufmerksamkeit als potenzielle, neue therapeutische Mittel für die Prävention und Behandlung von parodontalen Infektionen.
 Abb. 1: Rasterelektronenmikroskopische Darstellung fusiformer Bakterien auf der Wurzeloberfläche eines extrahierten Zahns. © Roxane Pfeiffer, B.Sc., Prof. Dr. Georg Gaßmann
Abb. 1: Rasterelektronenmikroskopische Darstellung fusiformer Bakterien auf der Wurzeloberfläche eines extrahierten Zahns. © Roxane Pfeiffer, B.Sc., Prof. Dr. Georg Gaßmann
80 Prozent der weltweiten mikrobiellen Biomasse kommen im Biofilmstadium vor.7 Sessile Zellen werden als die vorherrschende Lebensweise von Mikroorganismen betrachtet. Diese Zellen exprimieren Phänotypen, die sich deutlich von den entsprechenden nichtadhärenten, planktonischen Spezies unterscheiden. Abhängig von der Beteiligung mikrobieller Spezies und ihrer Lokalisation können Biofilme entweder förderlich oder schädlich für den Menschen sein. Laut den National Institutes of Health (NIH) werden über 75 Prozent mikrobieller Infektionen im menschlichen Körper durch die Formation und Persistenz von Biofilmen begünstigt. Biofilme sind allgegenwärtig. Fast alle Spezies von Mikroorganismen, Bakterien, Pilzen, Algen, Hefen, Protozoen und Viren können an Oberflächen oder an einander anhaften, um sie zu bilden. Biofilme, an deren Bildung pathogene Bakterien beteiligt sind, stellen eine potenzierte Pathogenquelle dar. Sie sind in infektiöse Erkrankungen involviert, wie z. B. bei Osteomyelitis und Parodontitis. Ebenso spielen Biofilme in der Entstehung von chronischen Erkrankungen wie Lungeninfekten, nosokomialen Infektionen, Wundinfektionen und Karies eine wichtige Rolle.26
Es gibt bisher zwei grundlegende Strategien, die in der Lage sind, die Biofilmformation zu beeinflussen: die Blockierung der Oberflächenanhaftung und die Störung der reifen Biofilmstrukturen. Wirkstoffe, die auf die Komposition und Architektur des Biofilms Einfluss nehmen, sollten möglichst spezifisch sein und zielorientiert eingesetzt werden können, da deren Gebrauch ansonsten die Komposition eines symbiotischen bzw. kommensalen Ökosystems beeinträchtigen und nutzbringende Mikrobiota beschädigen könnte.
Konventionelle und aktuelle nichtinstrumentelle Therapien im Management von Biofilmen zielen meist auf eine unspezifische prinzipielle Toxizität für orale Bakterien ab, ohne zu berücksichtigen, dass das orale Mikrobiom integraler Bestandteil des Beginns des Verdauungstrakts ist. Daher gibt es bisher zur Unterstützung der mechanischen Instrumentierung keine Ideallösung für das, was darüber hinaus als wirkliches Biofilmmanagement bezeichnet werden könnte. Der Schlüssel könnte in einer kombinierten Applikation von verschiedenen Mitteln liegen, um verschiedene Mechanismen mit synergetischem Potenzial zu nutzen, um sowohl die Biofilmarchitektur zu beeinflussen als auch in diesem Zuge die Integration pathogener Bakterien zu verhindern.26
Es gibt weitere Strategien, wie beispielsweise die Vakzinationsstrategie von Liu et al. (2013). Der Impfstoff gegen das orale Bakterium Fusobacterium nucleatum (F.n.) zielt vor allem auf FomA ab, einem Außenmembranprotein, das in bakterielle Koaggregation involviert ist. Diese Methode kann als ein Pionier für die Impfung gegen pathogene Biofilme angesehen werden.21 Die Modifikation der Genexpression der Pathogene innerhalb des Biofilms durch probiotische Pendants könnte eine weitere interessante Managementmethode darstellen. Diese könnte folgenden Doppelzweck bewirken: die Einschränkung bakterieller, oraler Kolonisation einerseits und die Inhibition der Expression von Virulenzfaktoren anderseits.26
Nicht nur für die Behandlung einiger besonderer Patientengruppen wie Raucher oder Diabetiker werden ergänzende oder substituierende Therapien benötigt. Diese könnten prinzipiell hilfreich erscheinen, um die Parodontopathogene zu reduzieren oder in ihrer Pathogenität zu beeinflussen. Dies vor allem auch vor dem Hintergrund, dass die bisherige Strategie mit Antibiotika sicher ihren Beitrag zur Entwicklung von Antibiotikaresistenzen, eines der größten sich abzeichnenden Probleme, beigetragen hat. So hat der weltweite Antibiotikagebrauch zur Kontrolle und Prophylaxe bakterieller Pathogene zur Resistenzbildung vieler Bakterien geführt. Ebenso trug die kontinuierliche Kombination von Tierfutter mit niedrig dosierten Antibiotika zu dieser Resistenzbildung bei.14 Dieses Problem spitzt sich offensichtlich weiter zu, wenn man berücksichtigt, dass die parodontopathogenen Bakterien von der Mundhöhle aus über die Blutbahn zu anderen Organen gelangen und dort Infektionen auslösen können oder ihre Resistenzen auf andere Bakterien übertragen können.
F.n.-Stämme, die gegenüber Amoxicillin, Clindamycin und Metronidazol resistent sind, konnten bereits isoliert werden. Vor dem Hintergrund der resistenten Bakterien werden neue, vorzugsweise kostengünstige Alternativen zu den konventionellen Antibiotika notwendig sein.6 Auch die steigende Anzahl der Infektionen, die durch resistente Bakterienisolate ausgelöst wurden, führte zur Suche nach neuen antimikrobiellen und chemotherapeutischen Mitteln. Vor allem natürliche Chemikalien und Pflanzenprodukte stehen hierbei als potenzielle Behandlungsmodalitäten für orale biofilmassoziierte Infektionserkrankungen im Fokus.14
Ausgehend von den bisher erläuterten Strategien und den folgenden Zusammenhängen der Biofilmformation liegt die Überlegung nahe, dass durch die Inhibition des sogenannten oralen „Brückenkeims“ F.n. bzw. dessen Aktivitäten möglicherweise eine pathogene Biofilmbildung vermieden werden könnte. Da F.n. eine wesentliche Rolle in der Integration der Keime des roten Komplexes zugeschrieben wird, könnte sich durch besagte Inhibition zumindest eine Erschwernis oder Hemmung für die Entwicklung der Pathogenität des Biofilms ergeben. In dem Zusammenhang ergeben sich die Fragen, welche Rollen F.n. bei der Biofilmformation einnimmt, welche Funktionen sich bei F.n. blockieren lassen und welche Mittel dafür zum Einsatz kommen könnten. Hieraus ergibt sich schließlich die Frage, wie sich die Inhibition von F.n. auf die Pathogenität des parodontalen Biofilms auswirkt (Abb. 1). Schließlich ist davon auszugehen, dass jede Strategie zum Eingriff in die mikrobielle Welt früher oder später eine Gegenstrategie hervorrufen wird.
Das Ziel dieser Literaturanalyse bestand darin, eine Übersicht darüber zu geben, welche möglichen nichtinstrumentellen Strategien bisher verfolgt wurden, die im parodontalen Biofilmmanagement der Zukunft mit dem Fokus auf F.n. eine Rolle spielen können (Abb. 2).
 Abb. 2: Übersicht über die verschiedenen Strategien eines Fusobacterium nucleatum-fokussierten Biofilmmanagements. © Roxane Pfeiffer, B.Sc., Prof. Dr. Georg Gaßmann
Abb. 2: Übersicht über die verschiedenen Strategien eines Fusobacterium nucleatum-fokussierten Biofilmmanagements. © Roxane Pfeiffer, B.Sc., Prof. Dr. Georg Gaßmann
Biofilm und Parodontitis
Im Jahre 2006 litten rund 70 Prozent der deutschen Erwachsenen unter Parodontitis. Parodontale Erkrankungen gelten schon seit Jahren als Volkskrankheiten. Im Zuge des demografischen Wandels zeichnet sich in der erneuten Erhebung aus dem Jahre 2014 ab, dass es vor dem Hintergrund der immer älter werdenden Bevölkerung in Deutschland zu einer Morbiditätskompression kommt, die besagt, dass sich Krankheitsausbrüche immer weiter in ein höheres Alter verlagern und damit in der Morbiditätskompression münden. Während der prozentuale Zahnverlust durch Karies immer weiter sinkt, erfahren Zahnverluste durch Parodontitis einen stetigen Anstieg.15,18,25
Die beiden häufigsten und meistuntersuchten parodontalen Erkrankungen sind die mit dentaler Plaque assoziierte Gingivitis und die chronische Parodontitis. Während Gingivitis eine reversible Form der Zahnfleischentzündung darstellt, geht die chronische Parodontitis mit irreversibler Gewebsdestruktion einher. Dabei kann die Gingivitis in eine Parodontitis übergehen, dies ist jedoch neben dem Biofilm als Infektionsquelle von weiteren Wirtsfaktoren abhängig.35
Die Parodontitis bezeichnet einen chronischen, multifaktoriell bedingten, entzündlichen Erkrankungsverlauf2, der durch die Ansammlung von bakteriellem Biofilm auf der Zahnoberfläche ausgelöst und durch eine beeinträchtigte lokale und systemische Immunreaktion vorangetrieben wird.27 Zusätzlich können sowohl die Initiation als auch die Progression der Parodontitis durch verschiedene Risikofaktoren modifiziert werden.28 Solche Risikofaktoren sind einerseits lokal, wie Mundatmung oder insuffiziente Zahnrestaurationen, andererseits systemisch wirkend, wie z. B. Tabakkonsum, Diabetes oder genetische Dispositionen. Auch Übergewicht oder Osteoporose können parodontale Erkrankungen begünstigen.20,34 Hierbei ist anzumerken, dass bis dato nicht alle Parameter, die zur Initiation und möglicherweise Progression der Parodontitis beitragen, identifiziert werden konnten.28
Trotz des multifaktoriellen Spektrums an Einflüssen auf die Ätiopathogenese wird die orale mikrobielle Belastung als einer der Hauptakteure in der Entstehung von Parodontitis angesehen. Wie alle äußeren Oberflächen des menschlichen Körpers, wird auch die Mundhöhle als Habitat für eine ausgeprägte Mikroflora genutzt, die in Symbiose bzw. im Kommensalismus mit dem gesunden Wirt lebt.28 Das heißt, dass im gesunden Zustand eine gewisse Balance zwischen den Mikroorganismen in der Mundhöhle und den Geweben bzw. den Zellen des Zahnhalteapparats und der Mundhöhle besteht.35 Diese Balance wird als Homöostase bezeichnet und ist gekennzeichnet durch die ausgeglichene Beziehung zwischen den Wirtsgeweben und der vorherrschenden Mikrobiota.12 Die Mikroflora der Mundhöhle besteht aus Hunderten Arten aerober und anaerober Bakterien und beherbergt sowohl kommensale als auch pathogene Bakterien. Diese haften an der Zahnoberfläche, vermehren sich und reifen dort über mehrere Stadien zu einem Biofilm heran.28
Zu Beginn der Biofilmformation erfolgt die Anhaftung erster Bakterien, also die Frühbesiedlung, auf der Zahnoberfläche unter Nutzung des Pellikels.3 Das Pellikel besteht aus verschiedenen Glycoproteinen, Antikörpern und Enzymen aus dem Speichel, die sich einige Minuten nach Reinigung der Zahnoberfläche dort anlagern und innerhalb einer Stunde von Mikroorganismen von den erstbesiedelnden Keimen zur Anheftung an den Zahn genutzt werden. Als Frühbesiedler sind grampositive Kokken und Stäbchen zu nennen. Daraufhin erfolgt die Integration weiterer bakterieller Spezies und eine Phase der Wachstumsverzögerung. Durch die Anheftung der Bakterien an das Pellikel findet eine Verschiebung von planktonischer zu sessiler Lebensweise statt. Dafür wird eine Aufregulation der genetischen Expression von Virulenzfaktoren ausgeführt, um dementsprechend die Phänotypen der Bakterien zu verändern. Während dieser genetischen Expression erfährt das bakterielle Wachstum eine Ruhephase.
Auf diese Phase folgt ein Stadium schnellen Wachstums. Hierbei setzen die adhärenten Bakterien, wie beispielsweise S. gordonii, große Mengen extrazelluläre Polysaccharide frei, um die Matrix für den Biofilm zu bilden. In dieser Matrix kann daraufhin das Wachstum von Mikrokolonien stattfinden. Mit der Zeit können sich weitere Bakterienarten, wie z. B. weitere gramnegative Organismen, anhaften, sodass die Komplexität des Biofilms steigt. Dieser Vorgang wird auch Koaggregation genannt (Abb. 3).
 Abb. 3: Rasterelektronenmikroskopische Darstellung eines subgingivalen, polybakteriellen Biofilms. © Roxane Pfeiffer, B.Sc., Prof. Dr. Georg Gaßmann
Abb. 3: Rasterelektronenmikroskopische Darstellung eines subgingivalen, polybakteriellen Biofilms. © Roxane Pfeiffer, B.Sc., Prof. Dr. Georg Gaßmann
Danach fahren einige Bakterienarten im Inneren des Biofilms ihr Wachstumsverhalten herunter und werden zu ruhenden Mikroorganismen. Im Gegensatz dazu sind die Bakterienarten an der Oberfläche des Biofilms stets aktiv. In dieser Phase können Kristalle in der interbakteriellen Matrix beobachtet werden, welche die initiale Zahnsteinmineralisation repräsentieren. Außerdem beginnen die bakteriellen Mikrokolonien, sich partiell abzusondern, um neue Kolonien des Biofilms zu bilden.
Sofern der Biofilm unangetastet bleibt, durchläuft er die zuvor beschriebenen Phasen und damit einen Reifungsprozess, die sogenannte Maturation.9 Vor allem die Verschiebung der Mikrobiota von vorwiegend grampositiven Bakterien hin zu dominierenden, gramnegativen Bakterien kennzeichnet den parodontalen Biofilm.23 Außerdem werden einigen Bakterienarten eubiotische Eigenschaften zugeschrieben. Solche Spezies, die mit gesunden Verhältnissen einhergehen, können beispielsweise Streptokokken sein.9 Demgegenüber stehen Bakterienarten, die vorrangig mit Parodontitis assoziiert werden, z. B. Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola und auch Fusobacterium nucleatum. Sie werden auch als Markerkeime bezeichnet.23
Socransky et al. beschrieben 1998 in ihren Beobachtungen subgingivaler Plaqueproben fünf Hauptkomplexe mikrobieller Kulturen. Einer von ihnen ist der rote Komplex. Dieser besteht aus Bakterienarten, die mit progressiven, parodontalen Infektionen assoziiert werden. Die Bakterien im roten Komplex sind die eng miteinander verbundenen Spezies Tannerella forsythia, Porphyromonas gingivalis (P.g.) und Treponema denticola. Diese Bakterien scheinen in Beziehung zu erhöhten parodontalen Taschensondierungstiefen und der Blutung auf Sondierung zu stehen.33 Die Assoziation von P.g. mit parodontalen Erkrankungen beruht auf Studien, die zeigten, dass diese Spezies ungewöhnlich für sowohl gesunde Verhältnisse als auch Gingivitis sind, aber bei destruktiven Formen von Erkrankungen in sehr hoher Anzahl nachweisbar waren.8
Ein weiterer Komplex ist der orangene, welcher u. a. Fusobacterium nucleatum und Prevotella intermedia beinhaltet. Diese Bakterienspezies scheinen der Kolonisation des roten Komplexes voranzugehen und diese auch zu initiieren.33 Diese Erkenntnisse deuten an, dass die parodontale Integration des roten Komplexes durch Bakterien des orangenen Komplexes, vor allem durch F.n., maßgeblich zur Virulenzsteigerung des Biofilms und auch zur Entstehung und Progression parodontaler Infektionen beiträgt.11
Orale bakterielle Biofilme liegen einerseits an der Zahnoberfläche an und andererseits an den Epithelzellen des Parodontiums.2 Daraus ergibt sich die kontinuierliche Belastung der parodontalen Gewebe mit mikrobiellen Organismen und deren freigesetzten Produkten.24
Eine intakte Immunabwehr ist in der Lage, die mikrobielle Belastung in Schach zu halten. Wird jedoch die Homöostase zwischen den vorherrschenden Mikrobiota und dem Wirt zugunsten der pathogenen Mikroorganismen gestört, entsteht eine Dysbiose, die meistens zu einer Entzündungsreaktion führt.12 Mögliche Störfaktoren sind die Beeinträchtigung der Wirtsantwort, beispielsweise durch eine systemische Erkrankung oder einen Anstieg der mikrobiellen Belastung, z. B. durch Vernachlässigung der Mundhygiene.36
Infolgedessen entsteht zunächst eine milde, reversible Form der parodontalen Erkrankung – Gingivitis. Dauert die Unterlegenheit des Immunsystems allerdings länger an oder erhöht sich die Plaqueakkumulation weiter, kann die irreversible Entzündung des Parodontiums die Folge sein.9 Ob die Plaqueakkumulation in einer marginalen Entzündung (Gingivitis) oder in irreversibler Zerstörung des Zahnhalteapparats (Parodontitis) resultiert, hängt von der Art der Wechselwirkung zwischen den beteiligten Komponenten ab.35
Fusobacterium nucleatum
Dieses Bakterium zeichnet sich durch seine besonderen Eigenschaften im Vergleich zu anderen oralen Bakterien aus. Dadurch kann es in einer bedeutenden Schlüsselrolle des Biofilmmanagements gesehen werden.
F.n. ist ein gramnegatives, anaerobes, orales Bakterium, das für gewöhnlich einen Teil der oralen sowie der gastrointestinalen Mikroflora ausmacht. Dieses Bakterium ist sowohl unter gesunden Verhältnissen als auch bei krankhaften Situationen der Mundhöhle nachzuweisen. Jedoch scheint die Prävalenz mit der Schwere der Erkrankung, dem Fortschreiten der Entzündung und erhöhten Sondierungstiefen zu steigen.13 F.n. ist ein unbeweglicher, nicht sporenbildender, spindelförmiger Bazillus.14 Die optimalen Wachstumsbedingungen für diesen Bazillus ergeben sich aus einer Temperatur von 37 °C und anaeroben Bedingungen in Verbindung mit einem pH-Wert, der sich zwischen pH = 6 und pH = 8 befindet.29 F.n. wird mit verschiedenen Formen parodontaler Erkrankungen assoziiert. Es ist einer der hauptverantwortlichen Akteure der physischen Interaktion zwischen kommensalen grampositiven Frühbesiedlern und parodontopathogenen gramnegativen Spätbesiedlern. F.n. trägt daher maßgeblich zur Integration und Etablierung von Bakterien des roten Komplexes bei. Folglich ist F.n. auch an der Entstehung parodontaler Infektionen beteiligt, da der rote Komplex insbesondere mit der Entstehung von parodontalen Taschentiefen und Blutungen auf Sondierung assoziiert wird.8
Ebenso wird F.n. als ein Übergangsorganismus zwischen supra- und subgingivaler Plaque gesehen. Es besitzt die Fähigkeit, zur Energiegewinnung verschiedene Zucker abzubauen, und kann Aminosäuren sowie Peptide fermentieren. Folglich produziert F.n. Säuren, wenn Zucker verfügbar sind, und Basen, sofern Aminosäuren zur Verfügung stehen.31 F.n. stellt außerdem flüchtige Schwefelverbindungen z. B. H2S her und steht deshalb repräsentativ für die Entwicklung von Halitosis. Auch für eine Vielzahl extraoraler Infektionen ist F.n. mitverantwortlich, da es über den Blutkreislauf an Endokarditis, Darmentzündungen, Harnwegsinfekten und Gehirnabszessen sowie Frühgeburten u.v.m. beteiligt sein kann.5,13,22 Daran anknüpfend wird angenommen, dass F.n. aus der mütterlichen Mundhöhle über hämatogene Transmission in die intrauterine Kavität wandern kann und dort zu Infektionen, bis hin zum Tod des Fötus führen könnte.13
Eine der wichtigsten Eigenschaften für die Aufrechterhaltung des Bestands von F.n. besteht in der Vielfalt seiner Möglichkeiten, mit Koaggregationspartnern im Biofilm in Interaktion zu treten.19 Die Biofilmformation steuert das Überleben, die Invasivität und das Tolerieren aerober Bedingungen von F.n. durch das Eindringen ins Epithelium. Dieser Bazillus ist in der Lage, seine Außenmembranpermeabilität zu senken, um vor antimikrobiellen Einflüssen geschützt zu sein.14
Außerdem enthält die Außenmembran von F.n. eine Anzahl an Adhäsinen, die an Speichelproteine, Bakterien und Wirtszellen, vor allem an Erythrozyten, polymorphnuklearen Leukozyten und Lymphozyten anhaften können.6,21 Eines der Außenmembranproteine ist FomA. Dieses Protein ist ein Porin, d. h. ein porenformendes Transmembranprotein in der äußeren Membran von gramnegativen Bakterien. Es fungiert als dynamische Schnittstelle zwischen F.n. und den umgebenden Strukturen. Es dient zum Stofftransport, zur Adhäsion zu anderen Zellen und kann eine Vielzahl an Substanzen binden. Auch dieses Außenmembranprotein ist mitverantwortlich für die Bildung von antimikrobiellen Resistenzen, indem es die Antimikrobiotika von der Zelloberfläche entfernt. Zusätzlich weist FomA Permeabilitätseigenschaften auf. Es erleichtert den Bakterien die Evasion des Immunkontrollsystems des Wirts, indem es sich an ein Fragment von IgG (Immunglobulin G) haftet. Zusätzlich zeigt F.n. hämolytische Aktivität.21
Eine weitere Eigenschaft von F.n. stellt die Produktion von sogenannten Autoinducern dar. Innerhalb von Biofilmformationen besteht eine Steuerung via Quorum sensing. Dies ist ein Zell-zu-Zell-Kommunikationsmechanismus, der über kleine Signalmoleküle bzw. Quorum sensing-Moleküle oder sogenannte Autoinducer ausgeführt wird. Diese Moleküle fungieren als kleine Bestandteile einer chemischen „Sprache“ und koordinieren die bakteriellen Populationsverhaltensweisen. Die bakterielle Population kann Erhöhungen der Zelldichte wahrnehmen und in Anpassung ihre Genexpression alterieren. Diese Veränderung nehmen die Bakterienkulturen ständig vor, um ihre physiologische Reaktion auf verschiedene Umgebungsstimuli kontinuierlich zu optimieren. Demzufolge trägt F.n. mit dessen Produktion von Autoinducern zur Modifikation der bakteriellen Phänotypen im Biofilm bei.14
Des Weiteren scheint F.n. in der Invasion von Epithelzellen, der Apoptose von Lymphozyten und der Stimulation der Expression von Zytokinen und Matrixmetalloproteinasen (MMP) der Wirtszellen mitverantwortlich zu sein. MMPs werden von residenten, somatischen Zellen oder Immunzellen der parodontalen Gewebe produziert. Unter gesunden Bedingungen tragen MMPs zum Turnover des parodontalen Bindegewebes bei. Jedoch wird ihre Überproduktion während einer Infektion mit der enormen Degradation von parodontalem Weich- und Hartgewebe in Verbindung gebracht. F.n. kann die Produktion von MMP-2, MMP-9 und MMP-13 in Epithelzellen anregen.37 Zusätzlich aktiviert es die Sekretion von proinflammatorischen Zytokinen wie IL-6, IL-8 und TNF-α.13
An F.n. wird der opportunistische Charakter der parodontalen Infektion besonders deutlich, wenn man bedenkt, dass dieses Bakterium unter der Homöostase zu deren Balance beiträgt, aber unter Dysbiose die Entzündungsreaktion maßgeblich vorantreibt und sich so zu einem Pathogen wandelt.
Da F.n. nicht nur eine zentrale Rolle während der pathogenen Biofilmformation einnimmt, sondern zudem ein breites Spektrum von Virulenzfaktoren aufweist und zur proinflammatorischen Stimulation von Wirtszellen beiträgt, scheint es ideal als Schlüsselziel für das Management von Biofilmen zu sein.
Ergebnisse
Zur übersichtlichen Ergebnissicherung wurden die systematisch erschlossenen Publikationen in thematische Gruppen unterteilt. In drei Studien wurde die Wirkung von Polyphenolen als mögliches therapeutisches Mittel in Bezug auf F.n. untersucht. Drei weitere Studien beschäftigten sich mit dem Einfluss verschiedener Zuckerarten auf F.n. und der Wirkung auf die Biofilmformation. Zwei von zwölf Studien untersuchten den Effekt von photodynamischer Therapie auf F.n. und das Biofilmmanagement. In einer Publikation wurde die Wirkung von DNase I und Proteinase K auf F.n. und die Biofilmbildung untersucht. Außerdem ergab die Suche jeweils einen Treffer zur Untersuchung des Effekts von Benzimidazolen, Povidon-Iod und essenziellen Ölen auf die Biofilmbildung bzw. das Biofilmmanagement und F.n.
Die Publikationen, die sich mit dem Effekt verschiedener Polyphenole auf F.n. beschäftigten, resultieren alle drei in positiven Aussagen. Trotz der Verwendung von jeweils unterschiedlichen Polyphenolarten verzeichneten alle drei Studien eine Hemmung der F.n.-induzierten Biofilmformation. Ben Lagha et al. konnten 2017 beobachten, dass Grün- und Schwarzteeextrakte, Epigallocatechin-3-gallat (EGCG) und Teeflavine antibakterielle und antiadhärente Wirkungen gegen F.n. besitzen. He et al. verwendeten 2016 das Polyphenol Resveratrol, und Ben Lagha et al. fokussierten sich 2015 auf Polyphenole aus Blaubeerextrakten.5,6,14
Zusätzlich wurde in einer dieser Studien die Adhärenz von F.n. zu Epithelzellen reduziert. F.n.-Zellen, die im Biofilm eingebettet waren, konnten zerstört werden, und die Teepolyphenole hemmten die hämolytische Aktivität sowie die H2S-Produktion von F.n.6 Ben Lagha et al. stellten 2015 außer der Hemmung der Biofilmformation fest, dass die Blockade des NF-ΚB Signalwegs durch die verwendeten Blaubeerextrakt-Polyphenole die Sekretion von Zytokinen und MMPs durch Makrophagen reduzierte.5 Im Gegensatz dazu wurde in der Untersuchung von He et al. (2016) gezeigt, dass Resveratrol keine signifikante Auswirkung auf die Genexpression von F.n. hatte.14
In drei der analysierten Studien widmeten sich die Autoren der Auswirkung von unterschiedlichen Zuckerarten auf F.n. Alle drei Untersuchungen kamen zu positiven Resultaten.19,30 Kolenbrander und Anderson (1989) sowie Ryu et al. (2016) widmeten sich vor allem dem Effekt von D-Galactose, während Jang et al. (2012) die Zucker Furanone und D-Ribose betrachteten. Die F.n.-induzierte Biofilmformation wurde in den Studien von Jang et al. (2012) und Ryu et al. (2016) durch den jeweiligen Zucker gehemmt. Zusätzlich verzeichneten Jang et al. (2012) eine Hemmung der Koaggregation und der Adhäsinexpression.17 Kolenbrander und Andersen (1989) hingegen wiesen die Hemmung der Koaggregation zwischen F.n. und P.g. durch die Zucker Lactose und D-Galactose nach.19
In den beiden Studien, welche die Auswirkung photodynamischer Therapie auf F.n. eruierten, wurden jeweils positive Ergebnisse verzeichnet.10,32 Im Review von Haag et al. (2015) stellten die Autoren fest, dass die photodynamische Therapie die F.n.-Zellen in In-vitro-Biofilmmodellen reduzierte. Sigusch et al. (2010) resümierten, dass die photodynamische Therapie zu signifikant reduzierten parodontalen Entzündungssymptomen bei Patienten mit lokalisierter chronischer Parodontitis während der dreimonatigen Beobachtungsperiode führte.32
In der einzigen, in diese Literaturanalyse eingeschlossenen Studie zur Effektivität von DNase I und Proteinase K konnte keine signifikante Auswirkung auf die F.n.-induzierte Biofilmformation verzeichnet werden.1 In der Studie von Sheng et al. (2006) zeigte sich, dass Benzimidazol den Katabolismus von F.n. unter anaeroben und sauren Bedingungen hemmte.31 Hosaka et al. beschäftigten sich 2012 mit der Effektivität von Povidon-Iod gegen den Biofilm, der durch P.g. und F.n. gebildet wird. Die Autoren zeigten, dass Povidon-Iod die In-vitro-Biofilmformation von F.n. und P.g. hemmte.16
In einer Studie, die den Effekt von essenziellen Ölen eruierte, konnte gezeigt werden, dass das essenzielle Öl von Sat. hortensis L. die Außenmembranpermeabilität von F.n. erhöhte und damit dessen Viabilität senkte. In diesem Zusammenhang wurde die MMP-2- und MMP-9-Aktivität der Epithelzellen, die von F.n. ausgelöst wurde, gehemmt.37
Fazit
Aus den Ausführungen wird ersichtlich, dass F.n. zum einen eine bedeutende Schlüsselrolle in der Biofilmbildung einnimmt und es bis dato einige versprechende spezifische Ansätze gibt, die in einem modernen Biofilmmanagement eine Rolle spielen könnten. Bisherige grundlegende Strategien, die in der Lage sind, die Biofilmformation zu beeinflussen, sind: die Blockierung der Oberflächenanhaftung und die Störung der reifen Biofilmstrukturen. Im Allgemeinen sollten Anti-Biofilm-Wirkstoffe spezifisch sein und zielorientiert eingesetzt werden, da deren Gebrauch ansonsten die Komposition des etablierten Ökosystems beeinträchtigen und die nutzbringende Mikrobiota beschädigen könnte.
Konventionelle und aktuelle nichtinstrumentelle Therapien im Biofilmmanagement zielen meist auf einzelne Bakterienspezies ab, ohne zu beachten, dass die meisten Infektionen, die durch Biofilme ausgelöst werden, sich aus der Persistenz polymikrobieller Biofilme ergeben. Daher gibt es bisher keine Ideallösung.
Der Schlüssel könnte die gleichzeitige Applikation von verschiedenen Mitteln sein, die Mechanismen mit synergetischem Potenzial implementieren, um sowohl die Biofilmstruktur zu stören als auch pathogene Bakterien abzutöten.26
Es gibt auch weitere Strategien, wie beispielsweise die Vakzinationsstrategie von Liu et al. (2013). Der Impfstoff gegen das orale Bakterium (F.n.) zielt vor allem auf FomA ab, einem Außenmembranprotein, das in bakterieller Koaggregation involviert ist. Diese Methode kann als ein Pionier für die Impfung gegen pathogene Biofilme angesehen werden.21
Die Modifikation der Genexpression der Pathogene innerhalb des Biofilms durch probiotische Pendants könnte eine weitere interessante Managementmethode darstellen.
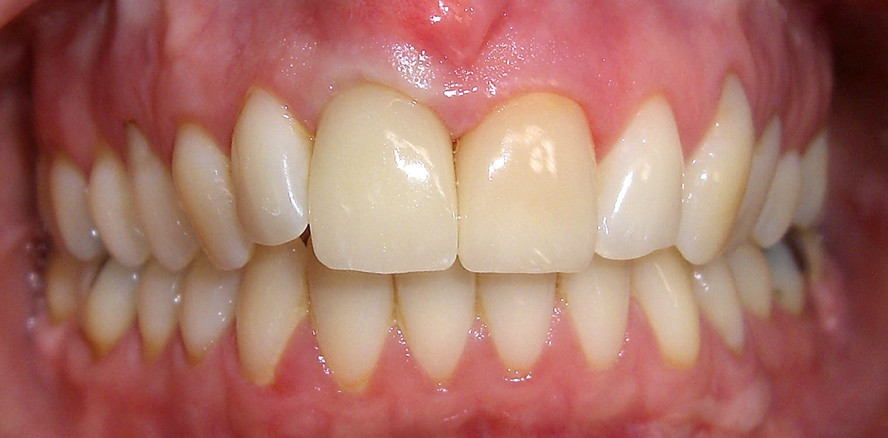
 Abb. 4: Intraorale Situation – leichte Entzündungszeichen erfordern ein selektives Biofilmmanagement. © Roxane Pfeiffer, B.Sc., Prof. Dr. Georg Gaßmann
Abb. 4: Intraorale Situation – leichte Entzündungszeichen erfordern ein selektives Biofilmmanagement. © Roxane Pfeiffer, B.Sc., Prof. Dr. Georg Gaßmann
Diese könnte folgenden Doppelzweck bewirken: die Einschränkung bakterieller, oraler Kolonisation und Inhibition der Expression von Virulenzfaktoren.26 Nicht nur für die Behandlung einiger besonderer Patientengruppen wie Raucher oder Diabetiker werden ergänzende oder substituierende Therapien benötigt (Abb. 4). Diese sind ebenso notwendig, um die Parodontopathogene zu entfernen, die sich in den Tiefen der parodontalen Taschen ansiedeln, auch vor dem Hintergrund, dass die Entwicklung von Antibiotikaresistenzen eines der größten auftretenden Probleme darstellt. Der weltweite Antibiotikagebrauch zur Kontrolle und Prophylaxe bakterieller Pathogene führte zur Resistenzbildung vieler Bakterien, ebenso wie die kontinuierliche Kombination von Tierfutter mit niedrig dosierten Antibiotika.14 F.n. erscheint als Target für das Biofilmmanagement geeignet und weist ein hohes Potenzial für präventive und therapeutische Modalitäten einer zukunftsorientierten Dentalhygiene auf (vgl. Abb. 2). Allerdings sind weitergehende Untersuchungen unabdingbar, um die Interaktionen zwischen den Komponenten in Biofilmen und dem menschlichen Immunsystem tiefer zu ergründen, um die weitere Entwicklung des Biofilmmanagements möglicherweise zu einer F.n.-fokussierten Präventionsstrategie weiterzuentwickeln.
Hinweis: Diese Literaturübersicht beruht zu einem wesentlichen Teil auf der Bachelorarbeit, die Roxane Pfeiffer, B.Sc. im Rahmen ihres Studiums „Dentalhygiene und Präventionsmanagement“ an der praxisHochschule in Köln verfasst hat und mit der sie den 2. Platz des jährlichen CP GABA Preises für Dentalhygiene 2017 belegte.
Weitere Autoren: Roxane Pfeiffer, B.Sc.
Die vollständige Literaturliste gibt es hier.
Der Beitrag ist im Prophylaxe Journal erschienen.
Bitte beachten Sie, dass CME-Tests nach zwei Jahren ihre Gültigkeit verlieren.