Prophylaxe 03.07.2018
Periimplantäre Mukositis und Periimplantitis
share
Herausforderung für Parodontologen und Oralchirurgen
Die Versorgung mit Zahnimplantaten zeigt bei Standardindikationen einen hohen Langzeiterfolg und ist eine gängige Therapieoption für den Ersatz fehlender Zähne.1 Dennoch stellen Erkrankungen wie periimplantäre Mukositis und Periimplantitis mit einer gewichteten mittleren Prävalenz von 22 bzw. 43 Prozent eine ernsthafte Komplikation in der modernen Zahnmedizin dar.2 Mit weltweit steigender Anzahl gesetzter Implantate gewinnen Prophylaxe und Therapie periimplantärer Entzündungen, die bei entsprechender Progredienz bis zum Implantatverlust führen können, zunehmend an Relevanz.3
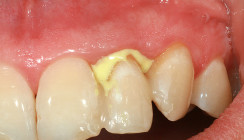
Die Einteilung periimplantärer Erkrankungen erfolgt anhand der Entzündungsausbreitung im Gewebe. Bei der periimplantären Mukositis ist die Entzündung auf das suprakrestale Weichgewebe um den Implantathals beschränkt. Ist zudem ein Knochenabbau vorhanden, der über das physiologische Maß des Knochenremodeling nach dem Setzen des Implantats hinausgeht, liegt eine Periimplantitis vor.4 Die periimplantäre Mukositis ist prinzipiell eine reversible Entzündung und entspricht der Gingivitis an natürlichen Zähnen. Anders ist es bei Periimplantitis, wo auf histopathologischer Ebene deutliche Unterschiede zur Parodontitis bestehen. Die Periimplantitis zeigt ein höheres Progressionspotenzial und eine im Vergleich erhöhte lokale Entzündungsantwort.5
Ätiologie und Risikofaktoren
Mukositis und Periimplantitis haben eine multifaktorielle Ätiologie, wobei als primäre Ursache ein bakterieller Biofilm, die Plaque, zugrunde liegt. Der Biofilm setzt sich vor allem aus einer gemischten, anaeroben Mikroflora zusammen, bei der gramnegative Bakterien dominieren. Auch Mischinfektionen mit Streptokokken und verschiedenen Pilzspezies wurden beschrieben.6 Während klassische Parodontalpathogene wie Porphyromonas gingivalis, Tannerella forsythia und Treponema denticola bei periimplantären Läsionen nachgewiesen werden, finden sich auch für Parodontitis untypische Keime wie Staphylococcus aureus, Helicobacter pylori, Haemophilus influenzae, Pseudomonas aeruginosa oder Staphylococcus anaerobius.7,8 Neben dem Biofilm können lokale und systemische Faktoren das Entstehen der periimplantären Entzündungen begünstigen.4 Risikofaktoren mit gesicherter Evidenz für eine Assoziation sind eine parodontale Vorerkrankung, mangelnde Compliance/schlechte Mundhygiene und Rauchen. Auch schlecht eingestellter Diabetes mellitus und Alkoholkonsum zeigen nach derzeitiger Studienlage einen Zusammenhang mit der Entstehung periimplantärer Infektionen.9,10 Lokale Faktoren umfassen das Vorhandensein von Zementresten, insuffzienten prothetischen Versorgungen, die Implantat-Abutment-Verbindung, fehlpositionierten Implantaten und die Breite der umgebenden keratinisierten Gingiva.9–11 In Diskussion stehen mögliche Zusammenhänge periimplantärer Entzündungen mit genetischen Risikofaktoren (Interleukin-1-Polymorphismus), Medikamenteninteraktionen (z. B. Bisphosphonaten) und Implantatoberfläche.9,10,12
Diagnostik
Periimplantäre Infektionen weisen in vielen Fällen keine oder kaum Schmerzsymptomatik auf, weshalb bereits im Verdachtsfall eine exakte klinische Diagnostik durchgeführt werden sollte. Entscheidend sind das Erheben von Sondierungstiefen und die Beurteilung von Blutung auf Sondieren (BOP, Bleeding on Probing) oder Suppuration um das Implantat. Mukositis und Periimplantitis zeichnen sich durch positives BOP aus, wobei die Periimplantitis von Suppuration begleitet sein kann.4,13 Beim Sondieren sollte darauf geachtet werden, nur leichten Druck (0,25 N) anzuwenden, um keine umgebenden Gewebe zu verletzen.14 Die Abnahme der Suprakonstruktion kann die Genauigkeit und Reproduzierbarkeit des Sondierungsvorgangs erheblich verbessern.15 Die Messung der Sondierungstiefen sollte idealerweise mit dem Referenzwert zum Zeitpunkt der Eingliederung der prothetischen Arbeit verglichen werden.16 Als weiterführende Diagnostik und zur Identifikation einer Periimplantitis ist die radiologische Diagnostik durch ein Kleinbild oder ggf. Orthopantomogramm erforderlich, um die Progredienz des periimplantären Knochenabbaus festzustellen. Idealerweise empfiehlt sich ein Referenzröntgen mit derselben Aufnahmetechnik wie bei der Eingliederung.16 Dreidimensionale bildgebende Verfahren, insbesondere die digitale Volumentomografie, geben Aufschluss über die periimplantäre Defektkonfiguration und können in Einzelfällen Grundlage für die weitere Behandlungsplanung und Therapieentscheidung sein.17
Die Untersuchung periimplantärer Sulkusflüssigkeit kann als ergänzende diagnostische Maßnahme bei periimplantären Entzündungen angesehen werden. Derzeit verfügbare Bakteriennachweise erfassen hauptsächlich das Spektrum klassischer Parodontalpathogene. Der diagnostische und therapeutische Mehrwert ist durch das heterogene Bakterienprofil bei periimplantären Läsionen fraglich.18 Periimplantäre Sulkusflüssikeit kann zur Analyse immunologischer Parameter Interleukin-1ß oder Tumornekrosefaktor-ß verwendet werden, die das Vorliegen einer Entzündung nachweisen. Jedoch kann eine periimplantäre Mukositis nicht von einer Periimplantitis unterschieden werden.19 Es gibt Hinweise, dass die Kombination erhöhter Werte spezieller inflammatorischer Biomarker (IL-1ß, VEGF und TIMP-2) und spezifische Bakterienprofile (T. denticola) mit Periimplantitis assoziiert sein könnten.20 Der konkrete Nutzen für Diagnostik und Therapie ist aus heutiger Sicht jedoch fraglich.
Therapie periimplantärer Entzündungen
Behandlung der Mukositis
Periimplantäre Mukositis ist ähnlich der Gingivitis eine reversible Entzündung und kann mit hoher Erfolgsaussicht therapiert werden, auch wenn nicht in allen Fällen eine Heilung gelingt.21 In Pathogenese und Diagnose sind Mukositis und Gingivitis vergleichbar und eine nichtchirurgische Intervention ist in den meisten Fällen ausreichend. Die Kombination von regelmäßiger mechanischer Plaqueentfernung und Optimierung häuslicher Mundhygiene ist von entscheidender Bedeutung für den Therapieerfolg.22,23 Verschiedene Methoden werden zur Oberflächendekontamination bei der Therapie angewendet. Das manuelle Debridement mit Handinstrumenten (Carbonfaser- und titanüberzogene Küretten) oder Ultraschallscalern verbessert Blutungsindex und Sondierungstiefen, wobei adjuvantes Air-Polishing mit Glycinpulver einen zusätzlichen therapeutischen Nutzen brachte.24 Air-Polishing als Monotherapie bewirkte bei mehrfacher Anwendung eine vergleichbare Minderung von BOP und Reduzierung erkrankter Implantate wie nach der Therapie mittels Ultraschallscaler.25 Adjuvante Maßnahmen, wie lokale antiseptische und antibiotische Therapien (lokal/systemisch), die zusätzlich bei der Behandlung durchgeführt wurden, verbesserten den klinischen Erfolg im Vergleich zum manuellen Debridement allein nicht signifikant.26 Die Anwendung von Chlorhexidindigluconat (CHX) in Form von Taschenspülung und topischer Applikation führte nach drei Monaten zu einer signifikant besseren Reduktion der Sondierungstiefen, ergab aber keine Unterschiede beim Blutungsindex und bei der Bakterienzahl.27 Das Konzept der „Full Mouth Disinfection” hatte keinen signifikant besseren Behandlungserfolg als die Kontrollgruppe.28 Schwarz et al. zeigten, dass auch bei Mukositis an Zirkondioxid-Implantaten mechanisches Debridement in Kombination mit adjuvanter lokaler Nutzung von CHX klinisch erfolgreich angewendet wurde.29 Als weiteres Antiseptikum wurde die lokale Applikation von Phosphorsäure untersucht, die Blutungsindex sowie Bakterienwachstum im Vergleich zur alleinigen Verwendung von Carbonküretten signifikant reduzierte.29 Keine klinische Evidenz gibt es für den Einsatz systemischer Antibiotika. Die systemische Gabe von Azithromycin® führte zu keiner Verbesserung der klinischen oder mikrobiologischen Parameter im Vergleich zum alleinigen mechanischen Debridement.30
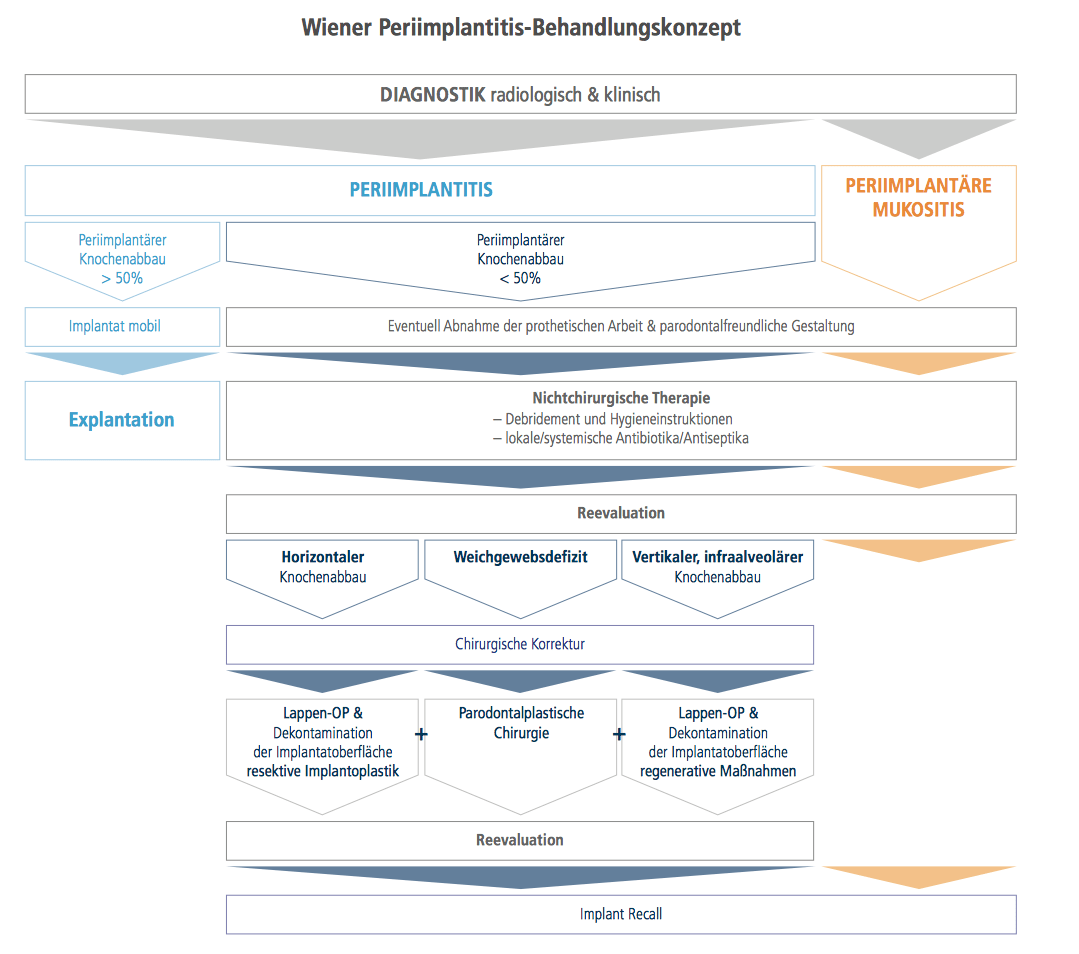
Abb. 1: Das Wiener Behandlungskonzept von Periimplantitis. Grafik: © Wien 2016 – DDr. Gerlinde Durstberger, Dr. Michael MüllerKern, Dr. Christoph Arnhart
Behandlung der Periimplantitis
Nichtchirurgische Therapie
Das Ziel ist es, klinische Zeichen der Entzündung zu reduzieren und bestenfalls zu eliminieren, d. h. BOP und Suppuration möglichst aufzulösen und Sondierungstiefen zu reduzieren. Es gibt verschiedene Methoden zur nichtchirurgischen Oberflächendekontamination, wobei der klinische Erfolg begrenzt und wenig voraussagbar ist.4 Einen hohen Evidenzgrad zeigen die Monotherapie mittels Er:YAG-Laser und Air-Polishing auf Glycinbasis, der adjuvante Einsatz lokaler Antibiotika (Doxycyclin), CHX-Chip und die antimikrobielle Photodynamische Therapie.31 Mechanisches Debridement mit Carbon- oder Plastikküretten, Schall- und Ultraschallsystemen zeigten nach drei und sechs Monaten eine vergleichbare Verminderung der mukosalen Blutung und Sondierungstiefen, auch ohne Reduktion der Keimbelastung.32 Die Monotherapie mit Er:YAG-Laser reduzierte BOP signifikant besser als Debridement mit Handinstrumenten und zusätzlicher CHX-Spülung/Applikation nach sechs Monaten.33 Er:YAG-Laser- und Air-Polishing-Monotherapie zeigten bei fortgeschrittenen Periimplantitisläsionen vergleichbare klinische Resultate.
Allerdings kam es langfristig bei keiner der beiden Methoden zur Reduktion der bakteriellen Keimbelastung oder kompletten Heilung der Erkrankung.34 Die Verwendung lokaler Antiseptika in Form eines CHX-haltigen Chips als adjuvante Therapie zeigte im Vergleich zu alleinigem Ultraschallscaling bei mehrfacher Anwendung eine signifikant höhere Reduktion der Sondierungstiefen.35 Die lokale Antibiose in Form von Minocyclin oder Doxycyclin reduzierte BOP und Sondierungstiefen im Vergleich zur Kontrollgruppe.36,37 Als weitere adjuvante Maßnahme hinsichtlich der Bedeutung für die Prophylaxe und Behandlung ist die antimikrobielle Photodynamische Therapie, die durch photochemische Dekontamination der Implantatoberfläche die Bakterienzahl signifikant reduzierte.38 Die adjuvante lokale Applikation von Minocyclin-Mikrosphären zeigte eine vergleichbare Reduktion der klinischen Parameter wie die adjuvante, antimikrobielle Photodynamische Therapie.
Chirurgische Therapie
Die Ziele umfassen die Reduktion der klinischen Infektionszeichen (BOP, Suppuration), die Verminderung der Sondierungstiefen sowie Stabilisierung des krestalen Knochenniveaus.40 Verschiedene chirurgische Therapiemaßnahmen werden je nach Konfiguration des periimplantären Knochendefekts angewendet. Sie umfassen die alleinige Lappenoperation (Open Flap Debridement – OFD), Lappenoperation mit resektiven Maßnahmen (Exzision von Weichgewebe, Adaptation der Knochenkontur, Glättung von Implantatoberflächen), Lappenoperation mit augmentativen Maßnahmen sowie Lappenoperation mit einer Kombination aus resektiven und augmentativen Maßnahmen.32 Ein Schlüsselfaktor für den Therapieerfolg ist die effektive Dekontamination der freiliegenden Implantatoberflächen. Dabei zeigten Diodenlaser, CO2-Laser, Chlorhexidindigluconat und Cetylpyridiniumchlorid vergleichbare klinische und radiologische Resultate wie die jeweilige Kontrollgruppe (Air-Polishing, CHX-/Placebolösungen).41–43 Resektive Chirurgie mit Implantoplastik zeigte nach drei Jahren eine signifikante Reduktion von BOP und ST-Werten sowie Stabilisierung des periimplantären Knochenniveaus.44,45 Die Durchführung resektiver Maßnahmen ist jedoch vor allem im ästhetischen Bereich limitiert. Werden augmentative Verfahren zur Defektauffüllung der intraossären Läsion angewendet, zeigen xenogene Knochenersatzmaterialien boviner Herkunft in Kombination mit einer Barrieremembran bessere klinische Resultate als autogene Materialien oder alloplastische Augmentate ohne Barrieremembran.46,47 Die Kombination von resektiven und augmentativen Methoden kann bei komplexer und fortgeschrittener Defektkonfiguration sinnvoll sein.48
Fazit
Mit zunehmender Anzahl dentaler Implantate steigt die Inzidenz periimplantärer Entzündungen, welche bei entsprechender Progredienz bis zum Implantatverlust führen können. Die Diagnostik bei periimplantärer Mukositis und Periimplantitis umfasst die Erhebung von Sondierungstiefen sowie BOP und Suppuration, wobei auch die Anfertigung von Röntgenbildern erforderlich ist. Während periimplantäre Mukositis in den meisten Fällen erfolgreich behandelt werden kann, sind nichtchirurgische Therapieansätze bei Periimplantitis oftmals wenig voraussagbar und in vielen Fällen ist eine anschließende chirurgische Intervention notwendig. Patienten mit Implantaten sollten in einen regelmäßigen Recall im Sinne einer lebenslangen unterstützenden Erhaltungstherapie eingebunden werden. Das ist der Schlüsselfaktor, um periimplantären Erkrankungen vorzubeugen, sie frühzeitig zu erkennen und zu therapieren.
Eine ausführliche Literaturliste steht hier zum Download bereit.
Der Beitrag ist im Prophylaxe Journal erschienen.