Parodontologie 14.04.2014
Innovative Verfahren in der konservativen Parodontitistherapie
share
Parodontale Erkrankungen stellen infektiöse Erkrankungen, bewiesen durch die bahnbrechenden Untersuchungen von Loe et al. (1986) und Page (1999), des Zahnhalteapparats dar, die durch eine Destruktion des Parodonts, inklusive des parodontalen Faserapparates, des Zements, des Alveolarknochens und der Gingiva gekennzeichnet sind (Abb.1). Die marginale Parodontitis ist eine opportunistische Infektion, die durch ein über wiegend gramnegatives, anaerobes Keimspektrum hervor gerufen wird. Dieses verursacht eine chronische Entzündung des Zahnhalteapparates (Kornman 2010).
Als Folge der persistierenden Entzündung ist der fortschreitende Verlust von parodontalem Gewebe und Attachment zu beobachten. Die marginale Parodontitis ist in Übereinstimmung mit internationalen epidemiologischen Unterschungen der Hauptgrund für den Zahnverlust nach dem 35. Lebensjahr. Ausgehend von epidemiologischen Studien (Abb. 2) liegt die Prävalenz der chronischen marginalen Parodontitis der erwachsenen Bevölkerung über 35 Jahren in Deutschland bei ca. 40 bis 45 Prozent, wobei ca. 53 Prozent dieser Altersgruppe an einer mittelschweren und ca. 21 Prozent an einer schweren Form der Parodontitis leiden. Aber auch bei 15-jährigen Jugendlichen konnten bereits mittelschwere (ca. 13 Prozent) sowie schwere (ca. 1 Prozent) Formen der marginalen Parodontitis beobachtet werden. Bei älteren Menschen (Senioren) weist fast jeder zweite entzündlich-destruktive Veränderungen (mittelschwer/schwer) des Zahnhalteapparates auf (DMS, 2006). Diese Untersuchungsergebnisse werden von epidemiologischen Erhebungen der American Academy of Periodontology bestätigt, die ca. 57 Prozent aller Zahnverluste der marginalen Parodontitis im Verhältnis zu anderen Ursachen zuweisen (AAP, 2005). Die jährlichen Behandlungskosten beziffern sich in Deutschland auf ca. 500 Millionen Euro (Pretzl et al. 2009). Diese Zahlen beinhalten keine Therapiekosten für mit marginaler Parodontitis mittel bar und unmittelbar assoziierte Krankheitsbilder wie Diabetes, Erkrankungen des kardiovaskulären Systems sowie des Respirationstrakts. Daraus lässt sich ableiten, dass die chronisch marginale Parodontitis gesundheitspolitisch einen hohen Kostenfaktor für Krankenkassen und andere Versicherungsträger darstellt. Innerhalb dieser Therapiekosten nimmt die antiinfektiöse konservative Parodontaltherapie den höchsten Anteil zur Behandlung der chronischen marginalen Parodontitis in Anspruch. Durch eine kausale Therapie (Abb. 3) kann eine Progression der Erkrankung verhindert werden (Grimm 2000, Sastravaha et al. 2004). Daher ist die mechanische supra- und subgingivale Zahnstein- und Plaqueentfernung das primäre Ziel der initialen Parodontaltherapie, die auf eine Zerstörung des subgingivalen Biofilms sowie eine Minimierung der parodontopathogenen Keime abzielt. Durch Scaling und Wurzelglättung können Konkremente, bakterielle Biofilme und Endotoxine effektiv von den Wurzeloberflächen entfernt werden. Instrumentierungsarten sind Hand- sowie Schall- beziehungsweise Ultraschallscaling (Drisko 1998, Oda et al. 2004, Sastravaha et al. 2005, Caruso et al. 2008). Es gibt aber auch immer wieder Hinweise in der Literatur (Zappa et al. 1991, Schmidlin et al. 2001), die eine Zerstörung der Wurzeloberflächen durch den Einsatz der maschinellen Scalingsysteme dokumentiert.
Klinische Studien zur Parodontitisbehandlung
Bereits zu Beginn des 20. Jahrhunderts wurden Instrumente entwickelt, die den heute gebräuchlichen Handinstrumenten sehr ähnlich sind (Hohlfeld und Wachtel 1990). Sie gelten heute noch als Mittel der Wahl bei der Bearbeitung von Wurzeloberflächen (Stassinakis et al. 1995, Kocher, 1994). Dabei unterscheidet man zwischen Scaling und Root Planing. Scaling wird definiert als das Entfernen der supragingivalen, weichen und harten bakteriellen Beläge und aller subgingivaler Konkremente. Unter Root Planing versteht man das Entfernen des zytotoxisch kontaminierten Zements bzw. Dentins sowie eine Glättung der Wurzeloberfläche (Zappa et al. 1991, Kocher 1990). Lange Zeit wurde außer der Taschenreinigung auch eine glatte Oberfläche der Zahnwurzel gefordert. Durch die bestmögliche Wurzelglättung sollte der Therapieerfolg sichergestellt werden. Es wurde angenommen, dass in Grübchen und Kerben der Wurzeloberfläche auch bakterielle Endotoxine zurückbleiben können. Durch die konsequente Glättung sollte die mikrobielle Rekolonisation verzögert oder sogar vollständig verhindert werden (Kocher 1990, 1995, Mengel et al. 1996).
Da die Reinigung der Wurzeloberflächen mit Küretten oft mühsam und zeitraubend ist, wurde in den vergangenen Jahren immer wieder nach Möglichkeiten gesucht, die klassischen Handinstrumente durch maschinell getriebene Geräte zu ersetzen (Yukna et al. 1997). Zur Reduzierung des Zeitund Kraftaufwandes und zur Vereinfachung der Reinigung der Wurzeloberfläche wurden verschiedene maschinengetriebene Zahnwurzelreinigungsinstrumente entwickelt, darunter auch schall- bzw. ultraschallgestützte Systeme. Eine Weiterentwicklung dieses Schallprinzips stellt das von Satelec neu entwickelte AIR-N-GO®-Gerät dar. Pulverstrahlgeräte sind bereits seit Jahren im Rahmen der supragingivalen Anwendung insbesondere bei der professionellen Zahnreinigung erfolgreich im Einsatz (für einen Literaturüberblick siehe Petersilka 2011). Die Indikationserweiterung auf subgingivale mit Biofilm belastete Oberflächen war bisher mit erheblichen Nachteilen assoziiert, da geeignete Instrumentenansätze nicht verfügbar waren und als Strahlgut ausschließlich Natriumbikarbonat-Pulver benutzt werden konnte. Hieraus resultierte eine unzureichende Reinigungsmöglichkeit der Wurzeloberflächen, und darüber hinaus bestand die Gefahr einer subgingivalen Emphysembildung. Diese Probleme sind mit der Entwicklung des AIR-N-GO®-Gerätes mittlerweile gelöst. Das unlösliche Natriumbikarbonat-Pulver wurde durch lösliches, we niger abrasiv wirkendes Glycin-Pulver ersetzt. Die Reinigungs- bzw. Dekontaminationswirkung an Wurzeloberflächen dieser (ca. 25–70 μm großen) aus der Aminosäure Glycin bestehenden Kristalle ist signifikant besser im Vergleich zu konventionellen Handinstrumenten und Ultraschallscalern. In einer Serie von Untersuchungen haben Petersilka et al. (2003a, b, c, d) demonstriert, dass Air Polishing mit niedrigabrasiven Glycin-Pulver den subgingivalen Biofilm effektiv von der Wurzeloberfläche entfernt. Darüber hinaus konnte in klinischen Untersuchungen(Referenz-Literatur auf www.airngoconcept.com) gezeigt werden, dass das Glycin-Pulver im Rahmen des Strahlverfahrens keine negativen Effekte auf das um gebende Weichgewebe ausübte. Im Vergleich hierzu bewirkten konventionelle Handinstrumente eine erheblich höhere Traumatisierung der angrenzenden Weichgewebe. Das Air-Polishing-Gerät AIR-N-GO der Firma Satelec® (Acteon Group) zur supragingivalen Plaqueentfernung (Abb. 5) sowie zur minimalab rasiven subgingivalen Konkrement- und Biofilmentfernung bietet damit eine völlig neue Form der konservativen Parodontitistherapie. Das speziell für das subgingivale Arbeiten entwickelte AIR-N-GO PERIO®-Gerät (Abb. 6a bis c) mit seinem subgingivalen Ansatz und seiner neuartigen Strömungskammer ist das Ergebnis modernster CFD-Technik (numerische Strömungstechnik). Die angrenzenden anatomischen Strukturen werden nicht gereizt und eine gründliche Entfernung des subgingivalen Biofilms auf der Wurzeloberfläche reduziert die marginalen Entzündungen und beugt Knochenverlust vor. Dabei wird das langzeitgetestete subgingival anwendbare AIR-N-GO PERIO®-Pulver auf der Basis von natür lichem Glycin verwendet.
Dieser Airpolisher mit Doppelfunktion, speziell entwickelt für die Behandlung von Zähnen und Implantaten, für supra- und subgingivales Arbeiten, gewährleistet eine gewebeschonende, schmerzarme und zahnerhaltende Politur. Die Supra-Funktion sorgt für eine optimale Oberflächenbearbeitung mit einem ästhetisch einwandfreien Ergebnis. Die Perio-Funktion ermöglicht kontrolliertes, subgingivales Arbeiten. Die sanfte Entfernung des Biofilms unterstützt wirkungsvoll die Behandlung von Parodontalerkrankungen und Periimplantitis. Die klinisch abgestimmte Düsenpalette für die Supra- und Perio-Funktionen mit 90° oder 120°, mit einem optimierten Griffdesign und ausgewogene Gewichtsbalance, sorgen für entspanntes, ermüdungsfreies Arbeiten. Mit dem einfach und leicht zu bedienenden Handstück werden auch schwer zugängliche Bereiche erreicht. Die Pulverbehälter ermöglichen kontinuierliches Arbeiten und verkürzen den Zeitaufwand für die Entfernung von Verfärbungen und Plaque. Bisher wurde mit diesen Instrumentenansätzen noch keine Emphysembildung beobachtet. Tatsächlich ermöglicht diese Therapiemethode eine drei- bis fünfmal kürzere Behandlungsdauer mit signifikant weniger Schmerzen für den Patienten verglichen mit konventionellen Handinstrumenten. Unsere Arbeitsgruppe hat darüber hinaus eine klinisch-kontrollierte und mikrobiologische Studie zum vergleichenden Einsatz des AIR-N-GO PERIO®-Gerätes und des Newtron-Systems zur Behandlung von Periimplantitiden abgeschlossen (Grimm und Sternemann 2012, Grimm et al. 2014).
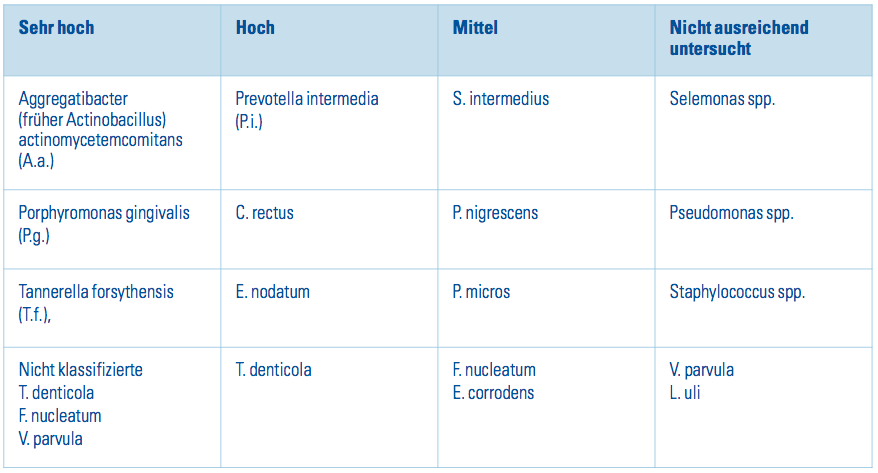
Tab. 1: Assoziation oraler Bakterien mit Parodontitiden (modifiziert nach Paster et al. 2001, Kumar et al. 2003).
Zielstellung
Es sind eine Reihe von publizierten Untersuchungen verfügbar, die die klinischen Ergebnisse einer nicht chirurgischen Parodontitistherapie von verschiedenen Schall-Systemen vergleichen und unterschiedliche klinische und mikrobiologische Effektivitätsergebnisse vor legen (Wennström et al. 2011, Grimm 2012 a, b, c, d, e, Grimm et al. 2012, 2014). Die vorliegende Untersuchung wurde als prospektive, randomisierte und mikrobiologisch kontrollierte Studie mit zwei Vergleichsgruppen angelegt. Als Bewertungskriterien wurden der Attachmentgewinn nach sechs Wochen und drei Monaten, die Veränderung der Sondierungstiefen und die Veränderung der subgingivalen Biofilmzusammensetzung ausgewählt. Die Zielstellung dieser Studie bestand darin, die klinischen und mikrobiologischen Ergebnisse während der konservativen Parodontitistherapie mit einem minimalabrasiven subgingivalen Pulverstrahlsystem (AIR-N-GO PERIO®) mit einem US-System (NEWTRON®-Technologie) zu vergleichen. Es wurden 30 Patienten, die im Ausgangsbefund eine chronische marginale Parodontitis aufwiesen, behandelt und über einen Zeitraum von drei Monaten nachuntersucht. Vor Beginn, unmittelbar nach der klinischen Intervention (nur mikrobiologischen Untersuchungen), nach sechs Wochen und drei Monaten wurden die klinischen und mikrobiologischen Parameter erhoben (Tab. 2). Für den mikrobiologischen Teil der Studie wurden mit Papierspitzen in der jeweils definierten parodontalen Tasche Bakterienproben entnommen und mittels einer molekularbiologischen Methode verglichen (Abb. 7a und b).
Materialien und Methoden
Patienten
In die Studie wurden 30 Patienten, die die Einschlusskriterien nach der Vorbehandlung erfüllten, einbezogen. Die Deklaration von Helsinki (nach der Novellierung der 41st World Medical Assembly, Hongkong, September 1989) bildet die Grundlage für die ethischen Erwägungen dieser klinischen Studie. Das Votum der Ethik-Kommission der Ärztekammer Münster wurde eingeholt. Alle Teilnehmer erteilten nach erfolgreich durchgeführter Vorbehandlung und mündlicher sowie schriftlicher Aufklärung eine Einverständniserklärung. Die teilnehmenden Patienten erfüllten die festgelegten Einschlusskriterien, die eine chronische Parodontitis umfassten. Je Quadrant musste nach der Vorbehandlung noch mindestens ein Zahn mit Sondierungstiefen größer oder gleich vier Millimeter vorhanden sein. Die letzte Parodontitisbehandlung musste mindestens zwölf Monate zurückliegen. Es durften keine Schwangerschaft bzw. systemischen Erkrankungen (wie HIV-Infektionen oder Diabetes mellitus), die das Ergebnis einer Parodontitistherapie hätten beeinflussen können, vorliegen. Darüber hinaus erfüllten Patienten, die das Parodont und den Verlauf der Parodontitis beeinflussende Medikamente einnehmen mussten oder in den sechs Monaten vor Studieneinschluss systemische Antibiotika eingenommen hatten, nicht die Einschlusskriterien. Alle Patienten mussten eine gute Mundhygiene aufweisen.
Vorbehandlung
Alle Patienten wurden nach der Eingangsuntersuchung in eine Vorbehandlung eingebunden. Die Patienten erhielten Mundhygieneinstruktionen und entsprechend ihrem Bedarf ein professionelles supragingivales Débridement. Die erste Phase der Vorbehandlung erstreckte sich je nach Patient über einen Zeitraum von mindestens drei und maximal fünf Wochen (drei bis fünf Termine). Die Patienten sollten in dieser Zeit einen PI von etwa 1 aufweisen. Die Vorbehandlung umfasste für beide Untersuchungsgruppen ein supragingivales Scaling und Polishing der Zahnoberflächen mit dem AIR-N-GO SUPRA®. Der Airpolisher AIR-N-GO SUPRA® (Abb. 6a bis c) arbeitet mit einem Strahl aus einem Wasser-Luft-Gemisch, dem ein speziell für den Erhalt von empfindlichem Gewebe entwickeltes Reinigungspulver zugesetzt ist. Die abgerundete Struktur des Pulvers und der hohe Feinheitsgrad der Mikrokügelchen (auf Basis von Kalziumkarbonat) schützen den Zahnschmelz und ermöglichen eine schonende und wirkungsvolle Reinigung der Zahnoberflächen. Der Spraystrahl erreicht auch schwierige Stellen, wie enge Zahnzwischenräume.
Studiendesign
Es erfolgte nach dem Abschluss der Vorbehandlung eine randomisierte Zuweisung der diagnostizierten Parodontitisfälle in zwei Therapiegruppen, Therapie 1 AIR-N-GO PERIO® als Untersuchungsgruppe 1 bzw. Satelec piezoelectric ultrasonic Kit mit sechs Paro-Spitzen (H1, H2L, H2R, H3, H4L und H4R) unter Nutzung des NEWTRON®-Geräteteiles im Piezotome® II als Untersuchungsgruppe 2. Die im Folgenden verwendete Kurzbezeichnung der beiden Untersuchungsgruppen lautet:
- Untersuchungs-/Therapiegruppe I AIR-N-GO PERIO®
- Untersuchungs-/Therapiegruppe II NEWTRON®
Alle Untersuchungen wurden gemäß Untersuchungsprotokoll durchgeführt (Tab. 2). Die Untersuchungen wurden wie folgt festgelegt: „Prä“ ist der Zeitpunkt der Voruntersuchung und der Vorbehandlung. Hier wurden die geeigneten Patienten ausgewählt. Der zeitliche Abstand zwischen Vor- und „Baseline“-Untersuchung hat mindestens zwei bis maximal sechs Wochen betragen. Baseline (BL) ist der Zeitpunkt 0 der Studie. Hier wurde die Therapie durchgeführt. Unmittelbar nach der Intervention (naI), sechs Wochen (na6Wo) und drei Monate (na3Mo) nach Baseline fanden die Nachuntersuchungen statt. Im Folgenden werden diese Abkürzungen der einzelnen Untersuchungszeiträume benutzt. Die Tabelle 2 zeigt eine zeitliche Übersicht der durchgeführten Maßnahmen. Die Untersuchungsgruppen im Einzelnen werden im Anschluss beschrieben. Die Untersuchungsgruppe I – AIR-N-GO PERIO® (n = 15) erhielt ein einmaliges subgingivales Débridement an allen Zähnen. Die Wurzeloberflächen wurden mit dem AIR-N-GO PERIO®-Gerät instrumentiert. Die Untersuchungsgruppe II – NEWTRON® (n = 15) erhielt ein einmaliges subgingivales Débridement an allen Zähnen. Die Wurzeloberflächen wurden mit den Satelec piezoelectric ultrasonic Kit mit sechs Paro-Spitzen (H1, H2L, H2R, H3, H4L und H4R) unter Nutzung des NEWTRON®-Geräteteils des Piezotome® II instrumentiert.
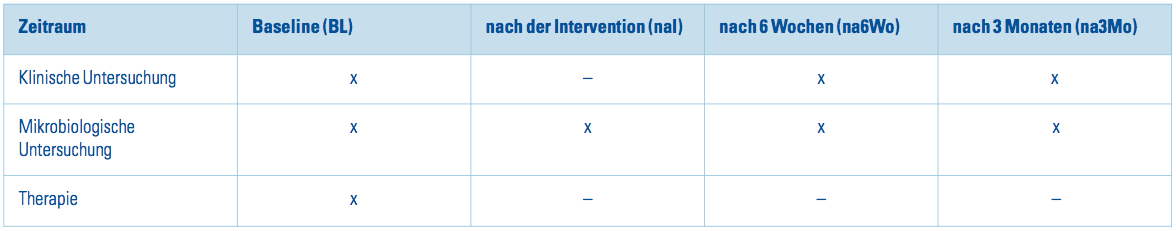
Tab. 2: Zeitliche Übersicht.
Behandlungsablauf
Sämtliche Behandlungen wurden unter Lokalanästhesie durchgeführt. Nach der erfolgreich abgeschlossenen Vorbehandlung erfolgt die Eingangsuntersuchung (Baseline). Sechs Wochen und drei Monate nach der letzten Behandlung wurden die Nachuntersuchungsbefunde erhoben. Neben dem aktuellen Zahnstatus (Fehlen oder Vorhandensein der Zähne) wurden an jedem Zahn die Sondierungstiefe (ST) vom Gingivarand bis zum sondierbaren Taschenfundus, die Gingivarezession (GR) von der Schmelz-Zement-Grenze bis zum Gingivarand und der klinische Attachmentlevel (CAL) von der Schmelz-Zement-Grenze bis zum sondierbaren Taschenfundus erhoben. Die Messungen von ST, CAL und GR wurden an vier Stellen pro Zahn vorgenommen (mesio-vestibulär, vestibulär, disto-vestibulär, oral). Die klinische Parametererfassung erfolgte mit einem Parodontometer der Firma Hu-Friedy™ (CP 15 UNC) auf den Millimeter genau, halbe Millimeter wurden gerundet.
Mikrobiologie
Die bakteriologischen Untersuchungen (Grimm et al. 1990 und 2005) erfolgten vor der Basisuntersuchung, unmittelbar nach der therapeutischen Intervention, sechs Wochen und drei Monate nach konservativer Parodontaltherapie in den beiden Untersuchungsgruppen durch die selektive Detektion der parodontopathogenen Markerbakterien mittels Bindung von Gensonden (Hybridisierung). Die subgingivale Probeentnahme (Abb. 7a und b) erfolgte mit sterilen Papierspitzen nach Slots (1986). Vorab wurde aus jedem Quadranten des Gebisses das Parodontium mit der tiefsten Tasche (5–6 mm oder tiefer) nach vorausgehender Trockenlegung ausgewählt. Die Proben wurden immer vor Untersuchung der klinischen Parameter genommen. Der betreffende Zahn wurde mit dem Luftbläser getrocknet und eine Watterolle ins Vestibulum gelegt, um eine Kontamination durch Speichel zu verhindern. Die Papierspitze wurde bis zum Taschenfundus eingeführt, dort für zehn Sekunden belassen, danach ohne eine Blutung auszulösen entfernt und sofort in das für den Test vorgesehene Proberöhrchen gegeben. Die Auswertung erfolgte gepoolt für den untersuchten Patienten. Das Proberöhrchen enthält einen Puffer, der die Aminosäuren der Bakterien für die Transportzeit konserviert. Molekularbiologische Tests wie der in unseren Untersuchungen verwendete IAI PadoTest 4·5® des Institutes für Angewandte Immunologie (IAI, Schweiz) benutzen als Sonden synthetische kleine DNAs komplementär zu den ribosomalen RNAs, um Bakterien wie A. actinomycetemcomitans (Aa), T. forsythensis (Tf), P. gingivalis (Pg), T. denticola (Td) zu analysieren. Das Institut für Angewandte Immunologie (IAI, Schweiz) gibt eine Sensitivität des IAI PadoTest 4·5® mit 104 Bakterien an. So stellt diese Anzahl die untere Nachweisgrenze dieses Tests dar, unter welcher ein Nachweis von Bakterien-DNS nicht möglich ist. Deswegen bedeutet ein negatives Testergebnis nicht unbedingt ein Fehlen dieser Bakterien. Weiterhin ist die Gesamtkeimzahl (Total Bacterial Load, TBL) ein guter Indikator für die parodontale Infektion. Ribosomale RNA-Gene (Sonden) werden zur Taxonomie und Identifikation von Bakterien eingesetzt.
Statistische Auswertung
Den Endpunkt dieser Auswertung bildete der Vergleich von zwei Therapiemodifikationen der konservativen Parodontitistherapie bezogen auf die Sondierungstiefen der mikrobiologisch untersuchten Analysezähne sowie bezogen auf alle untersuchten Parodontien in den beiden Therapiegruppen. Für die Tests der Parameter wurde das Signifikanzniveau bei = 0,05 festgelegt. Folgende Aufgabenstellungen bildeten die Grundlagen der statistischen Auswertung, durchgeführt mit IBM® SPSS® Statistics 19, IBM Corporation, USA.
Mikrobiologische Endpunkte
Die Auswertung erfolgte wie für die klinischen Parameter (s.d.), es wurden zusätzlich zwei weitere Auswertungen durchgeführt (mit * markiert):
- Auswertung zur Baseline-Messung (t1)
- Auswertung zur Messung unmittelbar nach Intervention (t2)*
- Auswertung zur Messung sechs Wochen nach Intervention (t3)
- Auswertung zur Messung drei Monate nach Intervention (t4)
- Differenzvergleich der Messung unmittelbar nach Intervention zur Baseline-Messung (t2–t1)*
- Differenzvergleich der Messung sechs Wochen nach Intervention zur Baseline-Messung (t3–t1)
- Differenzvergleich der Messung drei Monate nach Intervention zur Messung unmittelbar nach Intervention (t4–t1)
Klinische Endpunkte
Nach Abschluss der Untersuchungen wurden die erhobenen klinischen Parameter deskriptiv ausgewertet. Hierbei wurden die Mittelwerte der Variablen klinischer Attachmentlevel (CAL), Bleeding on Probing (BOP), Sondierungstiefe (ST) und Gingivarezession (GR) ermittelt. Es erfolgte eine deskriptive Statistik der stetigen Daten (metrische Erfassung) Attachmentlevel (CAL), Sondierungstiefe (ST) und Gingivarezession (GR) sowie des kategorialen Wert Bleeding on Probing (BOP) mittels der Kennwerte Median, Quartile, Minimum und Maximum unter Betrachtung von Boxplots. Als Signifikanztest für den Vergleich der stetigen Daten wurde eine analytische Statistik mittels Wilcoxon-Test (SPSS: Mann-Whitney-U-Test) durchgeführt. Für kategoriale Daten wurden Häufigkeitstabellen oder Kreuztabellen mit Häufigkeiten erzeugt (deskriptive Statistik). Bei den kategorialen Größen erfolgte die analytische Statistik mittels des exakten Fisher-Tests für zwei binäre Größen oder des Chi-Quadrat-Tests bei der Untersuchung von mehr als zwei Gruppen. Als sekundärer Endpunkt wurden die Differenzen der Analyseparameter über die Zeiträume der Studie t1 („Baseline“), t2 (mikrobiologische Erfassung unmittelbar nach der therapeutischen Intervention), t3 (nach sechs Wochen) und t4 (nach drei Monaten) gewählt.
Hier geht's zur Literaturliste.