Laserzahnmedizin 28.02.2011
Möglichkeiten und Grenzen der Laserbehandlung
share
Studie mit einem ER,Cr:YSGG-Laser
Laserzahnheilkunde hat sich zu einem eigenen Forschungszweig in der Zahnheilkunde entwickelt. Laser werden von vielen Zahnärzten in der täglichen Praxis als Ergänzung oder Unterstützung ihres Behandlungsspektrums eingesetzt. Neben den klinischen Möglichkeiten, die diese Technologie bietet, gibt es auch Grenzen, die neben dem Arbeits- und Patientenschutz auch bei der Einstellung eines Lasers zu berücksichtigen sind.
Rund 45 Jahre nach den ersten Versuchen, den Laser in der Zahnmedizin anzuwenden, gibt es unterschiedliche Lasertypen. In der Zahnheilkunde werden vor allem CO2-, Nd:YAG-, Er:YAG-, Dioden- oder Argon-Laser verwendet. Lasersysteme werden anhand ihres aktiven Mediums eingeteilt. Drei Hauptteile jedes Lasersystems sind: Energiequelle beziehungsweise Pumpquelle, eine Rückkopplungsanordnung (Spiegel beziehungsweise Gitter), die eine Strahlungs-Oszillation im Lasermedium erlaubt (Abb. 1) und ein aktives Medium (Lasermedium): Zur Erzeugung der Laserstrahlung werden Atome angeregt. Diese Atome sind Bestandteile des aktiven Mediums. Dies kann ein Gas, ein Festkörper, eine Flüssigkeit oder ein Halbleiter sein.
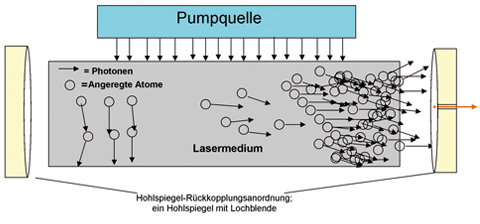
Abb. 1: Schematische Darstellung des Laserprozesses.
Jeder Laser ist durch spezielle Eigenschaften ausgezeichnet. Die Interaktion mit dem Gewebe wird durch den Energieeintrag ins Gewebe bestimmt. Bei Gewebsinteraktionen wird nach fotothermalen Effekten, fotochemischer Ablation, nichtlinearen Prozessen und fotomechanischer Ablation unterschieden.
Hauptanwendungsgebiete von Lasern definieren sich durch ihre biophysikalische Gewebsinteraktion. Die Effekte der Laserstrahlung in biologischen Geweben sind abhängig von einer Vielzahl verschiedener Faktoren. Diese Faktoren sind unter anderem Parameter des Lasers: Laserwellenlänge, Betriebsart (Continuous-Wave, getaktet oder gepulst), Leistungsabgabe, Pulsdauer, Repetitionsrate, Applikationsart und -dauer. Schließlich spielt der Absorptionskoeffizient im Gewebe sowie der Wärmeleitkoeffizient eine Rolle. Je höher die Absorption ist, desto geringer sind die Eindringtiefe und die thermischen Begleiterscheinungen, da die Energie durch Absorption des Gewebes aufgenommen und nicht in andere Energieformen umgewandelt werden kann. Bei geringer Gesamtleistung kann eine präzise chirurgische Schnittführung gewährleistet werden. Schwache Absorption (z.B. bei Metallen) führt zu tiefer Penetration und thermischen Schädigungszonen.
Er,Cr:YSGG-Laser
Eine Weiterentwicklung des Erbium-Lasers ist der Er,Cr:YSGG-Festkörperlaser (Biolase Technology, Inc., San Clemente, CA), der eine Wellenlänge von 2.780nm hat und in Verbindung mit Aerosol einen potenzierten Abtrag von Knochen und Zahnhartsubstanz ermöglicht. Die Kombination von Luft-Wasser-Laser-Energie führt zum explosionsartigen Verdampfen von Wassertröpfchen und zur Beschleunigung der nicht durch Absorption aufgelösten Luft-Wasser-Partikel durch Laserenergie auf 100m/s. Es werden Energiemengen freigesetzt, die schlagartig Wasser zu Wasserdampf werden lassen. Wassertröpfchen, die nicht die Laserenergie absorbiert haben, werden durch diese Mikroexplosionen beschleunigt und erzeugen dadurch den hydrophotonischen Schneideffekt, die sog. wasserinduzierte oder fotomechanische Ablation. Wegen der hohen Absorptionsrate im Wasser wird die eingebrachte Energie durch Wasseranteile in Körpergeweben komplett verbraucht. Es bleibt keine Restenergie, die in Wärme umgewandelt wird. Diese Eigenschaft kann in der Zahnheilkunde genutzt werden, um Zahnhartsubstanzen und Knochen nahezu schädigungsfrei abzutragen. Das Wasser hat einerseits beim Er,Cr:YSGG- Laser eine kühlende, andererseits einen synergetischen Effekt in Verbindung mit dem zentralen Laserstrahl und ist daher auch ein arbeitendes Medium.
Im Gegensatz zu Körpergeweben enthält Titan kein „Gewebewasser“, welches infolge der Aufheizung durch den Laserstrahl verdampfen könnte. Dies kann zu Oberflächenveränderungen auf Titan-Implantatoberflächen führen. Der Wirkungsgrad der Laserstrahlung ist bei Reintitan aufgrund des guten Absorptionsverhaltens und der geringen Wärmeleitfähigkeit im Vergleich zu anderen Legierungen höher. Die Aufschmelzungsbereiche weisen ein feinkörnigeres Gefüge als das Ausgangsmaterial auf. Für die Weichgewebeanwendung wird ein Behandlungsmodus verwendet, bei dem die Laserenergie direkt auf das Gewebe einwirkt. Hierbei wird entweder mit oder ohne Wasserzugabe zum Kühlen und zur Hydration gearbeitet.
Technische Daten
Er,Cr:YSGG (Erbium, Chromium, Yttrium, Scandium, Gallium, Garnet), Herstellerbezeichnung der Firma Biolase (San Clemente, USA): Millennium Waterlase
– Wellenlänge: 2.780 Nanometer
– Frequenz: 20 Hz
– Energie: 0–6 Watt (in 0,25 Schritten)
– Leistungsgenauigkeit: +/- 20 %
– Pulsenergie: 0–300 mJ
– Pulsdauer: 140–150 µs
– Übertragungskopfwinkel: 900°
– Spitzendurchmesser: 200–750 µm
– Strahlaufweitung: 80°
– Zielstrahl: Laserdiode, Laserklasse 1, 655 nm
– Laserschutzklasse: Klasse 4
– Tröpfchengröße: 5–200 µm
– maximale Tröpfchengeschwindigkeit: 100 m/s
Anwendungsgebiete
Für den Er,Cr:YSGG-Laser gibt es sehr unterschiedliche Einsatzgebiete: In der konservierenden Zahnheilkunde eignet er sich je nach Einstellung zur Abtragung von Zahnschmelz, kariösem und nichtkariösem Dentin. Retentive Muster können unterstützend zur Säure-Ätztechnik auf Zahnoberflächen erzeugt werden. Darüber hinaus können Kronenstümpfe vor der Zementierung desinfiziert bzw. desensibilisiert werden. Auch Zahnhälse lassen sich bei entsprechender Lasereinstellung desensibilisieren. Bei vielen Eingriffen kann dabei auf eine Anästhesie verzichtet werden. Gerade in der minimalinvasiven Präparationstechnik ist der Laser ein ausgezeichnetes Instrument, erreicht man mit ihm doch Zugänge zu Kleinstkavitäten, die mit einem mechanischen Instrument nur schwer zu präparieren sind. Während Kunststofffüllungen entfernt werden können, lassen sich Amalgam oder metallische Inlays nicht aus Zähnen heraustrennen.
In der Parodontologie lassen sich vor allem beim offenen Vorgehen Konkremente entfernen, Wurzeldentinoberflächen konditionieren bzw. desinfizieren und Gewebelappen deepithelialisieren. Auch Knochenränder können mit einer für Knochen geeigneten Einstellung konturiert werden. Der Laser zeichnet sich durch sein hydrokinetisches Wirkungsprinzip in seiner selektiven Arbeitsweise aus. Bei Hartgeweben werden Einstellungen gewählt, bei denen relativ viel Wasser und Luft hinzugemischt werden: Das Wasser absorbiert die Energie und der Laserstrahl und die beschleunigten Wassertröpfchen führen zum Abtrag. Bei Weichgeweben wird eher eine Einstellung gewählt, bei der wenig Luft und Wasser hinzu gegeben wird. Dies führt zu einer lokalen Gewebeerwärmung und zum Abtrag durch Thermolyse und Fotokoagulation. So kann z.B. der Knochendeckel beim externen Sinuslift sehr schonend präpariert werden, indem eine für Knochenabtrag geeignete Einstellung gewählt wird. Dieses Vorgehen schont die Schneider’sche Membran bei vorsichtigem Vorgehen.
Lippen- und Zungenbändchen und Fibrome lassen sich nahezu schmerzfrei ohne Anästhesie entfernen. Auch eine Gingivektomie ist schmerzarm durchzuführen und verursacht auf der Präparationsstelle kaum Nachblutung.
In der Implantologie werden Lasersysteme vor allem zur Freilegung nach gedeckter Einheilung als auch zur Oberflächenkonditionierung und -desinfektion bei der Periimplantitisbehandlung eingesetzt.
In-vitro-Studie
In eigener In-vitro-Untersuchung wurde das qualitative und quantitative Ausmaß an strukturellen und thermischen Schäden an Implantatoberflächen ermittelt und eine optimale Parametereinstellung für den Er,Cr:YSGG-Festkörperlaser bei der Periimplantitisbehandlung und der Freilegungsoperation gefunden.
Die strukturellen und thermischen Veränderungen wurden an Implantaten mit SLA-Oberfläche der Firma Straumann (CH-Waldenburg) untersucht. Zur Untersuchung von thermischen Auswirkungen des Lasers bei der Freilegung wurden diese in Schweinekieferhälften inseriert (Abb. 2).

Abb. 2: Versuchsaufbau: Präparat wird konstant auf Körpertemperatur gehalten. Abb. 3: Versuchsaufbau: digitale Temperaturmessung, Umschlingung des Implantatkopfes mit K-Typ-Thermoelement.
Die Freilegung des Kiefers erfolgte durch die Präparation eines vestibulär gestielten Mukoperiostlappens, der nach der Implantation und der Befestigung eines Thermoelementes am Implantathals unter Knochenkontakt (Abb. 3) reponiert wurde. Zur thermischen Regulierung auf Körpertemperatur wurden die Kieferpräparate in ein Wasserbecken mit einem Einhängethermostat eingebracht und mit einer Klemme fixiert. Das Wasser konnte über eine Heizung konstant auf Körpertemperatur gehalten werden. Als Referenzmessung wurde 60 Sekunden lang ein Implantat im Wasserbecken ohne Laserexposition gemessen.
Zur fotooptischen Darstellung der Einschmelzungen kam eine Canon EOS 350D (Japan, Utsunomiya) mit 8 Mio. Pixel und 90mm Makroobjektiv zum Einsatz. Eine 28-fache Vergrößerung der Einschmelzungen und Implantatstrukturen konnte auf dem Bildschirm durch die digitale Zoomfunktion erreicht werden.

Abb. 4: Versuchsaufbau: simulierte Periimplantitisbehandlung im zahntechnischen Stativ.
Die Abstände der Laserspitze bei der Periimplantitis-Behandlungssimulation wurden durch ein zahntechnisches Parallelometer (in z-Ebene) justiert und eingehalten (Abb.4). Das in Arbeitsabstand fixierte Laserhandstück wurde in Schwenkbewegungen (x-y-Ebene) im Parallelometer über die Implantatoberfläche entlang der Implantatlängsachse geführt. Die Durchmesser der Einschmelzungen und deren Randzonen wurden auf dem Bildschirm mit einer Schieblehre gemessen und per Dreisatz auf die tatsächliche Größe umgerechnet. Die konstanten Laserparameter waren: Expositionszeit 5s, Pulsenergie 100mJ, Pulsdauer 140µs, Frequenz 20Hz. Die variablen Parameter waren: Watt-Leistung, Spraymenge und Arbeitsabstand.
Da die Lasereinschüsse im Bereich der zentralen Einschmelzungen und Randzonen je nach Parametereinstellung qualitativ sehr unterschiedlich ausfielen (Abb. 5), wurden zur Auswertung und Beschreibung dieser Veränderungen Qualitätsmerkmale definiert und graduiert (siehe Tabelle).

Abb. 5a und 5b: Ausschnitte von circa 30-fach fotooptischen Vergrößerungen aus der Abstandsparameter-Auswertung. In der rechten Abbildung ist der verhältnismäßige Anteil der Randzonen zu den Zentraleinschüssen größer als in der linken Abbildung, da der Arbeitsabstand größer ist (Abb. 5a: 2 Watt, 10 % Luft, 10 % Wasser, 1,5 mm Arbeitsabstand; Abb. 5b: 2 Watt 10 % Luft 10 % Wasser, 2 mm Arbeitsabstand).
Qualitäts- und Quantitätsmerkmale wurden voneinander getrennt ausgewertet. Im Vorfeld war festzustellen, welche Strukturveränderungen wünschenswert bzw. klinisch noch gerade akzeptabel sind. Bei der Periimplantitisbehandlung sollte einerseits eine plaquearme Oberfläche erzielt werden, andererseits sollte die vom Hersteller vorgegebene Struktur nicht gänzlich verändert werden.
Bei der Betrachtung der zentralen Einschmelzungen fällt die bräunliche, teilweise bläuliche Farbe des Titans auf. Diese Veränderungen sind auf thermische Oxidations- und Verschmelzungsvorgänge zurückzuführen. Im Bereich dieser Einschüsse ist die eigentliche SLA-Struktur verschmolzen. Im Bereich der Randzonen sind diese farblichen Oxidationsvorgänge nicht zu erkennen. Es ist lichtoptisch ausschließlich eine Vertiefung des Grautons der SLA-Titanoberfläche auszumachen, die auf reduzierte Verschmelzungsvorgänge der SLA-Rautiefe zurückzuführen ist.
Zur Beurteilung des Wirkungsoptimums im Hinblick auf die Oberflächenschädigung wurden Qualitäts- und Quantitätskriterien für die ablativen Veränderungen festgelegt:
- Die Qualitätsstufe 3 (siehe Tabelle) sollte für die zentralen Einschmelzungen und Randzonen nicht überschritten werden.
- Der Anteil der prozentualen Fläche der Randzonen sollte möglichst groß sein.
- Der Anteil der prozentualen Fläche der zentralen Einschmelzungen sollte möglichst klein sein.
Durch die Herleitung der Fläche der kreisrunden Einschmelzungen und Randzonen aus den gemessenen Durchmessern konnte die Gesamtfläche der Schädigung berechnet und ins Verhältnis zur möglichen Expositionsfläche der Implantatoberfläche gesetzt werden. Hierdurch ergab sich eine prozentuale Verteilung zwischen exponierbarer Implantatoberfläche und tatsächlich geschädigter Oberfläche.
| Defekt-Variable |
Defektklasse | Defektausprägung |
| Schärfegrad Randzone | 0 | keine graue Randzone vorhanden |
| Schärfegrad Randzone | 1 | graue Randzone kaum erkennbar |
| Schärfegrad Randzone | 2 | flächig, keine Eingrenzung |
| Schärfegrad Randzone | 3 | flächig, keine Eingrenzung, Graufärbung reduziert |
| Schärfegrad Randzone | 4 | flächig, vereinzelte Eingrenzungen |
| Schärfegrad Randzone | 5 | flächig, vereinzelte Eingrenzungen, bräunliche Teilzonen |
| Schärfegrad Randzone | 6 | rund, unscharf umgrenzt |
| Schärfegrad Randzone | 7 | rund, scharf umgrenzt |
| Schärfegrad Einschmelzung | 0 | keine bräunliche Einschmelzung vorhanden |
| Schärfegrad Einschmelzung | 1 | bräunliche Einschmelzung kaum erkennbar |
| Schärfegrad Einschmelzung | 2 | flächig, keine Eingrenzung |
| Schärfegrad Einschmelzung | 3 | flächig, keine Eingrenzung, Braunfärbung reduziert |
| Schärfegrad Einschmelzung | 4 | flächig, vereinzelte Eingrenzung |
| Schärfegrad Einschmelzung | 5 | rund, unscharf umgrenzt |
| Schärfegrad Einschmelzung | 6 | rund, scharf umgrenzt |
| Schärfegrad Einschmelzung | 7 | rund scharf umgrenzt, bräunliches Zentrum |
Qualitätsmerkmal-Klassen der ablativen Strukturveränderungen.
Das Laserhandstück war in einem festgelegten Abstand zum Implantat in horizontaler x-y-Ebene beweglich im Parallelometer gelagert. Die Parameter „Abstand“ und „Kühlung“ wurden unabhängig voneinander untersucht. Bei der Abstandsuntersuchung wurden die Parameter „Luft“ und „Wasser“ konstant gehalten, bei der Kühlungsparameter-Untersuchung der Abstand.
Drei der ausgewerteten Implantatproben wurden nach der abgeschlossenen Versuchsreihe und Auswertung unter einem Rasterelektronenmikroskop (REM) im Straumann-Institut (Basel) nachuntersucht, um die Struktur der Qualitätsausprägungen von zentralen Einschüssen und Randzonen zu ergründen. Es wurden Aufnahmen in unterschiedlicher Vergrößerung betrachtet (Abb. 6). Mittels EDX (energiedispersive X-Ray-Analyse) wurde die Elementarzusammensetzung in den Oberflächeneinschmelzungen analysiert. Die konstanten Laserparameter waren: Expositionszeit 5s, Pulsenergie 100mJ, Pulsdauer 140µs, Frequenz 20Hz. Die variablen Parameter waren: Watt-Leistung, Spraymenge und Arbeitsabstand.

Abb. 6a und 6b: Ausschnitt aus der rasterelektronenmikroskopischen Untersuchung: Defekte bei der beispielhaften Einstellung „2 Watt, 2 mm Abstand, 30 % Luft, 30 % Wasser“.
Ergebnisse
Ohne Sprayeinwirkung bewirkt der Laser eine Temperaturerhöhung am Implantat-Knochen-Interface. Wenn nur Luft als Kühlmedium hinzugegeben wird, führt auch dies zu einer Temperaturerhöhung am Implantat. Erst vermehrte Wasserzugabe über 10 Prozent bewirkt eine Temperaturreduktion. Besonders effektiv ist die Kühlung bei der Zugabe von Luft-Wasser-Spray. Wird der Laser mit ausreichender Wasser- bzw. Spraykühlung betrieben, kann es nicht zu einem Temperaturanstieg im Knochen-Implantat-Interface kommen.
In den Versuchsreihen zur Analyse der Abhängigkeit von Arbeitsabstand und Spraywirkung wurden insgesamt 64 Implantatflächen untersucht und die Anzahl und Durchmesser von Oberflächeneinschmelzungen und Randzonen ermittelt. Die errechnete Gesamtfläche wurde bei der Analyse der Spraywirkung in Abhängigkeit vom Parameter „Laserleistung“ und „Sprayeinstellung“ untersucht. Qualitative Defektmerkmale wurden mit quantitativen Merkmalen verglichen und zueinander in Bezug gesetzt. Die Pulsenergie betrug 100mJ, die Pulsdauer 140µs, die Frequenz 20Hz.
Es zeigte sich, dass die Steuerung der Sprayzugabe für die Leistungsverdichtung dieses Lasertyps von vorrangiger Bedeutung ist und einen stark modulierenden Einfluss hat. Sie beeinflusst neben der Leistungseinstellung und dem Arbeitsabstand des Lasers erheblich die Qualität und Quantität von Defektflächen und steuert die Leistungsverdichtung des Lasers sehr gezielt. Es ist keine Proportionalität zwischen Spraymengenabgabe und Leistungsverdichtung zu erkennen.
Durch die Kombination von Laserlicht und Luft-Wassergemisch kommt es zu einem nicht linearen Prozess im Sinne der fotomechanischen Ablation. Wertet man alle Leistungseinstellungen aus, so ist für den Parameter Sprayeinstellung eine optimale Leistungsverdichtung in Bezug auf die Qualität der Defektflächen bei 2 Watt Laserleistung und 30-prozentiger Luft-Wasser-Sprayzugabe zu verzeichnen. Für den Parameter Arbeitsabstand ist eine optimale Leistungsverdichtung bezüglich der Qualität der Defektflächen bei 2Watt Laserleistung und 4mm bis 5mm Arbeitsabstand zu verzeichnen. Dieser Arbeitsabstand ist in der klinischen Anwendung bei manueller Führung des Laserhandstücks gut einzuhalten. Die Fläche der Einschmelzungen nimmt mit zunehmendem Abstand proportional ab.
REM-Untersuchung
Von drei Proben wurden je drei Übersichtsaufnahmen erstellt und an zwei Stellen die Struktur mit einer erhöhten Auflösung untersucht. In allen drei Fällen ist zu sehen, wie die feine fraktale Struktur der SLA-Topografie aufgeschmolzen ist. Die Sandstrahlstruktur bleibt im Wesentlichen beibehalten. Der Rand ist scharf, d.h. es gibt einen gut definierten Übergang zwischen gelaserten und unbehandelten Bereichen. Es wird kein Material herausgelöst, oder vulkanähnlich weggeschleudert. Es ist keine „zentrifugale“, konzentrische Materialdeponierung zu erkennen; die Energie des Lasers ist für eine Lochbildung im Titan zu gering. Unter dem REM gibt es kaum sichtbare Übergänge zwischen Randzonen und zentraler Einschmelzung, die scharfe Umgrenzung spricht für einen hohen Wärmeabfluss; die Laserenergie koppelt vor allem in den filigranen Titan-Ätzspitzen beziehungsweise „Ätz-Titanantennen“ an und verschmilzt diese. Die Energie reicht jedoch nicht aus, die Sandstrahlstruktur zu zerstören. Dennoch sprechen die Bilder für die starke Bündelung des Laserstrahls. Innerhalb dieses Einschmelzkreises ist die Verschmelzung homogen verteilt. Das Titan ist nur im Ätzbereich geschmolzen und durch den starken Wärmeabfluss nur in dieser Schicht wieder erstarrt, ohne die tiefer liegende SL-Struktur zu beschädigen.
Der lichtoptische Qualitätsunterschied von zentralen Einschmelzungen und grauen Randzonen ist daher ein Reflexionsphänomen. Es ist mit den inselartigen, nicht aufgeschmolzenen Bereichen erklärbar, die im Randbereich der Aufschmelzungen mangels Energiedichte gehäuft auftreten und mit den gitterartigen Einschmelzumrandungen eine hellgraue Lichtreflexion ergeben. Der Rand der Aufschmelzungen verzweigt sich und bildet dadurch die lichtmikroskopisch erkennbare Randzone; die homogen aufgeschmolzenen Zentralbereiche erscheinen lichtoptisch dunkel, da die nicht geschmolzenen Areale der Randzone mit ihrer unbeschädigten SLA-Struktur fehlen. Die mittels EDX ermittelte Elementarzusammensetzung ergab: in den nichtexponierten Arealen ist nur Titan (Ti) und Sauerstoff (O) zu sehen.
In den aufgeschmolzenen Zonen zeigt sich erhöhter Sauerstoffgehalt. Dies bedeutet, dass sich hier die Oxidschicht ausgedehnt hat. Dies erklärt die beschriebenen lichtoptischen Farbveränderungen des Titans, die auf unterschiedlich dicken Oxidschichten beruhen.
Die Laserleistung ist also zu niedrig, um die 30µm Sandstrahlstruktur (SL) zu zerstören; sie ist aber ausreichend, um die filigrane Ätzstruktur zu zerstören. Die „Antennenspitzen“ bzw. die Berggrate der SL-Struktur sind im Bereich der Ätzstruktur aufgeschmolzen.
Fazit
Eine Oberflächendekontamination bei der Periimplantitisbehandlung mit dem Er,Cr:YSGG-Laser ist möglich und klinisch vertretbar, jedoch ist aufgrund seiner oberflächenverändernden Eigenschaften auf eine defokussierte und energiereduzierte Parametereinstellung zu achten, um Defekte auf der SLA-Oberfläche möglichst klein zu halten. Thermische Schäden im periimplantären Interface treten nicht auf, da es durch die Sprayzufuhr zu einer Temperaturreduktion kommt.
Seitenanfang








