Parodontologie 23.09.2024
Dentogene Bakteriämie: Systemische Pathogenität oraler Biofilme
share
Dieser Artikel ist unter dem Titel „Dentogene Bakteriämie und ihre Folgen. Die systemische Pathogenität oraler Biofilme“ im PJ Prophylaxe Journal erschienen.
Die ökologischen Nischen der menschlichen Mundhöhle sind auch im gesunden Zustand von über 700 Arten von Bakterien, Pilzen und Hefen besiedelt. Dieses orale Mikrobiom schützt die oralen Strukturen als Residentflora vor pathogenen Keimen und steht über Botenstoffe in ständigem Austausch mit den Wirtsgeweben.31 Eine Störung der Homöostase durch exo- oder endogene Noxen führt zur Destabilisierungder Biozönose und in der Folge zur Etablierung einer pathogenen Plaque.
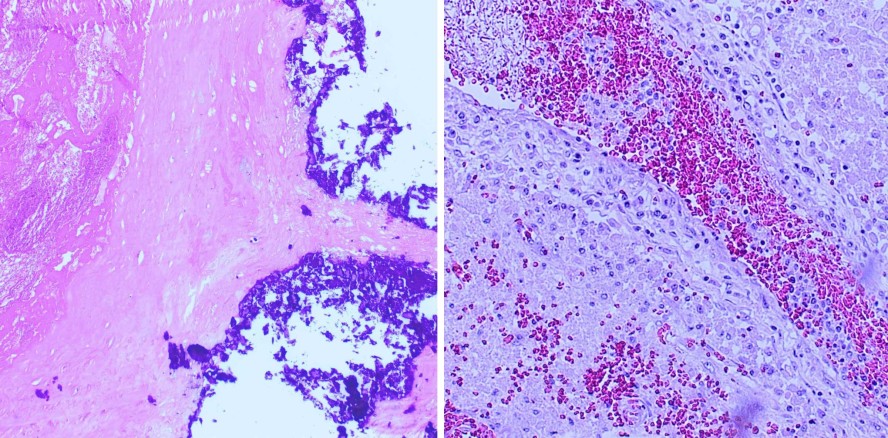
Die Spezies eines krank machenden Mikrobioms sind zumeist in komplexen Biofilmen im Sulkus, aber auch auf artifiziellen Oberflächen wie Prothesen und Implantaten organisiert (Abb. 1).7, 16 Mittels potenter Virulenzfaktoren induzieren sie Entzündungsreize und führen zu einer Destruktion der für die primäre Immunabwehr wichtigen Epithelschranke der Mundschleimhaut. Die unmittelbare Nähe des Biofilms zur stark vaskularisierten Mukosa erleichtert das Eindringen der Erreger in das subepitheliale Gewebe. Eine Reihe potenziell pathogener Keime kann sogar direkt in die Kapillaren der Gingiva eindringen. So begünstigt Streptococcus mutans die Expression von Adhäsionsmolekülen an den Endothelien. Gramnegative Anaerobier aus tiefen Zahnfleischtaschen zerstören mittels ihrer Proteasen und Lipopolysaccharide die Zellstrukturen und erhöhen die Permeabilität der entzündlich vorgeschädigten Gefäße. Die pathogenen Mikroorganismen samt ihrer Toxine und der durch sie induzierten Entzündungsmediatoren gelangen in die systemische Zirkulation. Floride Entzündungen oraler Gewebe verursachen schon bei geringen mechanischen Belastungen passagere Bakteriämien (Abb. 2). Bereits durch Zähneputzen und Kauen harter Speisen können Studien zufolge in 17 bis 25 Prozent der Fälle orale Bakterien in der Blutbahn nachgewiesen werden.13 Weit höher ist die Belastung nach zahnärztlichen Interventionen. In Zusammenhang mit professioneller Mundhygiene wurde in mehr als 40 Prozent der Fälle massive Bakteriämie festgestellt, noch höher liegen die Zahlen nach Zahnextraktion.30 Bei systemisch gesunden Personen mit intakter Immunabwehr hält die Bakteriämie zwischen 30 und 60 Minuten an, danach ist im Idealfall der Großteil der Keime durch das Immunsystem eliminiert. Ganz anders präsentiert sich allerdings die Situation bei Patienten mit chronischen, immunologischen oder konsumierenden Erkrankungen und auch bei älteren Menschen mit verminderter körpereigener Abwehr. Hier werden die haematogen disseminierten Erreger zu einer nicht zu unterschätzenden Gefahr für den Organismus.17, 23
Parodontale Entzündungen als Trigger der Arteriosklerose
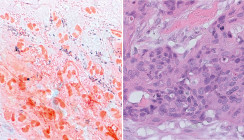
Die erste Station sind naturgemäß die Blutgefäße selbst und in der Folge das Herz. Es bestehen signifikante Zusammenhänge zwischen Art und Menge der parodontalpathogenen Bakterien und der Zunahme der Wanddicke der Gefäße. Arteriosklerotische Plaques aus der Karotis enthalten zu über 40 Prozent parodontalpathogene Keime. Die LPS der gramnegativen Anaerobier und Virulenzfaktoren von Bakterien wie S. mutans und Aggregatibacter actinomycetemcomitans (Aa) verursachen eine endotheliale Dysfunktion.2, 29 Auf molekularer Ebene produzieren parodontitisaktive Bakterien Hitzeschockproteine. Diese hoch immunogen wirksamen Antigene haben als Chaperone sowohl bei Pro- als auch bei Eukaryonten wichtige physiologische Funktionen bei der Faltung und Reifung von Eiweißen. Allerdings schützen sich bestimmte mikrobielle Spezies zunächst vor der Immunabwehr, indem sie Chaperone des Wirts nachahmen, ein Vorgang, den man als molekulare Mimikry bezeichnet.33 Langfristig werden aber dadurch hohe Antikörperlevel sowohl gegen die bakteriellen als leider auch gegen die humane HSP gebildet und in der Folge autoimmune Entzündungsprozesse gefördert.
Das Endothel wird zerstört und der Organismus reagiert mit der Ablagerung von Lipiden und nachfolgender Verkalkung (Abb. 3).26 Die durch Bakterien induzierten Zytokine regen die Proliferation der glatten Muskulatur in den Gefäßen an. P. gingivalis und S. sanguis können auf ihren Oberflächen ein spezifisches Eiweiß exprimieren, welches die Thrombenbildung fördert.22 Die so induzierten arteriosklerotischen Gefäßveränderungen machen auch vor Gehirnarterien, der Aorta und den Koronargefäßen des Herzens nicht halt. Chronische parodontale Infektionen erhöhen so als unabhängige Risikofaktoren signifikant das Schlaganfall- und Herzinfarktrisiko (Abb. 4).15, 18
Endokardiale Infektionen und erhöhtes Schlaganfallrisiko
Eine odontogene Bakteriämie ist für Patienten mit WHO-definierten Vorerkrankungen des Herzens, wie angeborenen zyanotischen Läsionen ohne Shuntoperation oder mit nach operierten Herzfehlern mit Conduits oder residualen Defekten, vorangegangener Endokarditis, Klappenvitien, mechanischen oder biologischen Klappenersatz eine Gefahr für die kardiale Gesundheit. Prinzipiell sind alle Eingriffe am Herzen mit Versorgung durch prothetisches Material zumindest in den ersten sechs Monaten nach der Intervention mit erhöhtem Risiko einer infektiösen Endokarditis belastet.11 Die WHO gibt Richtlinien zur antimikrobiellen Prophylaxe für bestimmte schleimhautdurchdringende zahnärztliche Maßnahmen wie Scaling, Wurzelglättung, Extraktionen oder parodontalchirurgische Eingriffe vor.12
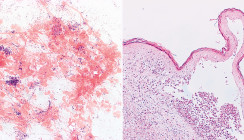
Bakteriämisch gestreute Keime siedeln sich meist an Schwachstellen im Körper an. Sowohl an sich zur normalen und Mundflora gehörende vergrünende Streptokokken als auch parodontitisassoziierte Keime, wie Fusobacterium nucleatum, Porphyromonas gingivalis, Prevotella intermedia, Aa und Eikenella corrodens sowie Staphylococcus aureus können lebensgefährliche Entzündungen mit bakteriell durchsetzten Vegetationen an den Herzklappen verursachen (Abb. 5). Besonders problematisch sind die Bakterien der HACEK-Gruppe, welche Auslöser der sogenannten kulturnegativen Endokarditiden sind.8 Die Bezeichnung resultiert aus dem nur sehr verzögerten Anwachsen der beteiligten Spezies auf Nährböden, was die Identifizierung und die Bestimmung der Antibiotikaempfindlichkeit stört. Zur HACEK-Gruppe gehören gramnegative Stäbchenbakterien der oralen und pharyngealen Flora, ihrem Anfangsbuchstaben entsprechend: Haemophilus influenzae, Aa, Cardiobacterium hominis, Eikenella corrodens und Kingella kingiae. Zumindest Eikenella und Aa stehen in unmittelbarem Zusammenhang mit Parodontitis, die drei anderen Arten sind bei floriden gingivalen Läsionen ebenfalls in die Sulkusflora integriert. Besonders Aa kann durch Fimbrien, Adhäsine und ein für die Endokardbesiedelung wichtiges extrazelluläres Matrixprotein mit dem Kollagen der Herzklappen interagieren.
Odontogene Bakteriämie in der Gravidität
Auf haematogenem Weg können orale Mikroorganismen und die durch sie induzierten Entzündungszellen und Entzündungsmediatoren aus der Zahnfleischtasche zu peripheren Geweben und nahezu allen Organen transportiert werden. Bei schwangeren Frauen kann eine Parodontitis zu einer Gefahr für das ungeborene Kind werden.3 Eine in der Schwangerschaft durch die Hormonlage getriggerte Entzündung der Gingiva und des Zahnhalteapparats führt zu einer Erhöhung von Entzündungsmediatoren, welche die Plazentaschranke für die ins Blut eingeschwemmten Bakterien durchgängig macht (Abb. 6). Die Plazenta hat auch im gesunden Zustand ein sehr kleines, für den Fötus nicht pathogenes Mikrobiom. Orale Pathogene wie Capnocytophaga, Viridansstreptokokken, F. nucleatum und E. corrodens stören diese Biozönose und induzieren durch ihre Anwesenheit ein dysbiotisches Milieu. Ähnlich wie in der Mundhöhle führen sie über ihre Virulenzfaktoren nun auch im Fruchtwasser, in der Dezidua und in den Eihäuten zu einer massiven Erhöhung der Entzündungsmediatoren. Die Folgen sind akute Chorioamnionitis und mütterliche Septikämie. Die Prostaglandinproduktion in den Chorionzotten und im Trophoblast steigt an und führt zu Kontraktionen des Myometriums. Die intrauterine Infektion geht mit hohem Abortus- und Frühgeburtsrisiko einher.19
Begünstigung von Arthritis und neurodegenerativen Erkrankungen
Die Zusammenhänge zwischen parodontalen Erkrankungen und rheumatoider Arthritis sind seit Langem bekannt.9, 27 P. gingivalis und gegen ihn gebildete Antikörper können nicht nur im gingivalen Sulkus, sondern direkt in der Synovia und der Gelenkflüssigkeit nachgewiesen werden.4, 5, 20 Der Keim bildet das Enzym, Peptidylarginindeiminase, welches die Aktivität von Argininresten verändert und dadurch die Bildung von APCA-Antikörpern, einem typischen Charakteristikum der rheumatoiden Arthritis fördert.21, 32 Eine erfolgreiche antiinflammatorische Therapie der Parodontalerkrankung mit gezielter Reduktion der pathogenen Plaque führt auch zu einer Verbesserung der rheumatischen Symptome.1Als Biofilmbildner haben oralpathogene Bakterien hohe Affinität zu artifiziellen Oberflächen, wie Gelenkimplantaten, wo sie zu massiven Komplikationen führen können. So konnten auf wegen Spätinfektionen explantierten Hüftprothesen bis zu 15 eindeutig orale Spezies nachgewiesen werden.34
Anaerobe Bakterien aus entzündeten Zahnfleischtaschen können über die Blutbahn die Blut-Hirn-Schranke alterieren und passieren.6 Einige von ihnen stehen in unmittelbarem Zusammenhang mit der Progression neurodegenerativer Erkrankungen wie der Alzheimer-Demenz und M. Parkinson.14, 28 So fördert beispielsweise P. gingivalis entzündliche Prozesse im ZNS, induziert dort eine Alterierung der Mikroglia und vermehrte TNF-α-Bildung. Andererseits kann er direkt mittels seiner Gingipaine die Bildung der gefährlichen hyperphosphoryllierten p-Tau-Proteine, welche die Alzheimerplaques bilden, initiieren. Die Konzentration der Entzündungsenzyme im Sulkus tiefer Zahnfleischtaschen und im zentralen Nervensystem korrelieren mit dem Fortschreiten der Alzheimererkrankung.10 In Gehirnen verstorbener Alzheimerpatienten konnten mittels PCR neben P. gingivalis auch vermehrt Treponema denticola, F. nucleatum und Aa nachgewiesen werden.25 Hohe Affinität zu nervalen Strukturen hat auch das orale gramnegative Stäbchenbakterium Campylobacter rectus, welches morphologische Veränderungen im Hippocampus, einem Teil des limbischen Systems, hervorrufen kann.
Bakterielle Entzündungen von Gingiva und Parodontium sind nicht nur eine Gefahr für die Mundgesundheit. Aufgrund der guten Durchblutung der oralen Gewebe können sie Ausgangspunkt schwerer systemischer Erkrankungen sein. Prophylaxe und bei Bedarf situationsentsprechende antiinflammatorische und antimikrobielle Therapie dienen nicht nur der Erhaltung der Zähne, sie verhindern auch den für die Gesamtgesundheit gefährlichen Keimtransfer in den Körper.24
Eine Literaturliste steht Ihnen hier zum Download zur Verfügung.