Prophylaxe 06.12.2020
Die Photodynamische und Photothermische Therapie
share
Ein Überblick
Die Parodontitis ist eine multifaktorielle Erkrankung. Paropathogene Keime (als ein Hauptfaktor) wachsen in Biofilmen, worin sie sich vor Antibiotika schützen können. Weiterhin kann die anatomische Komplexität der Wurzeloberflächen dazu beitragen, dass bakterielle Beläge auf mechanischem oder chemischem Wege nur schwer entfernt werden können. Porphyromonas gingivalis kann z. B. sogar die epithelialen Zellen der Gingiva penetrieren1 und dort auch, der Körperabwehr und konventionellen Medikamenten entgehend, überdauern2.
Systemische Antibiotika sind, durch die in der Sulkusflüssigkeit schwer zu erreichende minimale inhibitorische Konzentration, in ihrer Wirksamkeit limitiert. Dies trifft noch mehr für Biofilme zu. Dazu treten immer häufiger bakterielle Resistenzen auf.3 Der Erfolg der Parodontitisbehandlung hängt u. a. von der Entfernung der Biofilme sowie ihrer toxischen Produkte, wie z. B. Lipopolysaccharide, von der Wurzeloberfläche und der Neutralisation der proinflammatorischen Zytokine des Wirts ab.4 Konventionelle Behandlungsmethoden wie Scaling und Wurzelglättung (SRP) können die Parodontalpathogene v. a. in tiefen Taschen nicht komplett entfernen oder gar die Gewebsinvasion verhindern. Eine bakterielle Rekolonisierung ist möglich. Behandlungsrezidive können die Folge sein.2 Daher wurde in der Folge nach alternativen antibakteriellen Therapieansätzen gesucht. Neuere Strategien sind die antimikrobielle Photodynamische Therapie (aPDT) und die antibakterielle Photothermische Therapie (aPTT).
Die Photodynamische Therapie (PDT)
Die PDT wurde durch einen Zufall Anfang des 20. Jahrhunderts entdeckt. Bei Versuchen Herrmann von Tappeiners beobachtete sein Doktorand Oscar Raab, als er eine Schüssel mit Wimperntierchen und Acridin-Orange ins Licht stellte, den raschen Tod der Organismen.5 Die Interaktion zwischen Farbstoff, Licht und Zielgewebe wurde in den folgenden Jahren als PDT nutzbar gemacht und wird in der Humanmedizin besonders in der Onkologie eingesetzt. Sie besteht aus drei Elementen:
- harmloses sichtbares Licht einer bestimmten Wellenlänge (generiert aus einem Laser oder LED)
- ungiftiger Farbstoff, der sogenannte Photosensitizer (PS)6
- Sauerstoff
Der PS bindet sich an die Zielzellen. Wird er nun einem sichtbaren (Laser-)Licht in der Gegenwart von Sauerstoff ausgesetzt, führt dies zu seiner Anregung zum Singulett-Zustand. Dieses instabile Molekül geht entweder durch Energieverlust wieder zurück in den stabilen Zustand oder in einen langlebigeren Triplett-Zustand über (Abb. 1). In diesem Stadium kann das Molekül Redoxreaktionen mit umgebenden Zellmolekülen eingehen (Reaktionstyp I)8 oder mit molekularem Sauerstoff reaktive zytotoxische Sauerstoffspezies9 (z. B. Singulett-Sauerstoff, Superoxidionen und Hydroxylradikale) erzeugen (Reaktionstyp II).10 Dieses Phänomen heißt letale Photosensitivierung.11 Die reaktiven Sauerstoffspezies sind in der Lage, irreparablen Zellschäden zu erzeugen. Singulett-Sauerstoff tötet Bakterien, Viren, Protozoen und Pilze. In biologischen Systemen existiert er etwa 0,04 μs und der Aktionsradius ist 0,02 μm. Dadurch ist die durch ihn bedingte Zellzerstörung auf den Bereich des PS begrenzt. Entfernte Zellen und Organe bleiben vor Nebenwirkungen geschützt.6
Die Photothermische Therapie (PTT)
Die PTT ist eine, der PDT ähnelnde minimalinvasive Behandlungsmethode, basierend auf der Verwendung von Laserlicht bestimmter Wellenlängen und der Bindung von photosensitiven Materialien, d. h. exogenen Farbstoffen wie z. B. Indocyaningrün (ICG) oder Nanopartikeln an die Zielzellen, aber auch endogenen Chromophoren in diesen Zellen.12
Bei der PTT wird der PS nach Absorption des Lichts durch Elektronenübergang in einen angeregten Zustand überführt. Durch die Abgabe der Elektronenenergie kommt es zu einer Überhitzung, wodurch lokale irreversible Zellschäden im Bereich des lichtabsorbierenden Gewebes oder der Zielzellen entstehen. Die PTT hat den Vorteil, dass es ein sauerstoffunabhängiger Prozess ist.13 Die antibakterielle Wirkung von ICG wurde analysiert. Die Ergebnisse zeigen einen signifikanten Einfluss von ICG und Phototherapie mit Diodenlaser bei 810 nm auf die Reduzierung der Anzahl von pathogenen gramnegativen und grampositiven Bakterien.14
Anwendungen in der Zahnheilkunde
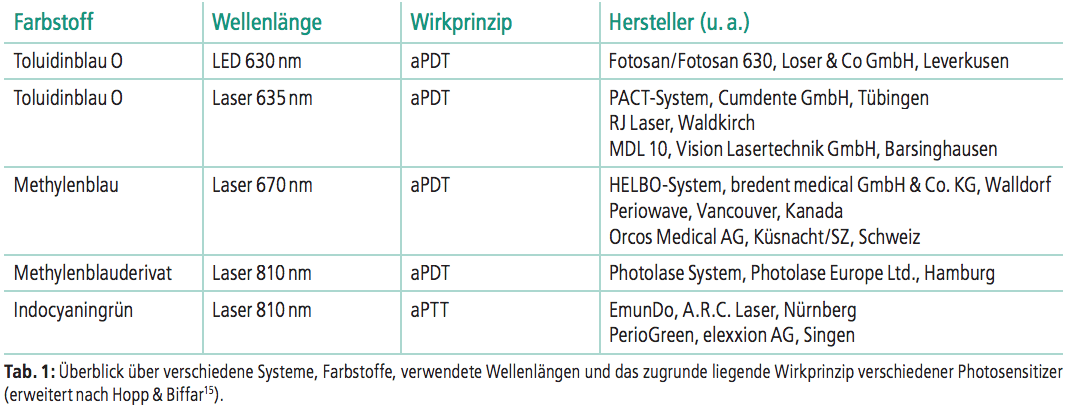
Seit den 1990er-Jahren wird die PDT bzw. die PTT auch für zahnärztliche Anwendungen erforscht, nachdem diese Behandlungsmethoden in der übrigen Humanmedizin, aber auch in der Veterinärmedizin schon lange Zeit angewendet wurden. Auf dem Markt existieren neben den vorgenannten Bezeichnungen verschiedene andere Begrifflichkeiten, die eher aus Marketinggründen entwickelt wurden, als dass es sich um andere Wirkprinzipien handeln würde:15 Photoaktivierte Chemotherapie (PACT), Photodynamische Desinfektion (PDD), Light-Activated Disinfection (LAD), Photoaktivierte Desinfektion (PAD) – um einige Beispiele zu nennen. In der Zahnheilkunde werden zurzeit vorwiegend vier unterschiedliche PS angewendet. Tabelle 1 gibt einen Überblick über verschiedene Systeme, Farbstoffe, verwendete Wellenlängen und das zugrunde liegende Wirkprinzip.
Anwendungsbereiche
Konservierende Zahnheilkunde
Die aPDT findet hier eine Anwendung in der Kavitätendesinfektion, besonders bei Caries profunda-Behandlungen oder bei direkten Überkappungen.16 Es wurden jedoch auch Versuche zur Kariesexkavation mittels aPTT durchgeführt.17 Im Gegensatz zu den blauen Farbstoffen findet nämlich mit ICG nicht nur eine Desinfektion, sondern auch ein Substanzabtrag statt. Ob dies eine Alternative zu den Hartlasern (z. B. Er:YAG- und Er,Cr:YSGG-Laser) darstellt, bleibt abzuwarten.
Oralchirurgie/MKG-Chirurgie
In der Oralen Chirurgie bietet sich die aPDT in der Desinfektion von Knochen- und Weichteildefekten, z. B. bei Wurzelspitzenresektionen oder zur Prophylaxe einer alveolären Ostitis/Dolor post.18 Ein positiver Einfluss der Laserstrahlung auf die Knochenheilung wird diskutiert.19
Endodontie
Zur Desinfektion des Wurzelkanalsystems wurden schon seit Längerem Hartlaser eingesetzt. Diese hochenergetischen Laser führen zu einer dosisabhängigen Hitzentwicklung, wodurch Bakterien abgetötet werden. Es entstehen jedoch besonders bei unkorrekten Behandlungsparametern Kollateralschäden wie verkohltes Dentin, Ankylosen, Schmelzen des Wurzelzements, Wurzelresorptionen und periradikuläre Nekrosen.20
Bei der aPDT besteht ein solches Risiko wegen der niedrigen Laserleistung nicht. Es werden durch die Hersteller angepasste Lichtleiter und Photosensitizer angeboten. Studien konnten zeigen, dass die Keimlast durch die aPDT signifkant reduziert werden konnte.21
Periimplantitistherapie
In der Implantologie wird die aPDT bei periimplantärer Mukositis oder Periimplantitis in offen chirurgischen oder geschlossenen Verfahren angewendet.22 Die Dekontamination der infizierten Implantatoberflächen ist das primäre Ziel der Periimplantitistherapie und unabdingbar bei regenerativen Maßnahmen.23 Aufgrund der Schwierigkeiten, die raue Implantatoberfläche komplett zu reinigen, erscheint die aPDT Vorteile gegenüber mechanischen Methoden zu haben.24
Parodontologie
Die aPDT und aPTT hat in der Parodontologie derzeit den größten Anwendungsbereich in der Zahnheilkunde.15 Die aPDT als Laserbehandlung mit der Laserklasse 3B kann auch durch die geschulte und fortgebildete Helferin bei entsprechender Vorbehandlung angewendet werden. Da es sich um eine physikalische, nichtinvasive Therapie25 handelt, darf sie nach Vorgabe des Zahnheilkundegesetzes § 1, Abs. 5 und 6 delegiert werden. Der Zahnarzt hat bei der Delegation von Aufgaben, im Sinne einer konkret abgegrenzten Beauftragung mit Einzelzuweisung, die Aufsichts-, Kontroll- und Verantwortungspflicht. Die Aufgabe muss aber nicht von ihm ausgeführt werden.22
Verschiedene Studien konnten zeigen, dass bei Patienten mit Parodontitis die aPDT als zusätzliche Maßnahme zu SRP nach drei und sechs Monaten zu einer signifikanten Verringerung der Blutung auf Sondieren (BOP) führt.26,27 Auch wurde eine Verbesserung der Sondierungstiefe und des klinischen Attachmentlevels bei kombinierter Anwendung der aPDT mit SRP nach drei und sechs Monaten nachgewiesen.28
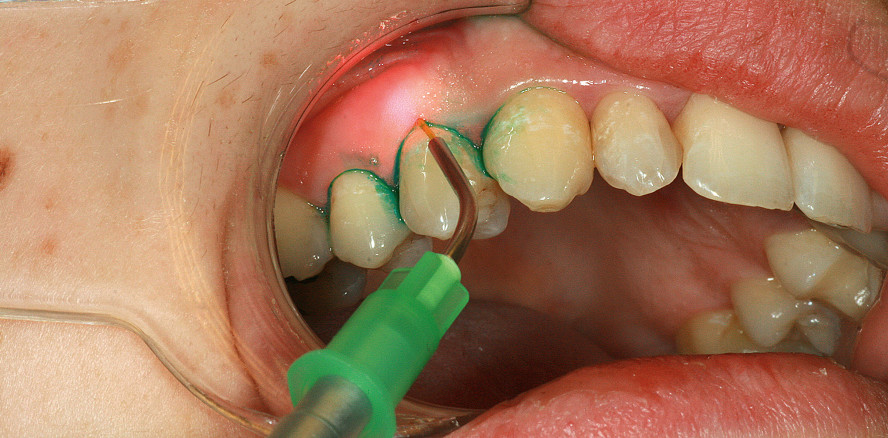
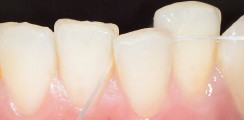
Jedoch bleibt die Studienlage insgesamt uneinheitlich, insbesondere mit Hinblick auf die Langzeitstabilität. Dies mag an der Heterogenität der in den Studien verwendeten Lasersysteme und PS liegen.25 Die Anwendung von ICG als PS mag als sauerstoffunabhängiges aPTT-Verfahren bei den anaeroben Verhältnissen innerhalb der parodontalen Tasche Vorteile gegenüber den „blauen“ Farbstoffen haben. Verschiedene Studien deuten darauf hin.29,30 Ein Beispiel für die klinische Anwendung zeigen die Abbildungen 2 und 3.
Fazit
Die aPTT mit ICG stellt möglicherweise eine sinnvolle Ergänzung zu Scaling und Wurzelglättung während der systematischen Parodontitistherapie dar. Dies könnte dazu führen, die Häufigkeit einer systemischen Antibiotikagabe zu reduzieren. In den aktuellen S3-Leitlinien der EFP31 wird die aPDT nicht als Routinebehandlung empfohlen. Die Datenlage an kontrollierten klinischen Langzeitstudien zum zusätzlichen Nutzen der aPTT mit ICG ist derzeit noch begrenzt.
Die vollständige Literaturliste gibt es hier.
Der Beitrag ist im Prophylaxe Journal erschienen.
Bitte beachten Sie, dass CME-Tests nach zwei Jahren ihre Gültigkeit verlieren.
Foto: Autor