Prophylaxe 28.02.2011
Gefahr erkannt - Gefahr gebannt
Mikrobiologische Diagnostik und antibiotische Therapie bei Parodontitis
Überwachte Vernachlässigung oder navigierte Therapie? Mikrobiologische Diagnostik ermöglicht eine Absicherung der klinischen Diagnose, eine gezielte Wahl des geeigneten Antibiotikums oder einer nur im Einzelfall notwendigen Antibiotika-Kombination, eine bessere Abschätzung der Prognose sowie effiziente und zielorientierte Therapieplanung.
Die Deutsche Gesellschaft für Parodontologie e.V. (DGP) geht davon aus, dass bei ca. 90% aller Patienten im Laufe des Lebens ein parodontales Problem auftritt, bei 10% davon eine aggressive Parodontitis. Im etablierten Diagnosekonzept einer Zahnarztpraxis muss verankert sein, wie solche Patienten erkannt werden bzw. zu detektieren, wenn bei bislang unaufälligen Patienten ein parodontales Problem auftritt.
Integration der Mikrobiologie in die PA-Diagnostik
Verdeutlicht werden soll dies anhand eines fiktiven Falles: Ein Patient betritt zum ersten Mal die Praxis. Nun wird entsprechend der Ausrichtung der Praxis ein Diagnosekonzept angewendet, das auch dazu geeignet sein muss, PA-Patienten zu erkennen. In der Regel handelt es sich dabei um den parodontalen Screening Index, ergänzt um Fragen zur Mundhygiene des Patienten. Wie wird nun die Mikrobiologie in das Konzept eingebunden?
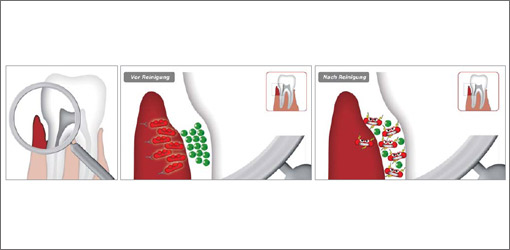
Abb. 1-3: Dynamik im Biofilm: Die Zahnfleischtasche vor und nach der Reinigung.
Ein Beispiel:
1. Erstkontakt, Besprechung des Prophylaxekonzepts mit dem Patienten, ggf. Erhebung
des Mundhygienestatus, Fragebogen, Erwartungen des Patienten,
Kooperationsbereitschaft.
2. Prophylaxesitzung(en)
3. Definitive Entscheidung, ob der Patient eine PA-Behandlung benötigt: Wenn diese Frage
mit ja beantwortet wird, ist jetzt eine mikrobiologische Testung notwendig, z. B. bei
Patienten mit PSI $ 3, entsprechendem PA-Status: 1. Mikrobiologische Testung.
4. PA-(Vor)Behandlung (Scaling/Root Planing, weitere Methoden). Mittlerweile müsste auch
das Ergebnis der mikrobiologischen Testung vorliegen, woraufhin entschieden werden
kann, wie weiter vorgegangen wird. Sollen Antibiotika eingesetzt werden oder nicht?
Wenn Antibiotika zum Einsatz kommen, sollte die weitere PA-Behandlung bis zum
Endpunkt durchgeführt und unmittelbar danach die Antibiotika eingesetzt werden.
5. Antibiotische Therapie: Beginn unmittelbar bei der letzten Sitzung der PA-Therapie.
6. Nach Beendigung der antibiotischen Therapie: Beginn der professionellen Plaque-
Kontrolle, Frequenz und Anzahl der Sitzungen individuell.
7. Erfolgskontrolle, in diesem Rahmen 2. Mikrobiologischer Kontrolltest.
8. UPT-Recall alle drei bis vier Monate: Mikrobiologische Kontrolle, bei auffälliger Klinik.
Der Einsatz des Mikrobiologischen Tests findet demzufolge nach vorher festgelegten Kriterien zu ganz bestimmten Zeitpunkten im Diagnosekonzept der Praxis und im Verlauf der PA-Behandlung statt. Wichtig ist, dass diese Zeitpunkte immer eingehalten werden, um vergleichbare Ergebnisse zu erhalten.
Zusammenfassung
Entscheidung zur Testung: Bei einem PSI . 3 (WHO-Sonde) erfolgt in der Regel eine PZR und die Erhebung eines kompletten PA-Status. Erster Test nach der/den ersten Prophylaxesitzung(en) (nach der Instrumentierung!), aber vor der ersten PA-Therapiesitzung. Zweiter Test nach Abschluss der Phase der professionellen Plaquekontrolle im Rahmen der PA-Therapie, bevor der Patient im Rahmen des UPT-Recalls behandelt wird.
Dabei ist Folgendes zu beachten: Es ist nicht sicher, dass ein befriedigendes klinisches Ergebnis auch die Abwesenheit von Markerkeimen bedeutet. Dies lässt sich nur durch die Mikrobiologie zeigen. Weder eine gute persönliche Mundhygiene noch die fachgerechte subgingivale Instrumentierung können bestimmte Markerbakterien beseitigen, z.B. Aggregatibacter actinomycetemcomitans oder auch Porphyromonas gingivalis.
Obwohl es keine klinischen Anhaltspunkte für das Vorhandensein von PA-Erregern gibt, stellen sie den eigentlichen Auslöser und einen wichtigen Faktor für die Prognose der Parodontitis dar. In der Regel wird daher die mikrobiologische Testung als fester Bestandteil in die Erhebung des Parodontalbefundes eingebunden.
Klinische und mikrobiologische Befunde
Grundlage für eine langfristig erfolgreiche Betreuung eines PA-Patienten ist:
1. Die bestmögliche Einschätzung der Prognose geschädigter Parodontien.
2. Frühstmögliche Detektion der Therapieresistenz einer Parodontitis bzw. von einzelnen
Stellen. Bei Vorhandensein bestimmter Erreger ist von vorneherein klar, dass es zu
einem rasch fortschreitenden Attachmentverlust kommen wird.
3. Für beide Aufgaben ist die mikrobiologische Testung notwendig.
Ein Beispiel: Der Nachweis von A.a. stellt eine sichere Indikation für eine antibiotisch unterstützte Therapie dar, da diese Keime durch mechanische Therapie allein nicht beseitigt werden können (Renvert et al. 1990). Eine ähnliche Situation besteht bei Porphyromonas gingivalis und in geringerem Maß bei Tannerella forsythensis. Die klinischen Befunde sind Grundlage für das weitere Vorgehen und unverzichtbar, jedoch führt die alleinige Erhebung klinischer Parameter zu einem unnötigen Zeitverlust, da die Verschlechterung der Sondierungstiefe und des BOP zwar exakt die aktuelle Situation beschreibt, aber nicht deren Ursachen.
Aus diesem Grund ist eine pauschale Antibiotikatherapie nur aufgrund rasch progredienter klinischer Befunde allein nicht indiziert, sondern erst dann, wenn ein mikrobiologischer Befund als klare Indikation vorliegt. Die diagnostische Mindestanforderung lautet hier: spätestens, wenn irgendwann im Behandlungsverlauf klar wird, dass eine Antibiotikatherapie notwendig wird, ist auch eine mikrobiologische Testung notwendig, denn dann tritt die Antibiotikatherapie während dieser Phase der Behandlung in den Mittelpunkt der Bemühungen. Das heißt, die weiteren Elemente der Therapie müssen temporär auf sie abgestimmt werden.
Zeitpunkt für die mikrobiologische Testung:
1. Sobald die Notwendigkeit einer Parodontitistherapie festgestellt wurde.
2. Spätestens wenn sich die Frage stellt, ob eine antibiotische Therapie notwendig ist.
Die pauschale Anwendung der sogenannten adjunktiven, kalkulierten Antibiotikatherapie in Form des Winkelhoff-Cocktails (Kombination aus Amoxicillin und Metronidazol) ist in jedem Fall abzulehnen. „Adjunktiv und kalkuliert“ heißt hier nicht mehr als „Nebenbei und ohne mikrobiologisch unterstützte Indikation“. In Zeiten rasant zunehmender hochresistenter Problemkeime ist die möglicherweise unnötige Verordnung einer Kombination von zwei Breitbandantibiotika mit erheblichem Nebenwirkungspotenzial weder bloß unterstützend zu sehen noch mit guter klinischer Praxis zu vereinbaren. Die gegenwärtigen Probleme mit Krankenhausinfektionen sind zweifellos auch auf den unkritischen Gebrauch von Antibiotika zurückzuführen.
Die mikrobiologische Testung vor Anwendung von Antibiotika ist Pflicht! Was sagt uns die Testung konkret?
– Wird überhaupt antibiotische Behandlung benötigt?
– Wird eine Kombinationstherapie benötigt?
– Wird eine Monotherapie benötigt?
Auf welchen Ergebnissen beruhen diese Aussagen?
– Werden Aggregatibacter und strikt anaerobe Erreger nachgewiesen, ist eine
Kombinationstherapie erforderlich (Amoxicilin, Metronidazol).
– Wird nur A.a. nachgewiesen und keine strikt anaeroben Keime (P.g., T.f.), so wird
nur eine Monotherapie mit Amoxicillin benötigt.
– Werden strikt anaerobe Erreger nachgewiesen (P.g., T.f.), so bedarf es einer
Monotherapie mit Clindamycin oder Metronidazol.
Vollständige Antibiotikaempfehlungen sind beim Verfasser erhältlich.
Antibiotika und Darmflora
Die Antibiotikatherapie ist ein erheblicher Eingriff in die mikrobielle Homöostase des Patienten. Für die PA-Therapie werden Antibiotika benötigt, welche insbesondere gegen anaerobe Erreger wirken. Diese Antibiotika beeinträchtigen daher auch die Darmflora, weil sie ebenfalls in hohem Maße aus anaeroben Bakterien besteht. Hilfreich sind hier Probiotika, welche der Reduktion der Darmflora entgegenwirken bzw. bei dem Wiederaufbau helfen (Probiotischer Joghurt, entsprechende Therapeutika) (Bischoff et al. 2005).
Technische Aspekte der optimalen Probenahme
Die Probenahme erfolgt nach Beendigung der letzten Behandlungseinheit, nicht vorher. PA-Markerkeime sitzen im Gewebe oder sind strikt gewebsadhärent. Die Zerstörung des Biofilms durch subgingivale Instrumentierung führt zu einer Freisetzung der aggressiven Markerkeime aus dem Gewebe wieder zurück in die Sulkusflüssigkeit. Diese sind dann besser nachweisbar als vor der subgingivalen Reinigung. Die Abbildungen 1 bis 3 verdeutlichen diese Dynamik. Der Patient darf auch vor der geplanten Probenahme die Zähne putzen, dies wird die Keimausbeute nicht beeinträchtigen.
Merke: Die subgingivale Belastung des Patienten mit PA-Erregern lässt sich durch das klinische Bild und die Beurteilung der Mundhygiene nicht einschätzen! Es gibt Fälle mit tiefen Taschen, die nur eine geringe Belastung mit PA-Markerkeimen aufweisen, andererseits findet man bei parodontal unauffälligen Patienten in flachen Taschen Aggregatibacter und Porphyromonas. Mit der optimalen Probenahme steht und fällt das Ergebnis der Testung. Wenn folgende Punkte beachtet werden, erzielt man optimale Resultate.
– Zeitpunkt der Probenahme: immer nach einer PZR oder subgingivalen Instrumentierung.
Durch die „Vorreinigung“ werden mehr gewebsgebundene aggressive Markerkeime
freigesetzt und detektiert.
– Material: Papierspitzen. In einer Vergleichstudie mit Papierspitzen und Mikropipetten
wurden gleichwertige Ergebnisse für beide Probenahmetechniken gefunden (Geibel
und Gleissner 2007).
– Probenahme jeweils in der tiefsten Tasche eines Quadranten, gemeinsame Auswertung
der Spitzen.
– So viel subgingivales Material wie möglich sammeln (auch mit mehreren Spitzen pro
Tasche).
Interpretation der Ergebnisse
Die prognostisch relevanten Parodontitis-Markerbakterien sind seit Langem bekannt, ebenso ihre unterschiedliche Virulenz und daraus hervorgehend ihre Bedeutung für die Prognose der Parodontitis. Auf dieser Basis lassen sich klare Aussagen bezüglich des zukünftigen Verlaufs der Parodontitis und damit auch bezüglich der individuellen Behandlung des Patienten machen (Infobox 2).
Erläuterung zur Infobox: Aggregatibacter sind durch subgingivale Instrumentierung, einerlei welcher Art (Gracey-Küretten, Laser, Pulverstrahlgeräte, photodynamische Therapie), nicht sicher aus dem Sulkus zu entfernen. Der Nachweis von Aggregatibacter und in geringerem Maß auch von Porphyromonas gingivalis ist daher eine sichere Indikation für die Antibiotikatherapie.
Folgen der nicht navigierten Therapie
Merke: Keine ungezielte Therapie ohne vorherige Diagnostik! Sowohl eine ungezielte mechanische Therapie als auch die nicht gesteuerte Antibiotikatherapie kann dem Patienten schaden.
Scaling/Root Planing
Interessanterweise wird durch Scaling/Root Planing ohne antibiotische Therapie die Menge an Aggregatibacter im Sulkus erhöht (Renvert et. al 1990). Wie ist das möglich? Im ungereinigten Zustand wird die Flora im Sulkus durch eine Vielzahl verschiedener Spezies, welche die Plaqueflora konstituieren, dominiert. Die aggressiven Markerkeime, insbesondere Aggregatibacter acinomycetemcomitans und in geringerem Maße Porphyromonas gingivalis dringen in das Saum- bzw. Taschenepithel ein und sind aufgrund dieser Gewebsständigkeit vor der Entfernung durch die subgingivale Instrumentierung geschützt. Wenn nun durch Scaling/Root Planing die Plaqueflora beseitigt wird, werden die aggressiven Markerkeime wieder aus dem Gewebe in den Sulkus freigesetzt. Zusätzlich erhöht sich durch dieses Vorgehen auch die Virulenz der Markerkeime. Warum? Die Virulenz der Markerkeime hängt mit ihrer Lokalisation zusammen. Tendenziell sind gewebsständige Erreger in einem Überdauerungszustand, der mit der Repression von Virulenzgenen einhergeht. Die Freisetzung dieser Erreger aus dem Gewebe kann zu einer Derepression dieser Sequenzen führen und damit zu einer größeren Aggressivität der Keime.
Wiederholte Instrumentierung bei Vorliegen von Aggregatibacter actinomycetemcomitans führt daher paradoxerweise zu einer Verschlechterung der Parodontitisprognose, wenn nicht antibiotisch behandelt wird. Daraus resultiert die Bedeutung einer sinnvollen mikrobiologischen Diagnostik im Rahmen der Parodontitistherapie. Ohne die Kenntnis, welche Erreger vorliegen, kann man sich nicht auf die alleinige mechanische Therapie verlassen. Man erreicht dadurch häufig vielmehr das Gegenteil.
Antibiotikatherapie
Ebenso verhält es sich bei der nicht gesteuerten Antibiotikatherapie. Werden Antibiotika verordnet, ohne dass die Zielerreger vorhanden sind, so wird logischerweise nur die normale Bakterienflora durch die Antibiotika beseitigt bzw. stark reduziert. Damit wird nur eine günstige Ausgangsposition für eine Besiedelung mit pathogenen Erregern geschaffen. Auch hier erreicht man also nur das Gegenteil dessen, was zu Beginn erzielt werden sollte.
Mikrobiologischer Befund als Möglichkeit zur Patientenbindung
Im Rahmen der UPT stellt die Erhaltung der Patientencompliance an das Prinzip einer drei- bis viermonatigen Recallintervalls zur Biofilmkontrolle eine gewisse Herausforderung dar. Selbstverständlich spricht hier die Qualität der Behandlung für sich, aber auch die Rahmenbedingungen können eine Rolle spielen, da es dem Patienten das Gefühl einer umfassenden Betreuung gibt. Ein didaktisch gut aufbereiteter und optisch ansprechender mikrobiologischer Befund kann die Akzeptanz fördern, weil dadurch Erfolge sichtbar und auf Risiken aufmerksam gemacht werden kann. Das „Ampelsystem“ zur Verdeutlichung des Risikoniveaus leistet hier gute Dienste, da es allgemeinverständlich ist.
Test auf Interleukin-1-Beta-Polymorphismus (Interleukin-Gentest)
Ein wichtiger Marker zur Einschätzung der Prognose einer Parodontitis ist die Produktion des zentralen proinflammatorischen Mediators Interleukin-1-Beta (IL-1b) und seines Antagonisten (Interleukin-1-Beta-Rezeptorantagonist).
Bei etwa 30 % der Bevölkerung liegt ein sogenannter genetischer Polymorphismus des IL-1-Gens vor, d.h. diese Personen produzieren bei einem bakteriellen Reiz vermehrt (bis zu viermal soviel) Interleukin als andere Personen. Aufgrund dieser vermehrten Interleukin-Produktion verlaufen Entzündungsreaktionen bei diesen Menschen sehr viel stärker als normalerweise und mit umfangreicherer Gewebedestruktion. In einer grundlegenden Arbeit von 1997 postulierten Kornman et al. einen Zusammenhang zwischen diesem „Interleukin-Highresponder“-Status und schwer verlaufender Parodontitis bei Erwachsenen. Dieser Status beschreibt daher vermutlich eine entsprechende Veranlagung.
Wie in jedem physiologischen Regelkreis ist neben dem reaktionsverstärkenden Mediator (IL-1) auch eine Gegenregulation notwendig, in diesem Fall ist das der Interleukin 1 Rezeptor-Antagonist (IL-1Ra). Bei einem Interleukin-Gentest werden daher diese beiden Mediatoren untersucht.
– Interleukin 1 (entzündungsfördernd)
– Interleukin 1 Rezeptorantagonist (entzündungshemmend)
Daraus ergeben sich vier Konstellationen, die vier Reaktionstypen beschreiben:
Genotyp 1: IL-1 normal, IL-1Ra normal: Patient mit normaler Entzündungsreaktion
Genotyp 2: IL-1 hoch, IL-1Ra normal: Patient mit starker Entzündungsreaktion
Genotyp 3: IL-1 hoch, IL-1Ra niedrig: Patient mit sehr starker Entzündungsreaktion
Genotyp 4: IL-1 normal, IL-1Ra niedrig: Patient mit verminderter Entzündungshemmung, häufig bei Periimplantitis.
Laine et al. (2001) fanden bei Personen mit progredienter Parodontitis, bei denen keine andere Risikofaktoren für die Parodontitis vorlagen (A.a., P.g., Rauchen, Diabetes), in 42,1% den Genotyp 3. Gesunde Personen ohne Parodontitis trugen den Genotyp nur in 11,3% der Fälle. Diese Zahlen legen einen Zusammenhang zwischen Parodontitis und Interleukin-Genotyp nahe. Obwohl die Diskussion über die prognostische Aussagekraft dieses Parameters nach wie vor im Gange ist, kann man mit Sicherheit einen wichtigen Schluss für die praktische Anwendung des Parameters ziehen: Sobald zwei Risikofaktoren im Spiel sind, wird die prognostische Aussagekraft des Interleukin-Prognosetests hochsignifikant, also z.B. wenn der Patient Raucher ist oder unter Diabetes sowie erhöhten psychischen oder auch physischen Stress leidet. Man kann dann mit hoher Sicherheit sagen: ein Patient mit Genotyp 2, 3 oder 4 im Interleukin-Gentest, der zusätzlich einen weiteren Risikofaktor hat, trägt ein signifikant erhöhtes Risiko für eine rasch fortschreitende Parodontitis oder zum Beispiel auch Periimplantitis.
Das Risikoprofil
Mit dem Interleukin-Gentest kann die berechtigte Frage des Patienten nach seinem persönlichen Risikoprofil sehr gut beantwortet werden. Risikofaktoren, die aus dem persönlichen Lebensstil resultieren, können damit besser beurteilt und der Patient auf einer sicheren Basis beraten werden.
Beispiel Rauchen: Patienten werden das „Laster“ nur schwer aufgeben, wenn nicht absolut sicher ist, dass es dem Behandlungserfolg schadet. Mithilfe der Prognosemarker kann hier im Rahmen einer umfassenden Betreuung des Patienten eine definitive Aussage gemacht werden. Die genetischen Marker beschrieben also ein Risikoniveau, auf dessen Basis andere Risikofaktoren zu beurteilen sind. Fazit: Nur ein multifaktorieller Ansatz führt zum Ziel einer validen Risikoprognose.
Eine ausführliche Literaturliste finden Sie hier.
Autor: Dr. Rudolf Raßhofer







