Prophylaxe 16.10.2019
Konsequente Diagnostik – Vermeidung einer Periimplantitis
share
Die Versorgung mit Zahnimplantaten bei Standardindikationen ist durch eine hohe klinische Verlässlichkeit und Vorhersagbarkeit gekennzeichnet. Wichtig ist dabei, dass Risikofaktoren schon präimplantologisch erfasst werden, um im Rahmen der Nachsorge die Entstehung periimplantärer Erkrankungen zu minimieren. Der folgende Beitrag zeigt einen Weg auf, die Periimplantitis frühzeitig zu erkennen, um sie dann minimalinvasiv behandeln zu können.
Sowohl Patienten als auch Behandler schätzen die Möglichkeit, vorhersagbar zahnlose Kieferareale zu versorgen. Hinzu kommen die Entwicklung und Erfahrung mit den unterschiedlichsten Implantatsystemen, die es auch in kompromittierten Situationen erlauben, zu implantieren. Überlebensraten deutlich über 95 Prozent sind nach Datenlage klinisch nach zehn Jahren erreichbar.1,2 Einige Studien deuten allerdings darauf hin, dass bis zu 65 Prozent der Fälle von einer periimplantären Mukositis und 47 Prozent von einer Periimplantitis betroffen sind. Deswegen hat die frühe Therapie der periimplantären Mukositis und damit die Vermeidung der Periimplantitis höchste Priorität.3,4
Biologische Komplikationen an Implantaten lassen sich grundsätzlich in die periimplantäre Mukositis und Periimplantitis einteilen. Die periimplantäre Mukositis wird dabei als Inflammation ohne Knochenverlust/reduziertes Knochenniveau definiert. Die Entzündung betrifft nur die an das Implantat angrenzende Schleimhaut. Die etablierte Periimplantitis ist eine Inflammation, die mit einem Knochenverlust kombiniert ist.
Im Rahmen der EuroPerio9 haben jetzt die American Academy of Periodontology (AAP) sowie die European Federation of Periodontology die Ergebnisse des World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions veröffentlicht. Sie haben nun auch periimplantäre Erkrankungen berücksichtigt und entsprechend der klinischen Phänotypen periimplantäre Gesundheit, periimplantäre Mukositis und Periimplantitis deziediert klassifiziert.
Periimplantäre Erkrankungen ähneln in ihrem Verlauf und ihren Definitionen parodontalen Erkrankungen. Mehrheitlich führt eine bakterielle Erkrankung des Parodonts mit Sondierungstiefen > 5 mm und zunehmendem Knochenverlust letztendlich zum Verlust des Zahns. Bei der Entstehung der Periimplantitis werden ähnliche Verläufe diskutiert. Hinzu kommen weitere Risikofaktoren. Diese reichen vom Fehlen einer Attached/keratinisierten Gingiva und Rauigkeit der Implantatoberfläche bis hin zu parodontalen Vorerkrankungen. Eine positive Raucheranamnese, die Art der prothetischen Versorgung der Implantate und systemische Risikofaktoren können die Gefahr für eine Periimplantitis steigern.
Als hauptsächlicher ätiologischer Faktor für periimplantäre Erkrankungen wird Plaque angegeben. Ähnlich der Gingivitis, welche eine Entzündung der marginalen Mundschleimhaut darstellt, jedoch nicht zwangsläufig in einer Parodontitis enden muss, kann Plaque zu einer periimplantären Mukositis führen. Ebenso werden auch mukositäre Veränderungen nicht immer in eine Periimplantitis übergehen.5 Das Hauptziel in der implantologischen Nachsorge muss sein, die Inflammation und weitere Risiken frühzeitig zu diagnostizieren.
Diagnostik
Für die Diagnostik der periimplantären Mukositis und Periimplantitis ist lediglich eine Parodontalsonde notwendig. Die radiologische Kontrolle kann durchaus mit Einzelzahnfilmen dokumentiert werden. Die Diagnostik sollte vor allem unter dem Aspekt der „Verlaufskontrolle“ stattfinden und sauber dokumentiert sein. Nur so können veränderte Befunde festgestellt werden, um sie dann frühzeitig minimalinvasiv zu therapieren. Als Standardindizien gelten:
- Checkliste „Anamnese“ (in jeder Nachsorgesitzung)
- Gesamtbefundaufnahme (1 x jährlich)
- Anwesenheit von Plaque (in jeder Nachsorgesitzung)
- gingivale Entzündung/Schwellung (visuelle Beurteilung in jeder Nachsorgesitzung)
- Bleeding on Probing (BoP): abhängig vom Risikoprofil (1–2 x jährlich)
- Sondierungstiefe: abhängig vom Risikoprofil (1–2 x jährlich)
- radiologischer Befund (alle 2–3 Jahre)
In jeder Nachsorgesitzung sollte kurz die allgemeine Anamnese abgefragt und Veränderungen dokumentiert werden (vgl. auch Nachsorge-Management nach Monje et al.6). Hierbei sollte das Risikoprofil des Patienten im Sinne der Aktualisierung der dentalen bzw. medizinischen Anamnese überprüft werden, um insbesondere Informationen zur Entwicklung der parodontalen Nachsorge bzw. Stoffwechselerkrankungen (Diabetes mellitus), Medikation und Tabakkonsum zu erhalten.
Eine Gesamtbefundaufnahme mit allen dentalen Parametern (auch Prüfung der Suprakonstruktionen) ist abhängig vom individuellen Patientenrisiko alle 12–15 Monate durchzuführen. Es gibt viele Arten der Dokumentation, ob manuell oder elektronisch. Wichtig ist dabei, dass die Befunde übersichtlich dargestellt und Veränderungen optisch nachvollziehbar sind (z. B. Berner Spinne [Abb. 1], Paro-Status etc.). Weitere Punkte, die hinsichtlich einer Kontrolle der prothetischen Suprakonstruktion im Rahmen der regelmäßigen Nachsorge notwendig sind, umfassen die Kontrolle der Abutmentverbindung auf Mobilität sowie die okklusalen Belastungsverhältnisse.
Die Überprüfung des Plaque-Indexes zeigt vor allem die „Motivation“ des Patienten, wie gut seine häuslichen Mundhygienemaßnahmen sind oder ob weitere motivierende und aufklärende Gespräche geführt werden müssen. Der Index gibt keine Aussage über die „Plaquequalität“. Die visuelle Kontrolle der periimplantären Weichgewebsverhältnisse auf etwaige Rötungen, Schwellungen und Rezessionen muss in jeder Nachsorgesitzung erfolgen.
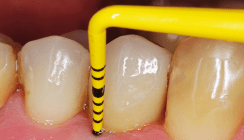
Die regelmäßige Prüfung der periimplantären Sondierungstiefen nach abgeschlossener Einheilungsphase wird empfohlen. Die Gefahr, dass der Sondierungsvorgang die Implantatoberfläche beschädigt, ist nach Lage verschiedener Studien wiederlegt. Demnach kann mit klassischen PA-Sonden (Taschensonden) gearbeitet werden. Das frühzeitige Erkennen einer periimplantären Mukositis ist elementar, da die Übergänge zu einer Periimplantitis fließend sind.7 Neben den Sondierungstiefen ist das BoP ein weiterer wichtiger Befund. Er weist auf erste entzündliche Veränderungen der periimplantären Mukosa hin. Eine zusätzliche Suppuration ist mehrheitlich ein Zeichen für eine vorliegende Periimplantitis.
Den Knochenverlust oder die Umbauprozesse des periimplantären Knochens können nur im Röntgenbild erkannt werden. Allgemein empfohlen ist der Einzelzahnfilm, welcher in Rechtwinkeltechnik aufgenommen wird. Idealerweise mit einer Schablone, um Abweichungen durch unterschiedliche Einstellungen zu minimieren. Um die Umbauprozesse besser beurteilen zu können, wird empfohlen, neben einem Sondierungsbefund zum Zeitpunkt der Eingliederung des Zahnersatzes, auch ein Röntgenbild anzufertigen. Die Ausgangssituation kann so besser mit evtl. im Verlauf auftretendem Resorptionsgeschehen verglichen werden. Nicht jeder Verlust von Knochen um Implantate ist mit einer Periimplantitis gleichzusetzen. Vielmehr können auch physiologische Remodellationsvorgänge nach ZE-Versorgung (Versorgung mit Zahnersatz und Zahnkronen) dazu führen, dass Knochen verloren geht. Diese sind, verglichen mit einer Periimplantitis, nicht entzündlich oder progredient.8
Möglichkeiten prophylaktischer Maßnahmen
Reinigung
Die anschließende Reinigung erfolgt unter dem kombinierten Einsatz von Handinstrumenten (Scaler und Küretten) und maschineller Verfahrensweisen (Ultraschall-/Schallgeräte, Airflow etc.). Die allgemeine Meinung, dass die Ansätze der Ultraschall- und Schallgeräte sowie die Scaler und Küretten aus Kunststoff, Karbon oder Titan bestehen sollten, um empfindliche Implantatoberflächen nicht zu beschädigen, ist nach neuer Datenlage9 nicht mehr haltbar. Vor allem Kunststoff- und Titanküretten sind durch ihre Stabilität häufig nicht geeignet, fest anheftende Auflagerungen zu entfernen.
In einer aktuellen In-vitro-Studie von Schmidt et al. wurden folgende Möglichkeiten der Instrumentierung an Implantatoberflächen getestet10: Stahl-, Titan- und Kunststoffküretten, Ultraschall (Kunststoff- und Stahlspitze), Air-Polishing mit niedrigabrasivem Pulver (Perio-, Soft- und Plus-Pulver), Laser und die Implantoplastik mit einem Diamantschleifer und anschließender Politur. Ein Implantat blieb als Kontrollgruppe uninstrumentiert. Vor und nach der Anwendung der einzelnen Methoden wurden elektronenmikroskopische Aufnahmen mit einer 1.000-fachen Vergrößerung der instrumentierten Implantatoberflächen angefertigt.
Ziel dieser Studie war die Prüfung der Oberfläche nach Instrumentierung im Hinblick auf mögliche Veränderungen und damit eventuell einhergehende veränderte bakterielle Kolonisation. Die Arbeitsgruppe kommt zu dem Ergebnis, dass nahezu alle oben genannten Instrumentierungsformen zu empfehlen sind. Einzig die Stahlkürette hat im Vergleich zu den anderen Methoden eine signifikant höhere Oberflächenrauigkeit erzeugt und sollte deshalb eher nicht verwendet werden. Es konnten aber keine signifikanten Unterschiede im Hinblick auf die Biofilmbildung nach den verschiedenen Instrumentierungen festgestellt werden.
Als Empfehlung kann festgehalten werden, dass das primäre Ziel sein muss, die pathologischen Auflagerungen zu entfernen. Eventuelle „Nebenwirkungen“ müssen im Rahmen der Risikoanalyse entsprechend berücksichtigt und nachversorgt werden. Grundsätzlich bieten maschinelle Verfahrensweisen eine Reihe von Vorteilen, können aber den Einsatz von Handinstrumenten nicht komplett ersetzen.11
Eine Pulver-Wasser-Strahl-Anwendung ergibt häufig Sinn.12 Wichtig dabei ist, dass mit minimalabrasivem Glycinpulver gearbeitet und eine für diesen Einsatzbereich besondere Düse angewandt wird. Sowohl der Einsatz von Handinstrumenten als auch maschinelle Verfahrensweisen erfordern umfassende Kenntnisse der entsprechenden Indikation im Implantatbereich und fundiertes Wissen über Kontraindikationen.
Zusätzliche Maßnahmen
Mit der Reinigung der Zunge, auf der sich eine Vielzahl von Mikroorganismen befinden, wird der Behandlungserfolg positiv unterstützt. Hierbei werden Bakterien entfernt, die zu mehr als 80 Prozent für Mundgeruch und für eine Reinfektion der gereinigten Areale verantwortlich sind.
Neben der physikalisch-mechanischen Entfernung der bakteriellen Biofilme können auch chemische Verfahren wie Spülungen mit Chlorhexidin, Zitronensäure, Wasserstoffperoxid oder Natriumhypochlorit zur Desinfektion der biofilmbesiedelten Implantatoberflächen adjuvant eingesetzt werden. Lokale antimikrobielle Maßnahmen sind insbesondere zur Rezidivprophylaxe der Periimplantitis geeignet.13
Unter den antimikrobiellen Wirkstoffen im supragingivalen Bereich kommt dem Chlorhexidin nach wie vor eine große Bedeutung zu. Es wirkt sowohl gegen grampositive und gramnegative Keime als auch gegen Pilze, Hefen sowie einige Viren. Allerdings sollte es aufgrund der konzentrationsabhängigen Nebenwirkungen wie Verfärbungen, Schleimhautbrennen und Geschmacksirritationen nicht länger als drei
Wochen angewendet werden.
Für die häusliche Mundhygiene können Mundspüllösungen wie Listerine (Johnson & Johnson) oder Meridol (CP GABA) eine positive Ergänzung der manuellen oder maschinellen Reinigung sein. Das gleiche gilt für den Einsatz von Probiotika.
Fazit
Zusammenfassend ist festzuhalten, dass die Prävention grundsätzlich die Voraussetzung für den Langzeiterhalt von Implantaten ist. Liegt bereits eine Periimplantitis vor, ist das therapeutische Spektrum begrenzt und ein Behandlungserfolg nicht voraussagbar. Die Kenntnis individueller Risikofaktoren und eine umfassende Diagnostik geben den Weg des supra- und subgingivalem Biofilmmanagements vor. Eine sorgfältige häusliche Mundhygiene sowie individuelle Nachsorgeintervalle schaffen die Basis für langfristig gesunde intraorale Verhältnisse. Durch die Kombination von professioneller Betreuung und häuslicher Mitarbeit des Patienten können periimplantäre Erkrankungen reduziert oder in einem reversiblen Stadium erkannt und dann minimalinvasiv behandelt werden.
Eine Literaturliste steht hier zum Download bereit.
Der Beitrag ist im Prophylaxe Journal erschienen.
Bitte beachten Sie, dass CME-Tests nach zwei Jahren ihre Gültigkeit verlieren.
Foto Teaserbild: zlikovec – shutterstock.com