Foto: Dr. Kim N. Stolte
Der orale Lichen planus ist eine chronisch-entzündliche, immunvermittelte Erkrankung der Mundschleimhaut, die vor allem Frauen im mittleren Lebensalter betrifft.1 Weltweit schwankt die Prävalenz je nach Region um ein Prozent, in Europa ist die Prävalenz mit 1,43 Prozent eher höher.1, 2 Ab dem 40. Lebensjahr steigt die Erkrankungswahrscheinlichkeit deutlich an.1
Klinisch zeigt der orale Lichen planus ein facettenreiches Bild (Abb. 1a–f). Am häufigsten tritt der retikuläre Subtyp auf.3 Dieser geht mit charakteristischen weißlichen Streifungen einher, die auch als Wickham-Streifung bezeichnet werden.4 Nach der Klassifikation von Andreasen lassen sich noch fünf weitere Typen (papulär, plaqueartig, atrophisch, erosiv/ulzerativ und bullös) unterscheiden.5 Lichen kann auch an anderen Schleimhautoberflächen, z. B. der Genitalregion, oder an der Haut auftreten, hier häufig durch „4P’s“ (pruritic, purple, polygonal papules) beschrieben.6
Die Weltgesundheitsorganisation führt den oralen Lichen planus unter den potenziell malignen Läsionen auf.7 Das Risiko einer malignen Transformation liegt bei 0,44 bis 2,28 Prozent, wobei eine unterschätzte Transformationsrate aufgrund restriktiver Diagnosekriterien, unzureichender Nachbeobachtungszeiträume oder geringer Studienqualität angenommen wird.8–11 Insbesondere bei erosiven Varianten wird ein erhöhtes Transformationspotenzial berichtet.12 Tabak, Alkohol und Hepatitis-C-Infektionen können als Cofaktoren wirken, die das Risiko zusätzlich erhöhen.13
Trotz einer Vielzahl an Studien ist die Ätiologie des oralen Lichen planus bis heute nicht vollständig verstanden. Genetische Prädispositionen, insbesondere bestimmte HLA-Allele, sowie externe Trigger wie psychischer Stress, virale Infektionen, Dysbiosen der oralen Mikroflora und Kontakt zu Amalgam scheinen die initiale Immunreaktion zu begünstigen.14 Pathologisch steht eine T-Zell-vermittelte Autoimmunreaktion im Vordergrund.15 Unterhalb des Epithels findet sich ein bandförmiges Infiltrat von CD4+- und CD8+-T-Zellen, welches, vermutlich über Interferon-γ-dominierte Signalwege, die Apoptose basaler Keratinozyten auslöst.16–18 Neuere Untersuchungen weisen zudem auf eine IL-17-reiche Entzündungsumgebung und eine Überaktivierung des JAK-STAT-Signalweges hin. Diese Aspekte wecken zunehmend therapeutisches Interesse.19–21

Abb. 1a–f: Variable klinische Manifestationen des oralen Lichen planus. Die Wangenschleimhaut ist am häufigsten betroffen (a) und Manifestationen können als unterschiedliche Subtypen auftreten. Der retikuläre Typ (a+b) geht meist mit weniger Beschwerden einher als der erosive Typ (b). Ferner können auch die Zunge (plaqueförmig [c], erosiv [d]) oder die Gingiva (e) betroffen sein. Hautbeteiligungen, wie hier am Unterarm, erscheinen häufig als juckende, polygonale, livide Papeln (f).

Abb. 1b: Variable klinische Manifestationen des oralen Lichen planus. Die Wangenschleimhaut ist am häufigsten betroffen (a) und Manifestationen können als unterschiedliche Subtypen auftreten. Der retikuläre Typ (a+b) geht meist mit weniger Beschwerden einher als der erosive Typ (b). Ferner können auch die Zunge (plaqueförmig [c], erosiv [d]) oder die Gingiva (e) betroffen sein. Hautbeteiligungen, wie hier am Unterarm, erscheinen häufig als juckende, polygonale, livide Papeln (f).

Abb. 1c: Variable klinische Manifestationen des oralen Lichen planus. Die Wangenschleimhaut ist am häufigsten betroffen (a) und Manifestationen können als unterschiedliche Subtypen auftreten. Der retikuläre Typ (a+b) geht meist mit weniger Beschwerden einher als der erosive Typ (b). Ferner können auch die Zunge (plaqueförmig [c], erosiv [d]) oder die Gingiva (e) betroffen sein. Hautbeteiligungen, wie hier am Unterarm, erscheinen häufig als juckende, polygonale, livide Papeln (f).

Abb. 1d Variable klinische Manifestationen des oralen Lichen planus. Die Wangenschleimhaut ist am häufigsten betroffen (a) und Manifestationen können als unterschiedliche Subtypen auftreten. Der retikuläre Typ (a+b) geht meist mit weniger Beschwerden einher als der erosive Typ (b). Ferner können auch die Zunge (plaqueförmig [c], erosiv [d]) oder die Gingiva (e) betroffen sein. Hautbeteiligungen, wie hier am Unterarm, erscheinen häufig als juckende, polygonale, livide Papeln (f).

Abb. 1e: Variable klinische Manifestationen des oralen Lichen planus. Die Wangenschleimhaut ist am häufigsten betroffen (a) und Manifestationen können als unterschiedliche Subtypen auftreten. Der retikuläre Typ (a+b) geht meist mit weniger Beschwerden einher als der erosive Typ (b). Ferner können auch die Zunge (plaqueförmig [c], erosiv [d]) oder die Gingiva (e) betroffen sein. Hautbeteiligungen, wie hier am Unterarm, erscheinen häufig als juckende, polygonale, livide Papeln (f).

Abb. 1f: Variable klinische Manifestationen des oralen Lichen planus. Die Wangenschleimhaut ist am häufigsten betroffen (a) und Manifestationen können als unterschiedliche Subtypen auftreten. Der retikuläre Typ (a+b) geht meist mit weniger Beschwerden einher als der erosive Typ (b). Ferner können auch die Zunge (plaqueförmig [c], erosiv [d]) oder die Gingiva (e) betroffen sein. Hautbeteiligungen, wie hier am Unterarm, erscheinen häufig als juckende, polygonale, livide Papeln (f).

Abb. 2a+b: Histologisches Bild eines oralen Lichen planus. Unter dem mehrschichtigen Plattenepithel findet sich das für den oralen Lichen planus typische, bandförmige, lymphozytäre Infiltrat sowie Apoptosen basaler Keratinozyten. Hämatoxylin-
Eosin-Färbung, Maßstabsbalken 200 µm (a - links) bzw. 100 µm (b - rechts).

Abb. 3a: Relevanz der histopathologischen Diagnostik und des Recalls bei oralem Lichen planus. Die Biopsie ist der Goldstandard zur Diagnostik des oralen Lichen planus. In Studiensettings kann die Entnahme mittels Stanzbiopsie den Vorteil der standardisierten Entnahmegröße bringen

Abb. 3b: Klinische Darstellung eines in der Vergangenheit histologisch gesicherten papulären Lichen, im Rahmen des Recalls entwickelt sich bei dieser Patientin eine High-Grade-Dysplasie.

Abb. 3c: Maligne Transformation der Mundschleimhaut auf dem Boden eines oralen Lichen planus bei einem 32-jährigen Patienten in Regio 37 innerhalb von sechs Monaten.

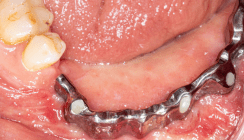
Abb. 4a–f: Gingivale Manifestationen des oralen Lichen planus. Gingivale Manifestationen des OLP können als Gingivitis fehldiagnostiziert werden (a–c), insbesondere, wenn typische Veränderungen an Wangeninnenseiten nur dezent ausgeprägt sind. Die mukoginigvalen Bedingungen zur Implantatpositionierung gelten auch bei Personen mit oralem Lichen planus, das Nichteinhalten, wie unzureichende befestigte Gingiva, führt zur Periimplantitis (d–f). Ferner scheint die Aktivität des oralen Lichen planus zum Zeitpunkt der Implantation für die Prognose entscheidend zu sein.

Abb. 4a–f: Gingivale Manifestationen des oralen Lichen planus. Gingivale Manifestationen des OLP können als Gingivitis fehldiagnostiziert werden (a–c), insbesondere, wenn typische Veränderungen an Wangeninnenseiten nur dezent ausgeprägt sind. Die mukoginigvalen Bedingungen zur Implantatpositionierung gelten auch bei Personen mit oralem Lichen planus, das Nichteinhalten, wie unzureichende befestigte Gingiva, führt zur Periimplantitis (d–f). Ferner scheint die Aktivität des oralen Lichen planus zum Zeitpunkt der Implantation für die Prognose entscheidend zu sein.

Abb. 4a–f: Gingivale Manifestationen des oralen Lichen planus. Gingivale Manifestationen des OLP können als Gingivitis fehldiagnostiziert werden (a–c), insbesondere, wenn typische Veränderungen an Wangeninnenseiten nur dezent ausgeprägt sind. Die mukoginigvalen Bedingungen zur Implantatpositionierung gelten auch bei Personen mit oralem Lichen planus, das Nichteinhalten, wie unzureichende befestigte Gingiva, führt zur Periimplantitis (d–f). Ferner scheint die Aktivität des oralen Lichen planus zum Zeitpunkt der Implantation für die Prognose entscheidend zu sein.

Abb. 4a–f: Gingivale Manifestationen des oralen Lichen planus. Gingivale Manifestationen des OLP können als Gingivitis fehldiagnostiziert werden (a–c), insbesondere, wenn typische Veränderungen an Wangeninnenseiten nur dezent ausgeprägt sind. Die mukoginigvalen Bedingungen zur Implantatpositionierung gelten auch bei Personen mit oralem Lichen planus, das Nichteinhalten, wie unzureichende befestigte Gingiva, führt zur Periimplantitis (d–f). Ferner scheint die Aktivität des oralen Lichen planus zum Zeitpunkt der Implantation für die Prognose entscheidend zu sein.

Abb. 4a–f: Gingivale Manifestationen des oralen Lichen planus. Gingivale Manifestationen des OLP können als Gingivitis fehldiagnostiziert werden (a–c), insbesondere, wenn typische Veränderungen an Wangeninnenseiten nur dezent ausgeprägt sind. Die mukoginigvalen Bedingungen zur Implantatpositionierung gelten auch bei Personen mit oralem Lichen planus, das Nichteinhalten, wie unzureichende befestigte Gingiva, führt zur Periimplantitis (d–f). Ferner scheint die Aktivität des oralen Lichen planus zum Zeitpunkt der Implantation für die Prognose entscheidend zu sein.

Abb. 4a–f: Gingivale Manifestationen des oralen Lichen planus. Gingivale Manifestationen des OLP können als Gingivitis fehldiagnostiziert werden (a–c), insbesondere, wenn typische Veränderungen an Wangeninnenseiten nur dezent ausgeprägt sind. Die mukoginigvalen Bedingungen zur Implantatpositionierung gelten auch bei Personen mit oralem Lichen planus, das Nichteinhalten, wie unzureichende befestigte Gingiva, führt zur Periimplantitis (d–f). Ferner scheint die Aktivität des oralen Lichen planus zum Zeitpunkt der Implantation für die Prognose entscheidend zu sein.
Diagnostik und Verlaufskontrolle: Wann ist chirurgisches Handeln gefordert?
Die gesicherte Diagnose des oralen Lichen planus stützt sich auf die Verbindung aus charakteristischer Klinik (Abb. 1a–f) und histopathologischer Bestätigung (Abb. 2a+b) mittels Biopsie.22, 23 Differenzialdiagnostisch sind vor allem die Leukoplakie, lichenoide Reaktionen durch Medikamente oder Restaurationsmaterialien, Autoimmunerkrankungen wie ein orales Schleimhautpemphigoid, Pemphigus vulgaris oder Lupus erythematodes, sowie Pilz- oder virale Infektionen auszuschließen.22
Der orale Lichen planus tritt häufig multifokal oder großflächig auf, eine vollständige Exzision ist daher häufig nicht möglich, jedoch für die Diagnosesicherung auch nicht obligat. In der Regel genügt eine repräsentative Inzisionsbiopsie (Abb. 3a–c). Bei variabler Manifestation kann die Biopsie in unterschiedlichen Regionen erforderlich sein.
Personen mit oralem Lichen planus sollten aufgrund des beschriebenen Risikos der malignen Transformation lebenslang regelmäßige Kontrolluntersuchungen wahrnehmen, deren Intervall vier Monate nicht überschreiten sollte.24 Ein fehlendes Ansprechen auf Glukokortikoidanwendung erhärtet die Indikation für eine erneute Biopsie, im Vordergrund steht die Vermeidung einer iatrogenen Therapieverzögerung bei etwaiger maligner Transformation zu einem Plattenepithelkarzinom (Abb. 3a–c), da dies die Prognose deutlich reduziert.25, 26 Weiterhin empfiehlt die AWMF-Leitlinie zu Vorläuferläsionen des oralen Plattenepithelkarzinoms für Verlaufskontrollen von Mundschleimhautläsionen, bei denen eine Restunsicherheit bezüglich der Dignität besteht, eine Bürstenzytologie.24 Die Diagnosesicherung ist mit dieser Methodik jedoch nicht möglich, da die zytologische Diagnostik entscheidende Charakteristika des oralen Lichen planus, wie das subepitheliale Entzündungszellinfiltrat, nicht erfassen kann. Auch bei Verdacht einer malignen Transformation soll gemäß Leitlinie eine histologische Klärung erfolgen.24
Lassen sich histologisch Dysplasien bestätigen, können klinisch homogene, histologisch als „low grade“ gewertete Läsionen zunächst beobachtet werden, „high grade“ klassifizierte Läsionen hingegen (Abb. 3a–c) sollen vollständig exzidiert werden.24
„Bei Beschwerden sollte ferner auch eine Candida-Superinfektion in Betracht gezogen werden, die bei Personen mit oralem Lichen planus gehäuft auftritt, und die Symptome des oralen Lichen planus überlagern kann.“
Behandlungskonzepte
Die medikamentöse Behandlung des oralen Lichen planus richtet sich nach dem Schweregrad der Erkrankung. In akuten Schüben gelten topische Kortikosteroide, z. B. auf Triamcinolonacetonid- oder Clobetasolproprionatbasis, als Mittel der Wahl. Systemische Kortikosteroide werden bei schweren Verlaufsformen, die auf die topische Anwendung nicht ansprechen oder bei extraoralen Manifestationen empfohlen und sollten aufgrund der erforderlichen fachärztlichen Expertise durch Dermatologen erfolgen. Die europäische S1-Leitlinie schlägt darüber hinaus Retinoide, Calcineurininhibitoren und Biologika vor und weist auf therapeutische Ansätze, wie Phototherapie, Laserverfahren und die extrakorporale Photochemotherapie hin, was das Fehlen einer suffizienten Standardtherapie unterstreicht (Tab. 1). Neuere Therapieansätze zielen auf die spezifische Unterbrechung der Entzündungskaskade ab, beispielsweise durch die Hemmung von sogenannten Januskinasen, die als zentrale Signaladapter zahlreicher proinflammatorischer Zytokine fungieren und so die IL-23/IL-17-Achse gezielt drosseln.19, 21
Bei Beschwerden sollte ferner auch eine Candida-Super-infektion in Betracht gezogen werden, die bei Personen mit oralem Lichen planus gehäuft auftritt, und die Symptome des oralen Lichen planus überlagern kann.27 Ältere Personen, Personen mit herausnehmbarem Zahnersatz und solche, die rauchen oder glukokortikoidbasierte Dosieraerosole aufgrund chronischer Atemwegserkrankungen einnehmen, haben weiterhin ein erhöhtes Risiko für eine orale Infektion mit Candida. Bei Verdacht auf eine Pilzinfektion sollte daher eine mikrobiologische Testung und gegebenenfalls eine antimykotische Therapie eingeleitet werden.27
Als generelle Maßnahmen werden eine optimale Mundhygiene, der Verzicht auf Tabak und Alkohol sowie das Meiden scharf gewürzter Speisen empfohlen.14 Zugleich sollte auf den möglichen Einfluss von psychischem Stress hingewiesen werden.14
Schließlich darf der Stellenwert der Patientenaufklärung nicht unterschätzt werden. Nur wenn Betroffene über den chronisch-rezidivierenden Verlauf, Reizfaktoren und die derzeit nicht heilbare Natur der Erkrankung informiert sind, können sie realistische Erwartungen entwickeln und lernen, besser mit der Erkrankung umzugehen.
| Empfohlene Interventionen - Topische Steroide (Clobetasolpropionat 0,05 %, Triamcinolon, Betamethason, Fluocinonid, Fluticason, Dexamethason und Prednisolon in verschiedenen Darreichungsformen). Intralesionale Injektionen von Kortikosteroiden (Triamcinolon‑Acetonid, Hydrocortison, Dexamethason und Methylprednisolon) bei ulzerativem OLP.
- Systemische Kortikosteroide (oral): Methylprednisolon oder Prednison (30–80 mg/Tag).
- Systemische Retinoide, z. B. Acitretin (25–50 mg/Tag) anfangs, gefolgt von Isotretinoin (0,5–1 mg/kg/Tag).
- Topische Retinoide (Isotretinoin 0,05–0,1 %) oder andere Vitamin‑A‑Derivate können weiße Läsionen beseitigen.
- Orale Ciclosporine (3–10 mg/kg/Tag).
|
| Weitere vorgeschlagene Interventionen - Topische Calcineurin‑Inhibitoren: Tacrolimus und Pimecrolimus.
- Sulfasalazin (2,5 g/Tag über sechs Wochen).
- Azathioprin (50 mg oral zweimal täglich oder 1–2 mg/kg/Tag über drei bis sieben Monate).
- Hydroxychloroquin‑Sulfat (200–400 mg/Tag für zwei Monate).
- Methotrexat (15 mg/Woche über drei Monate).
- Mycophenolat‑Mofetil (1–3 g/Tag, zwei Einnahmen täglich, über vier Wochen).
- TNF‑γ‑Inhibitoren (Alefacept, Adalimumab, Etanercept); Einsatz möglich, Wirksamkeit unsicher, da Studien mit
großen Patientenkollektiven fehlen. |
| Zu erwägende Interventionen - Cyclophosphamid (100 mg/Tag).
- Thalidomid (Initialdosis 50–100 mg/Tag, anschließend schrittweise Reduktion auf die minimale wirksame Dosis).
- Antibiotische Therapie für ein bis drei Monate (Metronidazol, Trimethoprim‑Sulfamethoxazol, Tetracyclin, Doxycyclin).
- Itraconazol, Griseofulvin.
- Dapson (initial 50 mg/Tag für 15 Tage, anschließend Steigerung auf 100 mg/Tag).
- Niedermolekulares Heparin (Enoxaparin 3 mg/Woche).
- Interferon als Therapieoption bei LP im Zusammenhang mit Hepatitis C.
- Levamisol.
- Lycopin (8 mg/Tag für acht Wochen).
- Portulak (235 mg/Tag).
- Curcuminoide (6 g/Tag in drei geteilten Dosen).
- Aloe vera.
- Topisches Tocopherol.
- Colchicin.
- Intraläsionale BCG‑Injektion (Bacillus Calmette‑Guérin)
- Extrakorporale Photochemotherapie.
- Psoralen plus UVA (PUVA), UVA1, breitbandiges oder schmalbandiges UVB.
- Er:YAG‑Laser (2.940 nm), Diodenlaser (630 nm), CO2‑Laser.
|
Tab. 1: Interventionen zur Behandlung des mukosalen Lichen planus (adaptiert von Ioannides, 2020).Tabelle 1
Parodontale und implantologische Aspekte bei oralem Lichen planus
Während rein gingivale Manifestationen des oralen Lichen planus nicht selten als Gingivitis fehldiagnostiziert werden (Abb. 4a–c),
sehen sich auf der anderen Seite Personen mit bekanntem Lichen mitunter Behandlerunsicherheiten ausgesetzt und Routinemaßnahmen, wie professionelle Zahnreinigungen oder antiinfektiöse Therapien unterbleiben aus Sorge, Befunde möglicherweise zu verschlimmern.
Systematische Übersichtsarbeiten belegen erhöhte Blutungs- und Sondierungswerte bei Personen mit oralem Lichen planus, dies prädisponiert Betroffene für die Entwicklung einer Parodontitis.28, 29 Als Ursache wird häufig die erschwerte Plaquekontrolle bei schmerzhaften Mundschleimhautläsionen angegeben. Der Lichen planus wird in der aktuellen Klassifikation unter den „nicht Plaquenduzierten gingivalen Erkrankungen und Zuständen“ geführt.30 Entsprechend sollte vor weiterführenden Therapien bei Indikation eine konsequente Parodontitisbehandlung mit engmaschiger Prophylaxe etabliert werden.
Hinsichtlich periimplantärer Erkrankungen ist es sinnvoll, mehrere Aspekte zu betrachten (Abb. 4d–f). Eine Metaanalyse fand zwischen Personen mit oralem Lichen planus und Kontrollen weder ein erhöhtes Risiko für periimplantäre Mukositis noch für Periimplantitis.31 Implantatüberlebensraten von 83,5 Prozent auf Patientenebene und 85,3 Prozent auf Implantatebene wurden in einem aktuellen Review bei einem medianen Follow-up von vier Jahren berichtet.32 Jedoch scheint die Krankheitsaktivität zum Zeitpunkt der Implantation entscheidend zu sein. So scheint bei „stabilisiertem“ oralem Lichen planus die Implantatüberlebensrate nicht beeinträchtigt zu sein, wohingegen 42 von 55 Implantationen bei Personen mit „aktivem“ oralen Lichen planus fehlschlugen.33, 34 Der Vollständigkeit halber soll erwähnt werden, dass zu einem späteren Zeitpunkt nach oraler Glukokortikoidgabe und Stabilisierung des oralen Lichen planus erneut implantiert werden konnte. Nach vier Jahren erga-ben sich keine Unterschiede hinsichtlich des marginalen Knochenabbaus zwischen gesunden Kontrollen und „stabilisierten“ Lichen-Patienten. Personen mit initial „aktivem“ Lichen während der Implantation zeigten im Vergleich erhöhten Knochenabbau.35
OLP stellt demnach keine Kontraindikation für Implantationen dar, jedoch sind periimplantäre Komplikationen möglich und eine sorgfältige Beurteilung des Entzündungsstatus sowie regelmäßige Kontrollen entscheidend.
Fazit
Der orale Lichen planus ist eine chronisch-entzündliche, potenziell maligne Erkrankung der Mundschleimhaut mit vielfältigen klinischen Erscheinungsformen. Vor diesem Hintergrund ist es eine unbedingte Voraussetzung, die Erkrankung sicher zu diagnostizieren. Regelmäßige Kontrollen, eine sorgfältige histopathologische Abklärung und ein individuell angepasstes Therapiekonzept sind entscheidend, um maligne Transformationen frühzeitig zu erkennen und Beschwerden zu lindern. Für die Praxis sind ein strukturiertes Recall-System, die interdisziplinäre Zusammenarbeit und eine umfassende Patientenaufklärung zentrale Bestandteile einer erfolgreichen Betreuung.
Literatur

Oralchirurgie Journal
Das Mitgliederorgan des Berufsverbandes Deutscher Oralchirurgen e.V. (BDO) ist das Fachmedium für den Berufsstand. Das Oralchirurgie Journal begleitet Fachzahnärzte für Oralchirurgie und chirurgisch tätige Zahnärzte mit praxisnahen Beiträgen, klinischen Fallberichten und wissenschaftlich fundierten Studien. Viermal im Jahr bündelt es aktuelles Fachwissen und Verbandsinformationen des BDO und bietet damit einen kompakten Überblick über Entwicklungen und Trends im Fachgebiet.
Jetzt das ePaper lesen.