Implantologie 20.10.2016
Barrieremembran – ein urzeitlicher Dinosaurier vom Aussterben bedroht?
share
Der Zahnarzt in Klinik und Praxis wird heutzutage mit einer Vielzahl von Produkten für die Regeneration des Hart- und Weichgewebes konfrontiert. Neben einer Fülle von Knochenersatzmaterialien werden unterschiedlichste Membranen beworben und angeboten. Doch inwieweit sind diese Membranen noch zeitgemäß? Einige von ihnen werden schon über viele Jahrzehnte angeboten, andere sind wieder (erst) seit Kurzem auf dem Dentalmarkt zu finden. Welche sind angestaubte Dinosaurier und welche brandaktuell? Dieser Artikel möchte Ihnen einen Überblick über die unterschiedlichen Membranarten geben und dabei die aktuelle wissenschaftliche Sichtweise näherbringen.
Biophysikalisch betrachtet sind Membranen letztendlich nur eine semipermeable Trennschicht, die zwei Kompartimente abtrennt und nur einen gerichteten Fluss von bestimmten Molekülen zulässt. In diesem Sinne werden Membranen extrakorporal bei der Dialyse in der Inneren Medizin angewendet, um harnpflichtige Substanzen aus dem Blut zu waschen. Der intrakorporale Einsatz erfolgte zunächst experimentell beim Ersatz der menschlichen Blase.1 Im Bereich der Knochen- und Weichgeweberegeneration wurden sie zunächst bei Wirbelsäulenoperationen eingesetzt. Hier wurden Membranen als passive Trennschicht bei Liquorfisteln eingesetzt. Erst relativ spät erfolgte ihr Einsatz im Bereich der Geweberegeneration.
Die ersten Membranen in der Zahnmedizin hatten mit einer biologischen Oberfläche nichts gemeinsam und haben vergleichbare Eigenschaften wie eine Teflonpfanne: Zellen haben keine Möglichkeit, die inerten, nicht resorbierbaren Membranen diesen Typs zu besiedeln. Somit hatten sie die einfache, passive Aufgabe, zwei unterschiedliche Gewebearten voneinander zu trennen. Warum ist dies nötig? Relativ früh wurde erkannt, dass Knochendefekte, sei es durch ein Trauma, nach Zahnextraktion oder durch eine Infektion bedingt, nicht einer „Restitutio ad integrum“, daher einer Ausheilung des Ausgangszustands folgen, sondern bedingt durch das viel schnellere Wachstum der Fibroblasten den gewünschten, aber deutlich langsamer wachsenden Osteoblasten für die Knochenregernation der Platz weggenommen wird.2 Hier greift die älteste Membranart in der Zahnmedizin, die sogenannten Poly-Tetra-Fluoro-Ethylen-(PTFE-)Membranen, kurz Teflonmembranen genannt, ein. Sie sorgen dafür, dass die Fibroblasten nicht in die Regenerationskavität eindringen können und ermöglichen somit eine Besiedlung und Knochenneubildung durch die Osteoblasten.3
Paläontologischer Ansatz oder modernes Membrankonzept?
Betrachtet man das alte Konzept und Aufgabenprofil für Membranen in der Zahnmedizin, so ist dieser relativ einfach und basiert auf der bereits erwähnten strikten Trennung von unterschiedlichen Zelltypen. Jedoch kann man dies nicht für alle Membrantypen verallgemeinern. Neben der passiven Trennungsfunktion setzt sich immer mehr die Überzeugung durch, dass Membranen mehr können und sollen. Konventionelle Kollagenmembranen führen hauptsächlich zu einer passiven Trennung der Gewebe (siehe Abbildung 4). Insbesondere moderne Kollagenmembranen haben die Aufgabe, auch ein gerichtetes Gewebewachstum herbeizuführen (siehe Abbildung 5). Hierdurch soll eine optimale Regeneration des Hart- und Weichgewebes erreicht werden. Jedoch nicht nur das: Auch die Angiogenese rückt in den Fokus der neuen regenerativen Medizin- und Materialforschung. Aus der Erkenntnis, dass ohne Gefäßversorgung keine Regeneration und Wundheilung möglich ist, sind in modernen Kollagenmembranen sogar Poren eingebaut, um eine gezielte Gefäßerschließung der Membran und des Augmentates zu ermöglichen. Somit hat sich das Konzept der passiven Trennung zu einem Konzept der Matrix, daher gerichteten Gewebewachstum durch die Membran gewandelt. Die Abbildungen 6 und 7 stellen die beiden Membrankonzepte gegenüber.
Wie könnte somit der Goldstandard einer modernen Membran aussehen? Die positiven Eigenschaften der Trennung von Osteo- und Fibroblasten sollte auch im modernen Konzept erfüllt sein.4 Des Weiteren ist eine hohe Stabilität der Membran gepaart mit guter Handhabung im trockenen wie feuchten und blutigen Zustand wünschenswert, damit das Augmentat sicher einheilen kann. Hierzu zählt auch eine gute biologische Oberflächeneigenschaft, die auch bei Wunddehiszenzen eine komplikationslose Einheilung ermöglicht. Wünschenswert ist des Weiteren auch die Vermeidung eines zweiten operativen Eingriffes zur Entfernung der eingebrachten Membran. Somit kann eine erneute Traumatisierung des Weichgewebes vermieden werden. Ein klarer Pluspunkt für resorbierbare Membranen. Jedoch ist auch hier das Abbauverhalten der unterschiedlichen Membranarten zu berücksichtigen: Generelle Kautel für den Abbau ist eine schonende Degradation, daher ohne starke Entzündungsreaktionen, die wiederum die Knochenregeneration hemmen oder zu einer Übersäuerung des umliegenden Gewebes führen.5 Auch dürfen die Abbauprodukte keine Haptene enthalten, um das allergische Potenzial der Membran zu minimieren.
Im Weiteren werden die unterschiedlichen Membranfamilien betrachtet und analysiert, inwieweit sie das Konzept der idealisierten Membran erfüllen und welche Kompromisse dabei einzugehen sind.
Vor- und Nachteile nicht resorbierbarer Membranen
PTFE-Membranen stellen die älteste Klasse der nicht resorbierbaren Membranen dar. Sie haben aufgrund ihrer Rigidität einen guten Stabilisierungseffekt für das eingebrachte Knochenaugmentat. Zum Teil wird in den neueren Generationen dieser Membranfamilie ein zusätzlicher Versteifungsgrad durch ein eingewobenes Titanskelett erreicht. Nachteilig erweist sich die Notwendigkeit, die nicht resorbierbare Membran in einem zweiten Operationsschritt zu entfernen. Treten in der Einheilungsphase Wunddehiszenzen auf, so ist im gehäuften Maße das Augmentationsergebnis durch unvollständige Durchbauung des Knochenersatzmaterials gefährdet. Eine sekundäre Wundheilung wird im Gegensatz zu den Kollagenmembranen nur selten beobachtet. Eine noch stärke Stabilisierung des Augmentates kann durch sogenannte Titangitter (engl.: Mesh) erreicht werden. Diese werden zum Teil für den Patienten adaptiert 3-D geplant, konfektioniert und hergestellt. Um eine Trennung von Hart- und Weichgewebe zu erreichen, ist jedoch oftmals der zusätzliche Einsatz einer Kollagenmembran sinnvoll, da das Titanmesh keine Trennschicht auf zellulärer Ebene darstellt. Auch im Fall der Titanmeshes wird oftmals in einer weiteren OP-Sitzung das Titanmesh entfernt und die Implantation durchgeführt.5 Durch den Einsatz von Magnesium- oder Polylaktidverbindungen kann sogar eine Degradation des Mesh erreicht werden. Somit entfällt in diesen Fällen sogar der zweite operative Eingriff zur Entfernung des Stabilisationsgitters.6 Inwieweit eine Wasserstofffreisetzung im Rahmen des Magnesium-Gitterabbaus Einfluss auf die Zellphysiologie und Wundheilung nimmt, bleibt in weiterführenden Studien abzuwarten.
Die Familie der resorbierbaren Membranen
Aus dem Wunsch nach einer mehr biologischen und selbstdegradierenden Membran heraus wurden unterschiedliche Membrantypen entwickelt. Hierbei spielen heute die große Gruppe der Kollagenmembranen eine entscheidende Rolle. Daneben existieren resorbierbare Membranen auf Hyaluronsäurebasis und sogenannte Polyethylenglycol-Membranen (PEG-Membranen).7 Aufgrund des unterschiedlichen Vernetzungsgrades erfolgt der durchschnittliche Abbau in wenigen Wochen bis hin zu sechs Monaten. Ausgangspunkt für die Herstellung von Kollagenmembranen sind unterschiedliche Spezies und Organe. Neben Ausgangsgewebe von Schwein (porcine Produkte, z. B. Bio-Gide®, Ossix®Plus), Rind (bovine Produkte, z. B. BioMend®) und Pferd (equine Produkte, z. B. Parasorb Resodont®) wird auch menschliches Gewebe (allogene Produkte, z. B. AlloDerm®) zur Synthese von Kollagenmembranen verwandt. In der aktuellen Literatur werden neben ethischen Bedenken bezüglich der Herkunft der einzelnen Membranen auch mögliche Risiken diskutiert. Neben einem möglichen allergenen Potenzial durch die Membranproteine wird auch immer wieder die Gefahr einer Virus- oder Prioneninfektion diskutiert.4, 5 Sie erscheint jedoch aufgrund der unterschiedlichen Prozessierungsschritte als vernachlässigbar gering.
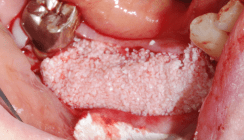
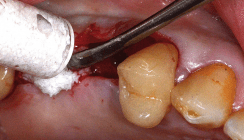
Als Entnahmeorgan für das Kollagen dienen nicht nur die Haut und der Darm. Aufgrund ihres guten Vernetzungsgrades wird auch das Perikard vom Schwein und Rind für die Synthese von Kollagenmembranen verwandt. Eine weitere Vernetzung der Kollagenfibrillen der Membran kann auch in weiteren Prozessierungsschritten erfolgen: Neben einer rein chemischen Vernetzung zum Beispiel mittels Aldehydreaktion, ist auch eine schonende, enzymatische Vernetzung des Ribose tragenden Kollagens möglich. Durch die vernetzten Kollagenmembranen ist das Einsatzspektrum von Kollagenmembranen größer geworden.8 Während unvernetzte Kollagenmembranen nach wenigen Wochen abgebaut sind, erfüllen vernetzte Kollagenmembranen über mehrere Monate ihre Aufgaben. Eine primäre höhere Rigidität in der individuellen Konfektionierung der Membranen am Patienten wird durch eine bessere Stabilität im feuchten und blutigen Zustand wettgemacht. Auch sind vernetzte Kollagenmembranen sehr widerstandsfähig gegenüber Dehiszenzen.9 Selbst primär freiliegende Membrananteile werden durch das Weichgewebe kolonisiert und es erfolgt ein reizloser Wundverschluss. Der erste Patientenfall in den Abbildungen 1–3 zeigt einen Patienten nach Unterkieferkontinuitätsresektion bei Plattenepithelkarzinom mit anschließender Bestrahlung. Zur sekundären Rekonstruktion des Unterkiefers erfolgte die Insertion einer Überbrückungsplatte sowie eines freien Beckenkammtransplantates. Zur Verbesserung der Einheilung wurde das Knochenaugmentat mit einer vernetzten Kollagenmembran umschichtet. Nach sechs Monaten zeigte sich eine reizlose Einheilung des Transplantates.
Untergruppen der Kollagenmembranen, wie zum Beispiel die Mucograft®, besitzen eine bereits makroskopisch sichtbare 3-D-Matrix und eignen sich insbesondere zur Regeneration des Weichgewebes. Sie sind eine ernstzunehmende Alternative für das autogene Bindegewebstransplantat vom harten Gaumen und werden daher insbesondere für Rezessionsdeckungen, Alveolenerhalt vor Implantation (engl.: Socket Preservation) bis hin zu Gewebeersatz bei Zungenlösung oder extraoral als Hautersatz nach oberflächlichen Hauttumoren angewendet.10, 11
Eine weiterer Vertreter von resorbierbaren Membranen sind die sogenannten Polyethylenglycol-Membranen (PEG-Membranen).7 Über einen unterschiedlichen Vernetzungsgrad lässt sich das Abbauverhalten unterschiedlich adjustieren und variiert zwischen einigen Wochen bis Monaten. Interessant ist insbesondere der Ansatz im Zweikomponetensystem. Die zunächst flüssige Membran härtet nach der Applikation auf dem Augmentat aus. Im Handel ist bereits ein erster Vertreter der PEG-Membranen angekommen: MembraGel® (Straumann). Vergleichbare Produkte wie z. B. Flex Barrier (Medical Instinct®) werden auch auf Hyaluronsäurebasis angeboten.
Neue Trends in der Membranforschung
Zur Verbesserung der Regeneration von Hart- und Weichgewebe sowie der Einheilung der Membran ist mit unterschiedlichen Entwicklungen in der Zukunft zu rechnen. Zum einen ist man bemüht, die Eigenschaft der Membranen durch Zytokine und Wachstumsfaktoren zu verbessern. Heute ist es experimentell bereits möglich, diese über Hydroxylgruppen an die Membran zu binden und über einen längeren Zeitraum aus der Membran freisetzen zu lassen. Somit könnte die Membran der Zukunft nicht nur die Osteokonduktivität, daher das gerichtete Knochenwachstum aus dem Augmentatbett fördern, sondern auch osteoinduktive Eigenschaften besitzen. Hierunter wird eine „de novo“-Entstehung von Knochen aus eingewanderten mesenchymalen Stammzellen verstanden. Möglich wäre auch eine gesteigerte Gefäßeinsprossung über eine Gefäßinduktion mittels VEGF oder anderen proangiogenen Zytokinen. Auch der Einbau von bakteriziden Substanzen wie Chitosan wird im Labor bereits erforscht.
Fazit
Membranen und ihre unterschiedlichen Anwendungstechniken in der Zahnmedizin sind auch nach Jahrzehnten der Anwendung noch nicht überholt und vom Aussterben bedroht. Einzelne Membranarten wie die Klasse der PTFE-Membranen haben jedoch sicherlich durch moderne Membrantypen an Bedeutung verloren und werden nur noch für spezielle Fragestellung eingesetzt.
Für die moderne Goldstandard-Membran sind insbesondere die Kriterien der guten Augmentatstabilisierung, gute biologische Erschließung und Degradationsverhalten zu fordern. Wünschenswert ist eine niedrige Fehleranfälligkeit und Versagen bei Wunddehiszenzen. Diese „intelligente Membran“ ist somit nicht nur eine passive Trennschicht, sondern eine aktive 3-D-Matrix.
In Zukunft ist eine fortschreitende Biologisierung der Membranoberfläche zu erwarten. Im Labor sind bereits mit Zytokinen und antimikrobiellen Molekülen beschichtete Membranen Realität. Somit könnten diese Membranen insbesondere im kompromittierten Patienten nach Bestrahlung oder Bisphosphonattherapie zum Einsatz kommen.
Eine ausführliche Literaturliste steht hier zum Download bereit.
Co-Autorin:
Dr. Dr. Christine Moll
Oberärztin der Mund-, Kiefer- und
Gesichtschirurgie
Universitätsklinikum Marburg
Baldingerstraße
35043 Marburg
Tel.: 06421 58-63209
Fax: 06421 58-68990
mollc@med.uni-marburg.de
www.ukgm.de