Implantologie 02.11.2017
Osseointegration von Zirkoniumdioxid- und Titanimplantaten
share
Die dentale Implantologie hat sich als wichtige Behandlungsmethode in der Zahn-, Mund- und Kieferheilkunde etabliert. Die Hauptfunktion der implantologischen Versorgung besteht neben der ästhetischen und funktionellen Rehabilitation vor allem in der Prävention von periimplantärem Knochenabbau als Hauptursache für das Entstehen einer periimplantären Entzündung. Das Implantat vermittelt eine direkte Übertragung der Kaukräfte auf den Kieferknochen und verhindert damit eine weitere Knochenresorption. Das klinische Ziel der Implantatinsertion ist die direkte strukturelle und funktionelle Verbindung zwischen der Implantatoberfläche und dem angrenzenden Knochengewebe (Osseointegration). Der Begriff der Osseointegration wurde von dem schwedischen Orthopäden und Wissenschaftler Per-Ingvar Brånemark geprägt und beschreibt das Einheilverhalten von enossalen Titanimplantaten im Knochen. Die Osseointegration ist definiert als unmittelbare Anlagerung von vitalem Knochengewebe an die Oberfläche eines Implantates ohne lichtmikroskopisch darstellbare bindegewebige Trennschicht und Erhalt dieser Verbindung unter funktioneller Belastung (BRÅNEMARK et al. 1985).
Zielsetzung der vorliegenden Untersuchung
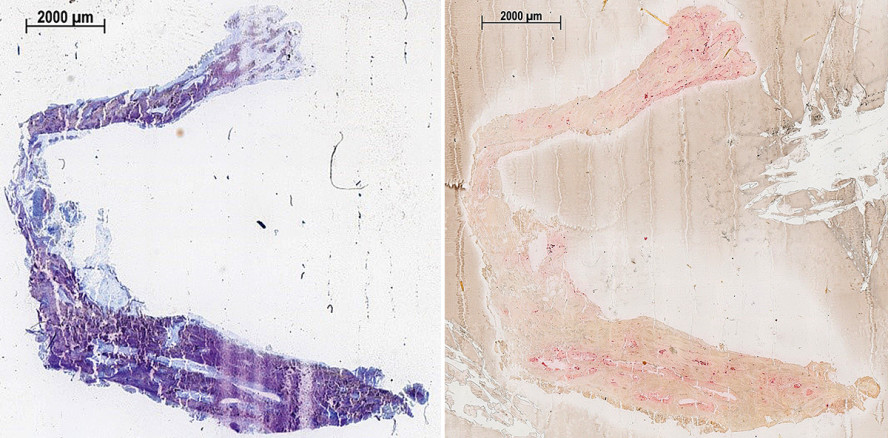
Das Ziel der vorliegenden Schafsstudie bestand darin, das knöcherne Einheilungsverhalten von Zirkoniumdioxidimplantaten mit einer speziellen mikrorauen Oberfläche im UK-Schafs-Modell zu untersuchen. Als Vergleichsproben dienten Titanimplantate mit säuregeätzter Oberfläche (OsteoActive®), die aktuell den „Goldstandard“ im Bereich der dentalen Implantologie darstellen. Durch qualitative histologische und initiale histomorphometrische Analysen wurde das Knochen-Implantat-Interface untersucht. Dabei fanden moderne Methoden der Kunststoffeinbettung der Bioptate (PMMA-Histologie auf der Grundlage der Trenn-Dünnschliff-Technik) Anwendung, die Untersuchungen am nativen Knochen ermöglichten. Für die histologische Begutachtung der Proben wurde die Oberfläche der Präparate mit 1%iger Toluidinblaulösung gefärbt:
- qualitative histologische Beurteilung des Knochen-Implantat-Interfaces
- qualitative Charakterisierung der Knochenregeneration am Knochen-Implantat-Interface durch enzymtechnische Untersuchungen (TRAP-Analysen)
Material und Methoden
Das verwendete Titanimplantat
Aufgrund seiner ausgezeichneten Materialeigenschaften (hohe Biokompatibilität, hohe Korrosionsbeständigkeit) ist reines Titan (Ti) das am häufigsten verwendete Biomaterial für die dentale Implantatherstellung. Die chemischen Eigenschaften am Implantat-Knochen-Interface und auch die hohe Korrosionsbeständigkeit werden nicht vom Ti selbst, sondern von verschiedenen Oxidschichten (TiO2, Ti2O3) bestimmt. Wir verwendeten in unseren experimentellen Versuchen ein Titanimplantatsystem mit optimaler Oberflächenmikrorauheit und Oberflächentopografie. Das K3 Pro-Implantatsystem® von Argon Dental zeichnet sich durch eine bakteriendichte Verbindung auf krestaler und subkrestaler Ebene mit einem geringen Austrittsprofil aus dem Sulkus aus. Das „Rapid“-Schneidgewinde mit einer 0,1%igen Gewindesteigung zur Erhöhung der Primärstabilität verfügt im apikalen Bereich über ein Kompressionsgewinde zur Knochenverdichtung. Dieses Gewindedesign mit der speziellen bewirkt eine schnelle und sichere Einheilung. Die raue Oberflächentopografie, die OsteoActive®-Oberfläche, entsteht durch eine Säureätzung. Dadurch entstehen 2–4 µm große Mikrogrübchen.
Das verwendete keramische Implantatsystem
Die Suche nach biomechanisch stabilen Keramiken führte 1978 zur Einführung von Zirkoniumdioxid als Material für dentale Keramikimplantate. Eine Vielzahl von toxikologischen und histologischen Untersuchungen zeigten, dass Zirkoniumdioxidimplantate sich im Tiermodell ohne bindegewebige Einscheidung knöchern osseointegrieren (Akagawa et al. 1993, 1998, Johansson et al. 1994, Kohal et al. 2004, Scarano et al. 2003). Die verwendeten Keramikimplantate wurden von der Firma Carident AG bereitgestellt.
Qualitative Oberflächenuntersuchungen
Die Analysen wurden mit einem Zeiss EVO MA 15 Rasterelektronenmikroskop (Software SmartSEM V05.04.03.00 16-Apr.-10) im Hochvakuum durchgeführt. REM-Bilder wurden bei 15 kV/30 pA erstellt. Das EDX Scanning wurde bei 17,0–8,0 kcps Eingangssignal am Spektrometereingang durchgeführt. Zur Elementanalyse der Probenoberfläche wurde ein BRUKER X-Flash 5010 EDX Detektor, ausgestattet mit einem Leichtelement-Fenster Typ slew AP3.3, eingesetzt (Software Esprit 1.9 - Quantax 200). Das slew AP3.3.-Fenster ermöglicht eine Detektion von Elementen mit einer Ordnungszahl > = 5 (Bor). Die Oberflächenanalyse ergab chemisch reine Ti- und Zirkoniumdioxidoberflächen.
Das Tiermodell
Für den vorliegenden Tierversuch wurden sechs klinisch gesunde Schafe (Stavropol Sheep) verwendet. Die Tiere waren zum Zeitpunkt der Implantation 18 Monate alt und wiesen ein Körpergewicht zwischen 60 und 67 kg auf. Das Versuchsprotokoll entspricht den Vorgaben der Ethikkommission der Stavropol State Medical University (AZ 98/4, 10/03/2011). Die Tiere waren in geeigneten Stallungen der Außenstelle des Research Institute for Goat and Sheep, Stavropol, untergebracht. Die Tiere wurden circa 24 bis 36 Stunden vor OP bei freiem Zugang zu Trinkwasser gefastet. Die Prämedikation erfolgte mit 0,3 mg/kg Diazepam i.v. und 0,08 mg/kg Butorphanol i.v. Die Narkose wurde mit 4–8 mg/kg Thiopenthal i.v. eingeleitet. Die Narkoseerhaltung erfolgte inhalativ mittels 1,4–2,0 % Isofluran in O2 mit einer Atemfrequenz von 15 bis 20 pro Minute bei einem Atemvolumen von circa 100 ml/kg Körpergewicht. Analgetisch wurden die Schafe mit 0,05 mg/kg Xylazin spinal versorgt. Während der OP erfolgte die Überwachung der Vitalparameter mittels Pulsoxymetrie und der Messung der inneren Körpertemperatur. Die Flüssigkeitssubstitution wurde perioperativ durch 10 ml/kg/h Ringerlaktat i.v. sichergestellt. Kurz vor Ende der OP wurde den Schafen 4 mg/kg Carprofen i.v. verabreicht, welches in den folgenden fünf Tagen je einmal täglich subkutan appliziert wurde. Weiterhin erfolgte die analgetische Abdeckung für drei Tage intramuskulär dreimal täglich. Eine Antibiotikaprophylaxe wurde nicht durchgeführt.
Postoperatives Monitoring der Tiere
Das Allgemeinbefinden der Tiere wurde in der ersten Woche zweimal täglich kontrolliert, nach der ersten Woche dann einmal täglich. Zur qualitativen Beurteilung der Osseointegration wurde der Unterkiefer der Tiere mittels der Computertomografie (CT) radiologisch untersucht. Diese Untersuchung diente außerdem zur Erkennung von eventuellen Komplikationen wie Implantatlockerungen. Nach Versuchsabschluss wurden die Unterkiefersegmente der Schafe histologisch aufgearbeitet. Es erfolgte eine Kunststoffeinbettung und die Anfertigung von Übersichtspräparaten des Defektes. Außerdem erfolgte zur Bewertung der zellulär-periimplantären Knochenregenerationsvorgänge eine TRAP-Analyse.
Studiendesign
Die Verteilung der Implantate erfolgte nach einem randomisierten Grundschema, wobei bei jedem Tier jeweils drei Probekörper aus Titan und drei aus ZrO2 verwendet wurden („Split-Mouth-Design“). Entsprechend dem Versuchsprotokoll wurden insgesamt 36 Implantate (18 x ZrO2, 18 x Ti-OsteoActive®) inseriert, wobei 29 Probekörper für die histologischen Untersuchungen verwendet werden konnten.
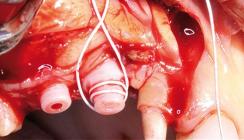
Implantation
In jeden Unterkiefer wurden jeweils sechs Implantate im Split-Mouth-Design eingebracht. Die Wahl der Knochenheilungszeit von sechs Monaten erfolgte analog zu vorangegangenen Studien (Duncan 2005), die diesen Zeitrahmen als ausreichend für eine knöcherne Regeneration der zahnlosen Kieferabschnitte beim Schaf befanden. Die Gingiva befand sich bei jedem Versuchstier in einem entzündungsfreien Zustand. Um direkten Zugang zu den zahnlosen Kieferknochenabschnitten zu erhalten, erfolgte zunächst eine Inzision der Gingiva krestal entlang des Alveolarkamms zwischen dem bezahnten Frontabschnitt und dem ersten Prämolaren mit einem Skalpell und eine stumpfe Präparation eines Mukoperiostlappens, jeweils oral und vestibulär des Schnittes, mit einem Raspatorium. Anschließend wurden die freigelegten Alveolarkämme mit einem Rosenbohrer abgeflacht und es erfolgte die Präparation für die Implantation gemäß Herstellerangaben, analog zum Vorgehen beim Menschen. Alle Bohrungen wurden mit einem chirurgischen Winkelstück bei 500 Umdrehungen pro Minute unter ständiger Spülung mit physiologischer Kochsalzlösung durchgeführt. Die Tiefe der Bohrungen entsprach den Längenverhältnissen der Versuchsimplantate. Anschließend wurden auf jeder Seite des Unterkiefers die Implantate manuell mit einem speziellen Drehmomentschlüssel eingedreht. Die Positionen der einzelnen Implantattypen (ZrO2, Ti-OsteoActive®) variierten bei jedem Schaf und orientierten sich an dem randomisierten Versuchsprotokoll. Der dichte Wundverschluss erfolgte mit resorbierbarem Nahtmaterial. Alle Implantate wurden vollständig mit Gingiva bedeckt und heilten subgingival ein.
Histologische Auswertung
Die histologische Auswertung der periimplantären Knochenneubildung basierte zum einen auf mit Toluidinblau gefärbten Kunststoffschnitten. Zusätzlich wurden noch TRAP-Färbungen vorgenommen, um die zelluläre Knochenneubildung qualitativ bewerten zu können.
Radiologische Untersuchung
Die radiologische Untersuchung erfolgte mit einem Computertomografen. Die Bildsegmentierung wurde mit Osiris, Version 8.0.2, auf die Schafsunterkiefersegmente angewendet. Die Bildsegmentierung wurde mit einem Kontrastbereich durchgeführt, der eine klare Trennung während der 3-D-Rekonstruktion gewährleistete. Die segmentierten Bilder wurden schichtweise nach der Z-Ebene akkumuliert und als 3-D-Bild rekonstruiert.
Ergebnisse Histologische
Untersuchungen
Von den ursprünglich 36 Implantaten, die für die histologischen Untersuchungen vorgesehen waren, gingen sieben Probekörper (5 x ZrO2, 2 x Ti-OsteoActive®) während der Einheilphase verloren. Direkte Knochenanlagerung an die Implantatoberflächen ließ sich sowohl in Bereichen mit trabekulären Knochenanteilen als auch entlang von Zonen, die hauptsächlich aus Knochenmark bestanden, beobachten. Bei mehreren Bioptaten konnten Entzündungszellen direkt auf der Oberfläche der Zirkoniumdioxid-Implantate erkannt werden. Ein physiologischer Knochenumbau um die inserierten Implantate war in beiden Versuchsgruppen in kortikalen Bereichen erkennbar. Dies wird auch durch die parallel angefertigten REM-Untersuchungen bestätigt. Der neu gebildete periimplantäre Knochen ist dicht, und es fanden sich vermehrt Osteone in direkter Umgebung der Implantatoberflächen beider Untersuchungsgruppen.
Die Osseointegration wurde in solchen Fällen als ungenügend bezeichnet, bei denen die Implantatoberfläche nicht von knöchernem Gewebe, sondern von nicht mineralisiertem Bindegewebe umgeben war. Vereinzelt waren in diesen nicht knöchernen Bereichen mononukleäre Zellansammlungen zu beobachten. In diesen Fällen wurde die Verdachtsdiagnose einer entzündlichen periimplantären Reaktion gestellt.
Die Zirkoniumdioxid-Implantate schienen innerhalb des gleichen Versuchstieres eine höhere Anfälligkeit für entzündliche Reaktionen zu haben.
Radiologische Untersuchung
Die computertomographische Untersuchung zeigt die dreidimensionale Darstellung der Implantatlokalisation mit deutlichen Zeichen der Osseointegration.
Diskussion
Versuchsdesign und Methodik
Für die experimentelle Erforschung der Knochenregeneration in der dentalen Implantologie sind Tierversuche unverzichtbar. Damit die dadurch erhaltenen Daten mit hinreichend hoher Wahrscheinlichkeit auf den Menschen übertragbar sind und ein direkter klinischer Bezug unterstellt werden kann, ist die Auswahl eines geeigneten Tiermodells von entscheidender Wichtigkeit. Aus diesem Grund sind bei der Auswahl des Versuchstieres verschiedene Kriterien zu beachten. In-vivo-Tierversuche erfolgten hierfür in den vergangenen Jahren an verschiedenen Tierarten, wobei vorzugsweise auf Beagle-Hunde, Minischweine, Schafe und Ziegen zurückgegriffen wurde (Zarrinkalam et al. 2009, Klein et al. 2013). Günstige Bedingungen für die Testung von Biomaterialien bietet offensichtlich das Schaf (Duncan 2005, 2014). Die der Untersuchung zugrunde liegende Fragestellung sollte kostengünstig und unter genau definierten Laborbedingungen beantwortet werden können. Ebenso sollten die durch die experimentellen Eingriffe hervorgerufenen Reaktionen den klinischen Bedingungen beim Patienten entsprechen. Charakteristische Merkmale wie Größe, Form und Festigkeit des Knochens sind dabei entscheidend. Diese sollten eine analoge Operationstechnik mit den gleichen Instrumenten und Implantaten wie beim Menschen erlauben. Nicht zuletzt sollte das Ausmaß der Knochenregeneration des Versuchstieres derjenigen des Menschen vergleichbar sein. Fraglich ist in diesem Zusammenhang nach wie vor, ob die aus Tierversuchen (vor allem mit Kleintieren) erhaltenen Daten im Rahmen einer Langzeitprognose auf den Menschen sinnvoll übertragbar sind (Wissing et al. 1990).
Bei der Wahl des Tiermodells galt für die vorliegende Studie als entscheidendes Kriterium die Vorgabe, dass der chirurgische Eingriff am Versuchstier, bezüglich Operationstechnik, verwendeter Instrumente und Implantate, analog zum humanchirurgischen Eingriff durchgeführt werden sollte. Aufgrund der Größe bzw. des Gewichtes, der relativ einfachen und kostengünstigen Haltung und der ähnlichen anatomischen und physiologischen Parameter (Breyer 2010) stellte sich das Schaf als das geeignete Tiermodell (Egermann et al. 2005, Stadelmann et al. 2008, Goldhahn et al. 2005, 2008) dar und erfüllte so die meisten Anforderungen, die Wissing et al. (1990) definierten.
Implantatdesign
In der vorliegenden Studie kamen zylindrische und konische Implantate der Firmen Argon Dental und Carident AG zum Einsatz. Die Durchmesser und die Länge der Gewindeanteile entsprachen Standardmaßen und werden in einem großen Indikationsbereich am menschlichen Kiefer verwendet.
Titan als Implantatmaterial
Als Vergleichsproben dienten in der vorliegenden Untersuchung Titanimplantate mit OsteoActive®-Oberfläche. Diese säurebehandelte Oberfläche ist im klinischen Bereich weit verbreitet und wurde in den letzten Jahren in zahlreichen experimentellen Studien in vitro (Boyan et al. 1998, Kieswetter et al. 1996, Martin et al. 1995) und in vivo (Buser et al. 1991, 1998, 1999, 2004, Cochran et al. 1996, 1998, Gahlert et al. 2007, Li et al. 2002) sowie auch in klinischen Studien an Menschen (Bornstein et al. 2003/2005, Cochran et al. 2002, Roccuzzo et al. 2001) ausgiebig untersucht und ermöglichte somit einen aussagekräftigen Vergleich zu den ZrO2-Implantaten.
Zirkoniumdioxid als Implantatmaterial
Als Material für die Keramikimplantate kamen in der vorliegenden Studie Yttrium (Y2O3) stabilisiertes Zirkoniumdioxid zum Einsatz, das alle, die nach ISO-Norm 13356 (2008) geforderten physikalischen und chemischen Eigenschaften für Zirkoniumdioxid als chirurgisches Implantatmaterial erfüllte. Die überlegenen biomechanischen Eigenschaften von Yttrium-stabilisiertem Zirkoniumdioxid werden hauptsächlich bestimmt durch die Stabilisierung der tetragonalen Kristallstruktur bei Raumtemperatur. Einteilige Zahnimplantate aus Zirkoniumdioxid werden schon seit Längerem im klinischen Alltag verwendet, jedoch sind in der Fachliteratur bezüglich der angebotenen Produkte kaum präklinische Grundlagenstudien und klinische Langzeitnachuntersuchungen zu finden. Die bislang publizierten Daten bezüglich der klinischen Erfolgsraten variieren sehr stark und machen eine wissenschaftliche und klinische Einschätzung dieser Systeme äußerst schwierig. Die veröffentlichten Studien berichteten mittlere Implantationszeiten zwischen 8,2 Monaten und 3,4 Jahren bei Überlebensraten von 82,4 Prozent bis 98,6 Prozent. Bei Komplikationen kam es meist zu Frühverlusten, häufig in Kombination mit Knochenaugmentationen und Implantatfrakturen (Gahlert et al. 2012, Lambrich & Iglhaut 2008, Mellinghoff 2006, Oliva et al. 2007, 2010).
Ein wichtiger Vorteil von Zirkoniumdioxid gegenüber Titan ist die geringere bakterielle Adhäsion. Grössner-Schreiber et al. (2001) inkubierten unbehandelte Titanscheiben und Titanscheiben, die mit TiN oder ZrN beschichtet wurden, mit einer Bakteriensuspension aus Streptococcus mutans und Streptococcus sanguis für eine Stunde und zählten anschließend die einzelnen durch adhärierende Bakterien gebildeten Kolonien mittels Fluoreszenzmikroskop. Bei nahezu identischen Werten bezüglich Oberflächenrauheit und Oberflächenenergie fanden diese Autoren eine signifikant geringere Anzahl an adhärierenden Bakterien auf den mit TiN und mit ZrN beschichteten Plättchen. Ähnliche Ergebnisse haben wir in unserer Fo-Gruppe mit einem standardisierten 3-D-Zell-Migrationsmodell gefunden, Ergebnisse unpubliziert. Auch Welander et al. (2008) hatten ähnliche Ergebnisse im Tierversuch.
Die Tatsache, dass einige industrielle Anbieter Zirkoniumdioxid-Implantate ohne dokumentierte präklinische Grundlagenforschungen und ohne dokumentierte Tierversuche kommerziell vertreiben, ist als eher kritisch einzuschätzen. Daher vervollständigen unsere Ergebnisse diese bisher weitgehend fehlenden experimentellen Untersuchungen besonders von zweiteiligen Zirkoniumdioxidimplantaten.
Qualitative Histologie am nicht dekalzifierten Knochen
Da der direkte Knochen-Implantat-Kontakt als der entscheidende Parameter für eine erfolgreiche Osseointegration von Implantaten gilt (Albrektsson et al. 1981, Branemark 1983, Branemark et al. 1969) wurde im Rahmen der histologischen Analyse das Interface zwischen Implantatoberfläche und direkt angrenzendem Knochengewebe untersucht. Durch die Färbung der Präparate mit Toluidinblau und die TRAP-Färbung konnten knöcherne und nicht knöcherne Bereiche eindeutig unterschieden und auch entzündliche Prozesse nachgewiesen werden (Willbold und Witte, 2010, Willbold et al. 2013).
Die qualitative histologische Untersuchung des ossären Integrationsverhaltens der Zirkoniumdioxid-Implantate ergab wenige Unterschiede im Vergleich mit den Ti-OsteoActive®-Implantaten. Es konnte gezeigt werden, dass, bei Insertion der Probekörper in den periimplantären Knochen, es sowohl für Ti-OsteoActive® als auch für ZrO2 zu einer direkten Knochenanlagerung an die Oberfläche der Implantate kam. Somit entsprachen die Ergebnisse der vorliegenden Untersuchung auch den Beobachtungen von bereits durchgeführten Tierstudien, die ebenfalls eine direkte Knochenanlagerung an Zirkoniumdioxid- bzw. Titanprobekörper im Schafsversuch nachweisen konnten (Liu et al. 2015).
Die direkten Anlagerungen waren sowohl in trabekulären Knochenanteilen als auch entlang von Abschnitten, die hauptsächlich aus Knochenmark bestanden, nachweisbar. Die Keramikimplantate wurden vom umliegenden Knochen umschlossen und osseointegriert. Der neu gebildete Knochen in direkter Umgebung beider Implantatgruppen war dicht und es bildeten sich Osteone aus.
Besonders in den TRAP-Präparaten waren verschiedene Entwicklungsstufen der Knochenneubildung zu differenzieren. Man konnte deutlich den schon ausdifferenzierten Knochenbereich und den nach der Implantation neu gebildeten Knochen unterscheiden. Der umliegende Knochen ging mit beiden Implantatgruppen innigen Kontakt ein und bezog das jeweilige Implantatsystem in die Knochenumbauvorgänge mit ein.
In der vorliegenden Studie konnte an verschiedenen Implantaten zellreiches, entzündliches Infiltrat beobachtet werden. Diese entzündlichen Prozesse waren bei Ti-OsteoActive® deutlich geringer ausgeprägt als bei ZrO2. Hier war eine Beeinträchtigung der Knochenanlagerung die Folge. Bezüglich Bone-to-Implant (BIC) sind die Medianwerte der Titanimplantate offensichtlich leicht höher als die Medianwerte der Zirkoniumdioxid-Implantate. Daraus lässt sich schlussfolgern, dass eine gesteigerte Oberflächenmikrorauheit für die Ausbildung der BIC contact-ratio wichtig ist.
Schlussfolgerungen
In der histologischen Untersuchung wurde sowohl für Zirkoniumdioxid als auch für Titan eine direkte Knochenanlagerung an die Oberflächen der Probekörper beobachtet. Eine Zwischenschicht aus lockerem Bindegewebe konnte nicht nachgewiesen werden. Die vorliegenden Ergebnisse unterstützten die Schlussfolgerung, dass Zirkoniumdioxid-Implantate zumindest eine vergleichbare osseointegrative Kapazität besitzen wie Titanimplantate mit säuregeätzter Oberfläche.
Es zeigte sich allerdings auf der Grundlage unserer qualitativen histologischen Analyse, dass Zirkoniumdioxid-Implantate offensichtlich eine stärkere Neigung zur Ausbildung von periimplantären Infekten hatten. Diese Aussage muss allerdings durch die ausstehende histomorphometrische (quantitative) Analyse noch bestätigt werden.
Danksagung
Besonders möchten wir Argon Medical und der Carident AG für die Bereitstellung der Implantatsysteme danken.
Wir danken Herrn Prof. Dr. F. Witte (Berlin) und seinen Mitarbeitern für die Herstellung der histologischen Schnittpräparate.
Zu besonderen Dank verpflichtet sind wir Herrn Prof. Aybazov und seine Mitarbeitern vom Research Institute for Goat and Sheep (Stavropol, Russia) für die Narkoseausführung und die Nachbetreuung unserer Schafe.
Ebenfalls Dank sagen möchten wir Frau Dr. Tebjakina, leitende Röntgenärztin des Zentralkrankenhauses Stavropol für die Durchführung der 3-D-Röntgenaufnahmen.
Die Literaturliste ist beim Autor erhältlich.
Eine gekürzte Fassung des Beitrages ist im Implantologie Journal 11/2017 erschienen.