Implantologie 02.03.2023
Resektive Periimplantitistherapie bei Morbus Crohn
share
Originaltitel „Resektive Periimplantitistherapie mit Implantoplastik bei Morbus Crohn“
Per-Ingvar Brånemark beschrieb 1977 mit Osseointegration eine funktionelle Ankylose von Knochen an Oberflächen von Titanimplantaten.1, 2 Dentale Implantate wurden seitdem stetig weiterentwickelt und bieten Patienten heutzutage in den meisten Fällen eine vorhersagbare Möglichkeit der langfristigen kaufunktinellen Rehabilitation. Trotz hoher Einheilraten von 90 bis 95 Prozent gibt es jedoch Risikofaktoren, die eine periimplantäre Entzündung mit Knochenabbau (Periimplantitis) begünstigen.3, 4 Dieser Beitrag gibt einen Überblick zur Periimplantitis und stellt die resektive Therapie mit Implantoplastik bei einer Patientin mit Morbus Crohn dar.
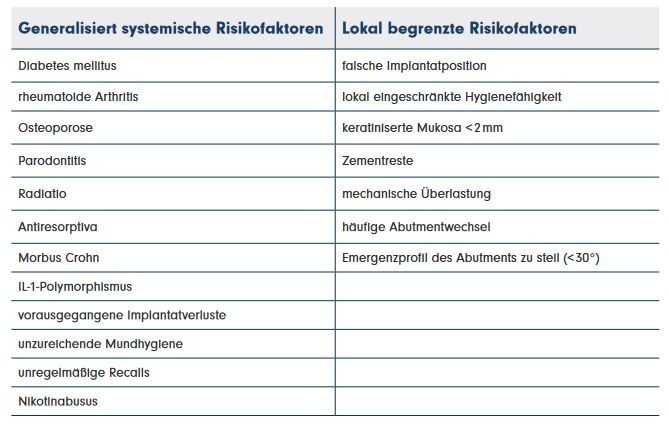
Die Risiken, die zu einem Implantatmisserfolg führen können, sind einteilbar in generalisiert systemische Faktoren und lokal begrenzte Faktoren. Tabelle 1 gibt dazu einen Überblick.
Manche dieser Faktoren sind durch den Patienten zu beeinflussen (z. B. Mundhygiene, Rauchen), andere können durch vorausschauende Therapieplanung vom Behandler vemieden werden (z. B. Zementreste, Implantatposition). Andere wiederum sind nicht zu beeinflussen (z. B. Osteoporose, Diabetes mellitus). Eine valide Therapie, die zur vollständigen Ausheilung des progredienten Knochenabbaus führt, fehlt allerdings bis heute.
Tab. 1: Faktoren, die zur Periimplantitis führen können.
Prävalenz
Insgesamt ist eine beträchtliche Patientenzahl von einer Periimplantitis betroffen.5 Derks et al. geben die Prävalenz von periimplantärer Mukositis und Periimplantitis mit 19 bis 65 Prozent sowie 1 bis 47 Prozent an. Die große Schwankungsbreite in der Literatur ergibt sich aus der hohen Divergenz der zugrunde liegenden Periimplantitis-Definition, die vor allem den Knochenabbau betrifft.6, 7
Ätiologie
Die Periimplantitis wird hauptsächlich durch anaerobe pathogene Keime der Mundhöhle verursacht (z. B. Tannerella forsythia, Prevotella nigrescens, Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Treponema denticola).8–12 Der Titan-affine Staphylococcus aureus scheint ebenfalls bei der Entstehung einer Periimplantitis eine wichtige Rolle zu spielen.13 Histologische Analysen zeigen zudem, dass Leukozyten, B- und T-Zellen deutlich erhöht sind.14, 15
Definition
In Chicago/USA wurde 2017 von Schwarz et al. auf dem „World Workshop“ die Periimplantitis als pathologischer entzündlicher Zustand im periimplantären Weichgewebe definiert, der einen progredienten Knochenabbau induziert.16 „Bleeding on Probing“ wurde als obligater Befund für die Diagnose einer Mukositis festgelegt, wohingegen ein radiologisch nachweisbarer Knochenverlust, in Kombination mit klinischen Entzündungszeichen, für eine Periimplantitis spricht.16–20
Eine unbehandelte Mukositis kann zu einer Periimplantitis exazerbieren.20–22 Diese Abgrenzung ist wichtig, da eine Mukositis durch konsequente Plaque-Entfernung reversibel sein kann, wohingegen eine Periimplantitis nicht zur langfristigen Ausheilung gebracht werden kann. Durch den fortschreitenden Knochenabbau besteht in der Folge das Risiko eines Implantatverlusts.16
Im klinischen Alltag besteht das diagnostische Problem darin, zu entscheiden, bis zu welchem Ausmaß Knochenabbau noch als „Bone Remodeling“ und ab welchem eine Periimplantitis angenommen werden kann. Wenn radiologische Ausgangsaufnahmen nach Implantation fehlen, empfehlen Sanz und Chapell die Diagnose einer Periimplantitis bei 2,0 mm vertikalem Knochenabbau zu stellen. Sind hingegen Ausgangsaufnahmen nach Implantation vorhanden, kann auch ein sensitiverer Wert verwendet werden. Krebs et al. untersuchten verschiedene Periimplantitisdefinitionen. Sie empfehlen bei Vorhandensein von postoperativen Röntgenaufnahmen einen Schwellenwert von 1,5 mm radiologischem Knochenabbau.7
Therapie
Die Periimplantitistherapie unterteilt sich in konservative und chirurgische Ansätze sowie regeneratives oder resektives Vorgehen. Abgeleitet aus der Parodontologie verfolgt sie den Ansatz einer adäquaten Plaquekontrolle.12 Diese Plaquereduktion erfolgt durch Plastik- oder Carbon-Küretten, um die empfindlichen Titanoberflächen nicht durch harte MetallKüretten zu verletzen.23, 24 Weitere Möglichkeiten der Plaquereduktion sind Ultraschall, luftabrasive Geräte, DiodenLaser oder Antiseptika (z. B. Zitronensäure, Chlorhexidin).25–27 Kombiniert werden kann die Therapie mit lokalen oder systemischen Antibiotika.28
Der chirurgische Therapieansatz der Periimplantitis ist dem der offenen Parodontalchirurgie abgleitet.29 Eine schmale Indikationsbreite bilden regenerative Therapieansätze, bei der hauptsächlich dreiwandige Defekte, die ausreichend steil und tief sein müssen, mit Knochenersatzmaterialien gefüllt werden können.30 Der Therapieerfolg dieser regenerativen Maßnahmen wird maßgeblich davon bestimmt, dass eine vollständige Dekontamination der Implantatoberfläche erreicht wurde.
Oft kommt es hingegen zu generalisiertem Knochenabbau mit konsekutiv freiliegenden Implantatwindungen. Hier kann eine „Implantoplastik“ durchgeführt werden. Bei dieser wird die kontaminierte Implantatoberfläche unter Abtragung der freiliegenden Implantatwindungen geglättet (roter Diamant, gelber Diamant, Arkansas-Stein), sodass die erneute Plaqueakkumulation erschwert wird.31
Es ist wichtig, die Implantatoberfläche nicht mit Silikonpolierern („Brownie“, „Greenie“) zu bearbeiten, da Silikonrückstände im periimplantären Weichgewebe nicht biokompatibel sind und zu Fremdkörperreaktionen sowie neuen Entzündungen führen können.32 Freie Titanpartikel verursachen (nach bisherigem Forschungsstand) keine Schäden der Zellaktivität, können aber als ästhetische Kompromittierung zu metallischen Verfärbungen der Weichgewebe führen.33–35
Fallbericht
Eine 61-jährige Patientin wurde in unsere Tagesklinik für MKG-Chirurgie überwiesen und stellte sich mit Beschwerden an Implantaten vor, die 2009 inseriert wurden. Anamnestisch gab die Patientin einen seit der Jugend diagnostizierten Morbus Crohn an, der aktuell gut eingestellt sei. Sie befände sich seit acht Jahren in Remission, eine medikamentöse Therapie erfolge aktuell nicht.
Anamnese
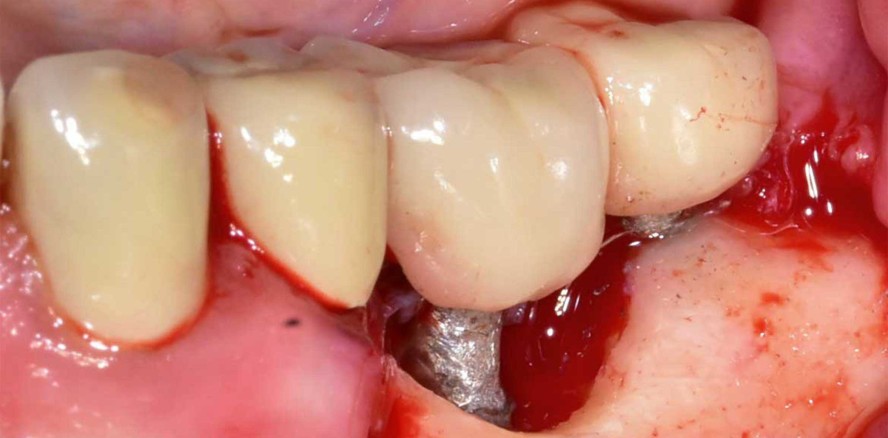
Nach klinischer Inspektion, Befundung und der Erstellung eines OPG wurde die Diagnose Periimplantitis an den verblockten Implantaten 36 und 37 gestellt, da klinisch „Bleeding on Probing“ (BOP) und radiologisch ein Knochenabbau über 2,0 mm vorlag (Abb. 1 und 2). Die Breite der keratinisierten Mukosa betrug am Implantat 36 weniger als 2,0 mm und verlor sich am Implantat 37 komplett. Die umliegende freie Mukosa war reaktiv hyperämisch, mit begleitender ödematöser Schwellung, verändert (Abb. 3).
Befund
Nach klinischer Inspektion, Befundung und der Erstellung eines OPG wurde die Diagnose Periimplantitis an den verblockten Implantaten 36 und 37 gestellt, da klinisch „Bleeding on Probing“ (BOP) und radiologisch ein Knochenabbau über 2,0 mm vorlag (Abb. 1 und 2). Die Breite der keratinisierten Mukosa betrug am Implantat 36 weniger als 2,0 mm und verlor sich am Implantat 37 komplett. Die umliegende freie Mukosa war reaktiv hyperämisch, mit begleitender ödematöser Schwellung, verändert (Abb. 3).
Therapie
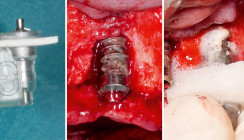
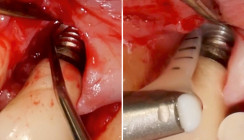
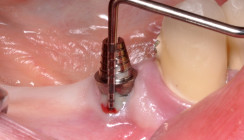
Nach eingehender Beratung und Aufklärung wurde die Patientin zur resektiven Periimplantitistherapie mittels Implantoplastik terminiert. Unter Lokalanästhesie (Articain 1:200.000) erfolgte nach streng marginaler Schnittführung (zum Erhalt der restlichen keratinisierten Mukosa) die Bildung eines Trapezlappens mit distaler Entlastung am Implantat 37 und mesialer Entlastung am Zahn 35 (Abb. 4). Nach mechanischer Dekontamination mittels Kürette wurden die freiliegenden Implantatoberflächen im Sinne einer Implantoplastik modelliert (Abb. 5). Dabei wurden die Implantatgewinde so weit abgetragen, bis eine glatte Implantatoberfläche mit geringerer Gefahr der Plaqueakkumulation und Rekontamination entstand. Bei der Implantoplastik gilt es, lediglich die Implantatwindungen zu ebnen, um nicht den Durchmesser der Implantate zu reduzieren (Frakturgefahr). Zum Abschluss wurde die Oberfläche mit einem Arkansas-Stein poliert. Der Wundverschluss erfolgte mit monofilem Nahtmaterial der Stärke 5/0 (Monofast, mectron) nach gründlicher Spülung mit CHX (Chlorhexamed forte alkoholfrei 0,2 %, GSK) und Kochsalzlösung (Abb. 6).
Nach Instruktion über postoperative Verhaltensmaßnahmen und der analgetischen Therapie (Paracetamol 1 g) erfolgte bei blandem Wundverlauf die Nahtentfernung nach sieben Tagen. Die Patientin wurde an den überweisenden Hauszahnarzt verwiesen, mit dem Hinweis zur Reevaluation und Durchführung einer regelmäßigen Individualprophylaxe nach frühestens sechs Monaten. Weitere Termine in unserer Tagesklinik zur Verbreiterung der keratinisierten Mukosa mittels freiem Schleimhauttransplantat nach Ausheilung wurden geplant. Abbildung 7 zeigt den Zustand 20 Tage postoperativ.
Diskussion
Dieser Fallbericht demonstriert, wie Risikofaktoren (verminderte keratinisierte Mukosa, verblockte Suprakonstruktion, eingeschränkte Hygienefähigkeit, Morbus Crohn) die Entstehung einer Periimplantitis beeinflussen können.
Morbus Crohn (MC) und Colitis ulcerosa (UC) treten in den entwickelten Industrienationen in den letzten Jahrzehnten vermehrt auf, sodass dieses Krankheitsbild für Zahnärztinnen und Zahnärzte an Bedeutung gewinnt. In Deutschland erkranken pro Jahr von 100.000 Einwohnern 322 neu an Morbus Crohn. Der Altersgipfel liegt in der dritten und vierten Lebensdekade, sodass oft augenscheinlich junge gesunde Menschen betroffen sind.36
Morbus Crohn (MC) ist eine entzündliche Darmerkrankung, die durch transmurale Ulcera der Darmwände gekennzeichnet ist. Im Gegensatz zur CU kann MC den gesamten Verdauungstrakt (von der Mundhöhle bis zum After) befallen. In der zahnärztlichen Praxis sollte bei diesen Patienten daher eine genaue Inspektion der Mundschleimhaut erfolgen, um lichenoide/leukoplake Veränderungen, Lippen- und Gingivaschwellungen, Pseudopolypen oder aphthoide/ulzerative Läsionen („Kopfsteinpflasterung“) frühzeitig zu erkennen.37
Die Krankheit verläuft in Schüben und stellt sich in einer Remission völlig symptomfrei dar, während eines Schubs hingegen leiden die Patienten an Bauchkrämpfen, Durchfällen, Gewichtsverlust, Erbrechen und Fieber. Therapiert wird die Erkrankung mit diversen pharmakologischen Arzneien, die nach einem Stufenschema verordnet werden.
In der Anamnese sollte der Zahnarzt daher aufmerksam auf Immunsupressiva (Prednisolon, Mesalazin, Azathioprin, Methotrexat) und Biologika (Infliximab, Adalimumab, Vedolizumab, Ustekinumab) achten und mit dem Wissen über die CED-Erkrankung des Patienten auf nicht steroidale Antirheumatika (Ibuprofen, Aspirin, Diclofenac) verzichten, da diese die Magenschleimhäute reizen und einen Schub induzieren können.
Voina-Tonea et al. ermittelten in einem systematischem Review einen statistisch signifikanten Zusammenhang zwischen Morbus Crohn und Implantatfrühverlusten.36 Gründe für die gestörte Osseointegration werden in der Mangelernährung vermutet und dass autoimmune Inflammationsgeschehen direkten Einfluss auf die Knochenneubildung haben können. Zudem sind mögliche Nebenwirkungen langfristiger Cortisontherapien auf das Implantatüberleben denkbar. Weitere bekannte Nebenwirkungen, die direkt und indirekt das Implantatüberleben beeinflussen können, sind u. a. Hypertonie, Diabetes mellitus, Gastritis Typ C, Osteoporose, Glaukom und ein erhöhtes Infektionsrisiko.
Im oben genannten Review wurden drei retrospektive und eine prospektive Studie ausgewertet, wobei die Studien von van Steenberghe et al. und Alsaadi et al. einschränkend lediglich eine sehr geringe Teilnehmeranzahl von n = 2 und n = 3 aufwiesen.38, 39 Inwieweit der Morbus Crohn im vorliegenden Fall eine konkrete Rolle bei der Entstehung einer Periimplantitis gespielt hat, bleibt hypothetisch, muss aber bei der Therapiefindung berücksichtigt werden. Aufgrund der horizontalen (37) und schüsselförmigen (36) Knochendefektkonfiguration wurde ein regenerativer Therapieansatz als nicht Erfolg versprechend bewertet (Abb. 1 und 5). Flache Knochendefekte bilden äußerst schlechte Voraussetzungen für einen regenerativen Therapieansatz und sind schwierig, langfristig stabil zu augmentieren.40, 41 Um die Periimplantitis, insbesondere im ästhetisch nicht sichtbaren Bereich, zu verlangsamen, wurde ein resektiver Therapieansatz gewählt, der durch die „Planierung“ der Implantatgewinde eine vollständige Dekontamination erleichtert und eine frühzeitige Rekontamination der Implantatoberfläche erschwert.
Um eine regelrechte Implantoplastik durchführen zu können, sollte mit dem Patienten und dem betreuenden Zahnarzt immer diskutiert werden, die Suprakonstruktion für den Eingriff abzunehmen. Es zu belassen, erschwert die Modulation der freiliegenden Implantatgewinde erheblich und schmälert so das Ergebnis. In komplexen Fällen kann es sogar sinnvoll sein, mit Coverscrews die Implantate zu schließen und erneut subgingival nach Knochenaufbau einheilen zu lassen. Im vorliegenden Fallbericht entschied sich die Patientin aus pekuniären Gründen gegen die Entfernung der Suprakonstruktion.
Der klinische und radiologische Erfolg einer Periimplantitistherapie lässt sich erst rückblickend nach mehreren Jahren bewerten, und Patient und Behandler sollten sich bewusst sein, dass der langfristige Implantaterhalt von vielen Faktoren abhängig ist. Da die Periimplantitis ein multifaktorielles Geschehen darstellt, gibt es Faktoren, die weder vom Patienten noch vom Behandler zu beeinflussen sind (Tab. 1) und somit, trotz umfassenden Bemühungen beider Seiten, Implantate als letzte Konsequenz explantiert werden müssen.
Hinweis: Dieser Artikel wurde durch keine externe Quelle finanziert. Die Autoren erklären, in keinen Interessenkonflikten zu stehen. Der hier vorgestellte Patientenfall ist ein aktueller Case Report, bei dem die langfristige Beurteilung (Follow-up) noch aussteht.
Eine Literaturliste ist hier aufrufbar.
Dieser Beitrag ist im IJ Implantologie Journal erschienen.