Implantologie 27.01.2020
Chirurgische Periimplantitistherapie von Implantatoberflächen
share
Kombination mit Air-Polishing und Verbreiterung der keratinisierten Gingiva mit e-CTG
Entzündungsprozesse in der Umgebung von Zahnimplantaten führen zu schwerwiegenden Konsequenzen, die den Verlust des Implantats nach sich ziehen können, wenn sie nicht rechtzeitig behandelt werden. Die beiden folgenden Fallberichte untersuchen die Wirksamkeit einer chirurgischen Behandlung der Implantatoberfläche bei drei Periimplantitisläsionen in Kombination mit Air-Polishing.
Werden Implantate nicht regelmäßig und gründlich gereinigt, kommt es – wie bei den eigenen Zähnen – zu Entzündungen. Die Symptome einer Periimplantitis müssen dabei von der periimplantären Mukositis unterschieden werden. Letztere ist eine reversible Inflammation des das Weichgewebe umgebenden Implantats, deren Symptome Blutung auf Sondieren (BOP) und eine leichte Schwellung des Zahnfleischrands sind.1 Neueren Studien zufolge tritt bei 80 Prozent der beobachteten Patienten eine periimplantäre Mukositis auf.2 Im Gegensatz dazu ist die Periimplantitis eine irreversible Entzündung des Weichgewebes um Zahnimplantate, bei der ein radiologischer Knochenverlust nachweisbar ist (PPD > 4 mm) und in der klinischen Untersuchung Blutungen mit oder ohne Eiterung bei der Sondierung auftreten. Dies betrifft sowohl Weich- als auch Hartgewebe, die das osseointegrierte Zahnimplantat stützen, dies kann zum Verlust des Implantats führen.3 Im Falle der Mobilität von enossealen Implantaten bleibt keine andere Wahl, als dieses zu entfernen, da keine ordnungsgemäße Osseointegration vorliegt.1 Periimplantitis trat bei 28 Prozent und mehr als 56 Prozent der in jüngsten Studien beobachteten Personen auf.2
Abgesehen von den frühen Implantatversagen, die hauptsächlich auf traumatische Operationen, Überhitzung des umgebenden Knochens, unzureichende Primärstabilität oder bakterielle Kontamination während der Operation zurückzuführen sind, gibt es mehrere Ursachen, die zu einer destruktiven periimplantären Entzündung führen können. Mögliche Risikofaktoren sind schlechte individuelle oder professionelle Mundhygiene und Plaquekontrolle, Parodontitis in der Anamnese, eine übermäßige Menge an parodontalen Mikroorganismen, Rauchen, okklusale Überlastung, Diabetes, genetische Merkmale, Alkoholkonsum, Geometrie und Oberflächeneigenschaften der Implantatschrauben sowie das Fehlen von keratinisiertem Zahnfleisch um die Implantate.3–7
Die Behandlung der Periimplantitis kann konservativ und chirurgisch erfolgen. Eine nichtchirurgische Behandlung als ursachenbezogene Therapie kann in moderaten Fällen zu einer Verringerung der Entzündung führen, jedoch auch bei der Vorbereitung chirurgischer Eingriffe wirksam sein.8
Da der wichtigste äthiologische Faktor die Bildung und Reifung von Biofilmen auf der Implantatoberfläche ist, basieren die Behandlungsmethoden für Periimplantitis darauf, diese zu eliminieren. In der Anfangsphase erscheint ein dünnes Häutchen aus Glykoproteinen und Lipiden sowohl auf der Implantatoberfläche als auch auf den umgebenden Zähnen.9 Bei teilbezahnten Patienten wird der ursprüngliche periimplantäre Biofilm innerhalb von 30 Minuten nach dem Einsetzen des enossealen Implantats von grampositiven Kokken und Stäbchen sowie einer geringen Menge von gramnegativen anaeroben Stäbchen besiedelt.9 Bei einer Periimplantitis treten auf der Implantatoberfläche und im umgebenden Gewebe die gleichen Bakterien auf wie bei einer Parodontitis: Porphyromonas gingivalis, Treponema denticola, Tannerella forsythia, Prevotella intermedia, Fusobacterium nucleatum sowie nach früheren Studien Actinomyces actinomycetemcomitans und Candida albicans. Zudem sind enterale Stäbchen und Staphylococcus aureus in der Struktur eines reifen periimplantären Biofilms aggregiert.10–12
Eine ordnungsgemäße Reinigung und Dekontamination von Schraubengewinden ist schwierig zu erreichen. Antimikrobielle Mittel, Ultraschallgeräte, Gracey-Küretten, Er:YAG-Laser- und Air-Polishing-Geräte können mit variabler Wirksamkeit eingesetzt werden.13 Untersuchungen zufolge scheinen Gracey-Stahlküretten und Ultraschallscaler mit universellen Spitzen die Morphologie der Implantatoberfläche zu verändern, indem sie raue Spuren hinterlassen.14, 15 Plastikküretten erreichen nicht die Makro- und Mikroporosität der Implantatfäden, und Ultraschallscaler mit weichen Plastikspit- zen können Kunststoffreste erzeugen, welche die Wundheilung beeinträchtigen können.14, 16
In-vitro-Studien zufolge zeigte das Air-Poli-shing-Gerät signifikant bessere Ergebnisse als Gracey-Kürette oder Ultraschallscaler17, die Ergebnisse wurden auch mit dem Strukturgleichungsmodell (SEM) ausgewertet. Bei der Behandlung mit Glycinpulver zeigten sich keine Oberflächenveränderungen. Auch die Reinigungswirkung war am höchsten, da 95 Prozent der Implantatoberfläche auf diese Weise erreicht wurden.17
Eine angemessene Breite der keratinisierten Gingiva um enosseale Zahnimplantate könnte die Lebensdauer der Implantate verlängern. Gemäß neueren Studien wurde eine negative Korrelation zwischen keratinisierter Schleimhautbreite, Schleimhautrezession und parodontalem Ansatzniveau gefunden.6, 18 Während der chirurgischen Behandlung zeigten autogene Gingivatransplantate, die am Gaumen entnommen und um das Zahnimplantat gelegt wurden, bessere Ergebnisse als die Verwendung eines azellulären Hauttransplantats.18 Das Ziel dieser Studie war es, die klinischen Ergebnisse des Air-Polishings während der chirurgischen Periimplantitistherapie zu bewerten und die Bedeutung der erforderlichen Breite und Dicke der keratinisierten Gingiva um Zahnimplantate zu betonen.
Materialien und Methoden
Zwei gesunde Patientinnen mit drei enossealen Implantaten wurden untersucht. Die klinischen Parameter wie Blutungen auf Sondieren (BOP), Taschensondentiefe (PPD), Gingivarezession (GR) registriert, der klinische Attachmentverlust (CAL) berechnet (CAL = PPD + GR) sowie die Breite und Dicke der bukkalen keratinisierten Gingiva wurden aufgenommen. Diese Parameter wurden zum Zeitpunkt der Operationen und der zwei- und sechsmonatigen Nachoperation an sechs Punkten jedes Implantats in Periocharts registriert.
Beschreibung des klinischen Verfahrens
Die Operationen umfassten die Entfernung von Granulationsgewebe sowie die Konturierung des Zahnfleischs und Knochens. Die Implantatoberflächen wurden mit einem AirPolishing-Gerät mit Kunststoffspitze (Varios Combi Pro, NSK) gereinigt und mit physiologischer Kochsalzlösung gespült. In beiden Fällen war die Breite der keratinisierten Gingiva unzureichend, sodass die bukkalen Oberflächen der Implantate mit epithelisiertem Bindegewebstransplantat bedeckt wurden. In Fall 2 handelte es sich bei der Läsion um einen dreiwandigen intraalveolären Defekt. Daher wurde zur Augmentation ein synthetisches Knochentransplantat (In’Oss Putty, Biomatlante) verwendet. Die klinischen Parameter (BOP, PPD, GR) wurden zum Zeitpunkt der Operationen und der sechsmonatigen Termine nach der Operation registriert. Beide Patientinnen erhielten ein individuelles Mundhygienetraining, das sie auch während der Studie durchführten.
Fall 1
Die 59-jährige Patientin hatte keine systemischen Erkrankungen. Ihre zwei problematischen Zahnimplantate befanden sich in der linken Unterkieferregion, Position 34 und 36. Während der ersten Untersuchung mit einer Parodontalsonde floss eine übermäßige Menge eitriger Exsudation aus dem Gingivasulkus. Die durchschnittlichen Taschentiefen (PPD) betrugen am Implantat 34 auf bukkaler Seite 4,67 mm und auf lingualer 3,00 mm, an Implantat 36 auf bukkaler Seite 4,67 mm und auf lingualer 2,33 mm. An der bukkalen Seite der Implantate befand sich zudem keine keratinisierte Gingiva, sondern nur die freie Alveolarschleimhaut. Die professionelle Mundhygienebehandlung und das individuelle Training wurden aufrechterhalten. Zudem wurde empfohlen, zweimal täglich mit 0,2-prozentiger Chlorhexidindigluconat-Lösung zu spülen.
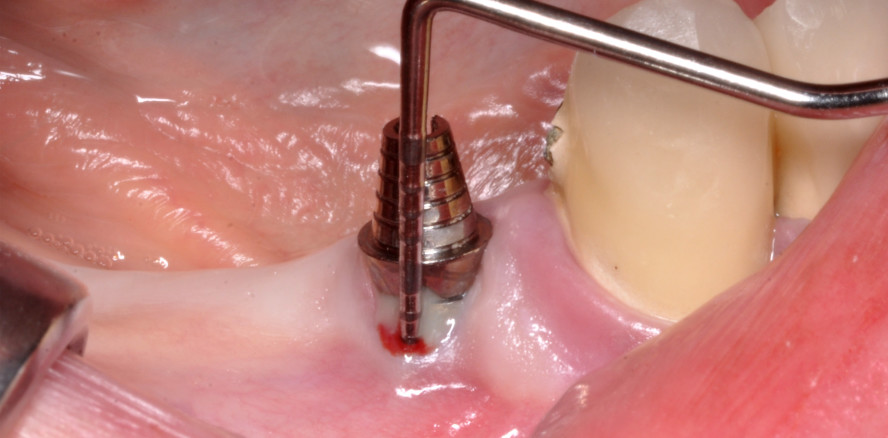
Die Operation wurde unter örtlicher Betäubung durchgeführt. Ein Lappen mit voller Dicke wurde hergestellt und nach dem Anheben des Periosts alle Granulationsgewebe entfernt, der umgebende Knochen war leicht konturiert. Die oberen Gewinde der Implantatschraube waren mit Zahnstein und Plaque bedeckt. Diese wurden mit einem Air-Polishing-Gerät (Varios Combi Pro, NSK) unter Verwendung von Perio-Mate-Pulver (NSK, Pulver auf Glycinbasis) und Kunststoffspitzen im Ultraschallmodus vorsichtig entfernt. Der Bereich wurde gründlich mit physiologischer Kochsalzlösung gespült. Nach dem Reinigen wurde ein epithelisiertes Bindegewebstransplantat (e-CTG) aus dem Gaumen entnommen und auf der bukkalen Seite beider Implantate über dem Periost platziert (Abb. 1a bis f). Die Nähte wurden in zwei Schichten hergestellt: Periost- und Schleimhautstiche. Während der zweiwöchigen Heilungsperiode wurde der Patient an jedem zweiten Tag kontrolliert, der OP-Bereich wurde bei jedem Termin mit 3-prozentiger Wasserstoffperoxidlösung gereinigt. Das Zähneputzen in diesem Bereich wurde untersagt, es wurde empfohlen, mit 0,2-prozentiger Chlorhexidindigluconat-Lösung zu spülen. Nach zwei Wochen wurden die Nähte entfernt.
Fall 2
Die 65-jährige Patientin hatte keine systemischen Erkrankungen. Das behandelte Zahnimplantat befand sich in der rechten Unterkieferregion, Position 43. Auf dem Röntgenbild war ein untertassenförmiger Knochenverlust nachweisbar. Während der klinischen Untersuchung traten Blutungen und Eiterungen beim Sondieren auf. Es wurden durchschnittliche PPDs von 5,33 mm bukkal und 2,00 mm lingual gemessen. Es gab nur freie Alveolarschleimhaut, welche die Schraube von bukkal bedeckte.
Die Mundhygiene und chirurgische Behandlung erfolgten mit den gleichen Materialien und der gleichen Methode wie in Fall 1, aber zusätzlich wurde ein synthetisches Knochentransplantat (In’Oss Putty, Biomatlante) verwendet, um den bukkalen dreiwandigen Knocheninnendefekt zu füllen sowie die Knochenregeneration durch Stabilisierung des Koagulates zu verbessern. Der höchste PPD-Wert wurde auf mediobukkalen Seite des Implantats registriert, PPD = 7 mm (Abb. 2a bis f).
Ergebnisse
Während des Heilungsprozesses wurden die behandelten Bereiche jeden zweiten Tag kontrolliert, dies beinhaltete auch eine sanfte Reinigung mit 3-prozentiger Wasserstoffperoxidlösung. Die Nähte wurden nach zwei Wochen entfernt. Die e-CTG-Transplantate wurden in beiden Fällen (Fall 1 und 2) inkorporiert und die klinischen Parameter nach einer zweimonatigen Heilungsperiode erneut gemessen.
Fall 1
BOP und Eiterung gingen zu 100 Prozent zurück. Bei Implantat 34 betrug die durchschnittliche PPD-Reduktion 1,00 mm (von 3,00 mm auf 2,00 mm) auf der lingualen Seite und 2,67 mm (von 4,67 mm auf 2,00 mm) auf der bukkalen. Bei Implantat 36 betrug die durchschnittliche PPD-Reduktion 0,3 mm (von 2,33 mm auf 2,00 mm) lingual und 3,00 mm (von 4,67 mm auf 1,67 mm) bukkal. Die mittlere CAL verringerte sich bei Implantat 34 lingual auf 1,00 mm (von 3,00 mm auf 2,00 mm) und bukkal auf 2,33 mm (von 6,33 mm auf 4,00 mm). Bei Implantat 36 ging der mittlere CAL auf 0,00 mm (2,33 mm) ligunal und 2,67 mm (5,67 mm bis 3,00 mm) bukkal zurück. Tabelle 1 (Seite 20) zeigt eine Übersicht der Werte. Bei der Messung der höchsten PPD-Werte betrug die Reduktion der Sondierungstiefe bei beiden Implantaten 3 mm. Bei der sechsmonatigen postoperativen Kontrolle erhöhte sich die Breite der keratinisierten Gingiva im Ansatz auf 1 mm. (Abb. 3a und b).
Fall 2
Die BOP zeigte eine Reduktion von 83 Prozent, die Eiterung verschwand. Der durchschnittliche PPD-Rückgang betrug 0,00 mm (2,00 mm) auf der lingualen Seite und 3,00 mm (von 5,33 mm bis 2,33 mm) auf der bukkalen. Die mittleren CAL-Werte stiegen lingual um 1,00 mm (von 2,00 mm auf 3,00 mm) und sanken bukkal um 2,00 mm (von 6,33 mm auf 4,33 mm). Unter Berücksichtigung des höchsten PPD-Werts betrug die Verringerung der Sondierungstiefe 4,00 mm (Abb. 4a und b). Die Breite der keratinisierten Gingiva vergrößerte sich auf 3 mm (Abb. 5a bis d).
In beiden Fällen sind aufgrund der leichten gingivalen Rezession als Nebenwirkung nicht nur PPD-, sondern auch CAL-Werte aussagekräftig. Der Zahnfleischrand und die Sondierungstiefen werden voraussichtlich innerhalb von zwölf Monaten nach der Nachuntersuchung ihre endgültige Form und endgültigen Werte erreichen.
Diskussion
Beide Fälle zeigten eine ordnungsgemäße Wundheilung, die klinischen Symptome einer Periimplantitis verschwanden innerhalb der sechsmonatigen Heilungsperiode. Klinische Parameter werden nach zwölfmonatigen Kontrollterminen erneut erhoben. Das verwendete Air-Polishing-Gerät hat sich als effektive Methode zur Entfernung von sub- und supragingivalen Biofilmen von Implantatoberflächen erwiesen. Jüngsten Studien zufolge ist bekannt, dass die Verwendung von Glycinpulver die Implantatoberfläche weniger belastet als Natriumbicarbonatpulver.19 Die platzierten autogenen epithelisierten Bindegewebstransplantate scheinen dabei zu helfen, ein gesundes und entzündungsfreies Umfeld für Periimplantate zu erhalten. In diesen beiden vorgestellten Fällen erwies sich die Air-Polishing-Methode mit offenem Lappenzugang in Kombination mit der Verbreiterung der keratinisierten Gingiva als wirksam bei der Behandlung der Periimplantitis.
Interessenskonflikt
Die Autoren erklären, dass kein Interessenkonflikt bezüglich der Veröffentlichung dieses Papiers besteht. Die Fallberichte wurden vor regionalen und institutionellen ungarischen Ethikkommitees für Wissenschaft und Forschung geprüft sowie vom ungarischen Office of Health Authorization and Administrativ Procedures genehmigt und gemäß der Erklärung von Helsinki durchgeführt.
Die Literaturliste gibt es hier.
Weitere Autoren: Dr. Orsolya Németh, Dr. Márton Kivovics
Der Fachbeitrag ist in der ZWP spezial erschienen.
Foto: Autoren