Laserzahnmedizin 24.06.2014
Schlüsselfaktor Er:YAG-Laser bei periimplantären Entzündungen
share
Dentale Implantate sind heute eine von den Patienten weithin akzeptierte und gewünschte Therapie zur Restauration teilbezahnter und unbezahnter Kieferabschnitte. Damit wird diese Therapieoption immer öfter im zahnärztlichen Behandlungsalltag umgesetzt. Als Folge dieser Entwicklung wird aber auch die Häufigkeit der Periimplantitis, d.h. der Infektion des periimplantären Gewebeareals, mehr und mehr steigen. Damit ist klar, dass periimplantäre Erkrankungen den praktizierenden Zahnarzt künftig in zunehmendem Maße beschäftigen werden.
Die Voraussetzung für die Entwicklung geeigneter Protokolle zur Prävention und Therapie der periimplantären Erkrankungen ist selbstverständlich eine umfassende Kenntnis ihrer Ätiologie, Pathogenese und Epidemiologie. Der Großteil der frühen klinischen Studien beurteilte die Qualität des Behandlungsergebnisses anhand der Überlebensraten, also des physischen Verbleibens des Implantats in der Mundhöhle. Anfänglich führten die Autoren Implantatverluste eher auf mechanische Zwischenfälle als auf biologische Ursachen zurück. Heute rückt die Bedeutung des Gesundheitsstatus der periimplantären Gewebe für das Implantatüberleben zunehmend in den Blickpunkt. Auch wenn die Implantatbehandlung generell als höchst erfolgreich gilt, treten häufig periimplantäre Infektionen auf, die als periimplantäre Mukositis und Periimplantitis bezeichnet werden. Dabei handelt es sich ebenso wie bei den parodontalen Erkrankungen um entzündliche Krankheiten infektiösen Ursprungs, die schließlich zum Verlust des stützenden Knochens am Implantat führen. Bei der periimplantären Mukositis ist die Entzündung definitionsgemäß auf die periimplantäre Mukosa begrenzt, während sie bei der Periimplantitis auch den periimplantären Knochen einbezieht. Für positive Langzeitergebnisse von Implantaten sowie zur Prävention und Behandlung von oralen Infektionen müssen diese Krankheiten kontrolliert werden.
Die verfügbaren epidemiologischen Daten legen nahe, dass einer von fünf Patienten im Laufe der Zeit eine Periimplantitis entwickeln wird und dass Patienten mit Implantaten grundsätzlich oft eine periimplantäre Mukositis aufweisen. Derzeit gibt es nur begrenzte wissenschaftliche Daten zur Behandlung periimplantärer Erkrankungen. Die meisten Behandlungsverfahren orientieren sich an der Parodontitistherapie. Das wichtigste therapeutische Ziel ist die Infektionskontrolle. Hierzu kann auch eine Anpassung des Zahnersatzes gehören, wenn dessen Form eine adäquate häusliche Mundhygiene und die professionelle Reinigung der Implantatoberfläche von Biofilm und Kalkablagerungen behindert. Bei fortgeschrittener Periimplantitis kann ein chirurgisches Vorgehen indiziert sein, um den Biofilm zu beseitigen. Im Rahmen solcher chirurgischen Eingriffe kann gegebenenfalls auch eine regenerative Behandlung erfolgen, um verlorenen Knochen zu ersetzen. Noch basieren die therapeutischen Interventionen bei der Periimplantitis überwiegend auf klinischer Erfahrung, da zuverlässige klinische Daten in vielen Bereichen fehlen. Allerdings ist die Forschungsaktivität auf diesem Gebiet gegenwärtig hoch und kontinuierlich werden neue Daten gewonnen, sodass zukünftig mit klareren Richtlinien für die Behandlung dieser Krankheiten zu rechnen ist.1 Für die Prävention von periimplantärer Mukositis und Periimplantitis sind die Frühdiagnostik mit einer Parodontalsonde und die Evaluation des Gesundheitsstatus der periimplantären Gewebe essenziell. Eine frühe Diagnosestellung ermöglicht eine frühe Intervention, die dann klinisch effektiv sein kann. Werden jedoch die Frühzeichen verkannt, ist eine komplexere Therapie erforderlich, deren Ergebnisse dann weniger vorhersagbar sind.
Ätiologie und Pathogenese
Dass die Anwesenheit von Mikroorganismen für die Entwicklung periimplantärer Infektionen eine essenzielle Voraussetzung darstellt, ist in der Literatur gut belegt. Heute weiß man, dass gleich nachdem ein Implantat gesetzt worden ist, sich Glykoproteine aus dem Speichel an die zur Mundhöhle hin exponierten Titanoberflächen der Implantate oder Abutments anlagern. Diese Glykoproteinschicht wird dann von Mikroorganismen kolonisiert. Kurze Zeit nach der Implantation bildet sich so eine subgingivale Mikroflora, in der Peptostreptococcus micros, Fusobacterium nucleatum und Prevotella intermedia dominieren. Periimplantäre Erkrankungen sind durch eine überwiegend gramnegative, anaerobe Mikroflora gekennzeichnet, wie sie in ähnlicher Form bei Parodontitis zu beobachten ist. Für die Periimplantitis wurden hohe Konzentrationen parodontalpathogener Keime, wie Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythia und Treponema denticola nachgewiesen. Ferner legen Studien nahe, dass die Mikroflora bei periimplantären Erkrankungen oft auch Fusobacterium nucleatum und Actinomyces-Spezies sowie Staphylococcus aureus und Enterokokken enthält. Staphylococcus aureus besiedelt auch andere Fremdkörper und führt beispielsweise auch an Hüfttransplantaten zu Komplikationen. Titan scheint die Ansiedlung von S. aureus zu begünstigen, der sich häufig auch an dentalen Implantaten findet.1 Die Weichgewebemanschette am Implantat setzt sich zusammen aus einer epithelialen und einer bindegewebigen Anheftung. Die epitheliale periimplantäre Mukosa, bestehend aus oralem Gingivaepithel, oralem Sulkusepithel und nicht keratinisiertem Saumepithel, entspricht weitgehend dem epithelialen Zahn-Mukosa-Kontakt. Die bindegewebige Anheftung an das Implantat erfolgt über in den marginalen Knochen inserierende Faserbündel, welche sich implantatnah, parallel und zirkulär zu dessen Oberfläche anordnen. Das supraalveoläre Bindegewebe ist im Unterschied zu dem den Zahn umgebenden Bindegewebe sowohl zell- als auch gefäßarm. Dies führt zu verminderten Abwehr mechanismen gegen bakterielle Einflüsse am Implantat. Periimplantäre Entzündungen können sich folglich schneller ausbreiten als vergleichbare Entzündungen des parodontalen Halteapparats. Fehlende Desmodontalstrukturen beschränken die Abwehrfähigkeit des Wirtsorganismus einzig auf die Gefäßproliferation innerhalb der marginalen Weichgewebsmanschette, was zu einer gesteigerten Ausprägung der klinischen Entzündungszeichen der marginalen Weichgewebe führt. Wahrscheinlich besteht ein Zusammenhang zwischen der zum Zeitpunkt der Implantation in der Mundhöhle vorhandenen Mikroflora und dem sich auf Implantaten entwickelnden Biofilm. In diesem Sinne können beim Teilbezahnten parodontale Taschen an natürlichen Zähnen als Reservoir für Mikroorganismen fungieren, die dann die neu gesetzten Implantate besiedeln.
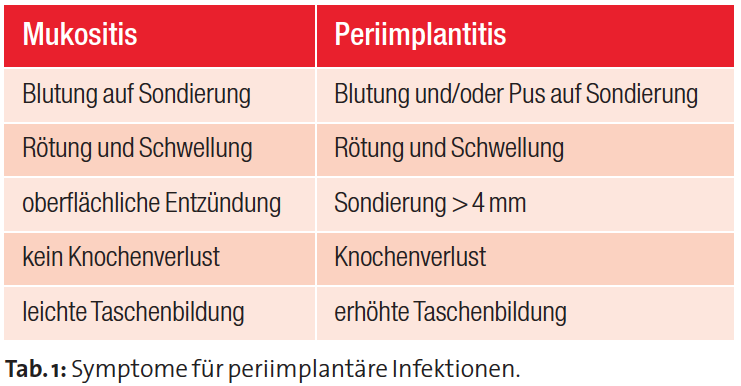
Die Periimplantitis: Eine durch Infektion verursachte entzündliche Erkrankung (Tab. 1)
- Die Implantate werden nach dem Inserieren oder nach der Freilegung bei zweizeitigem Vorgehen sehr rasch von oralen Mikroorganismen kolonisiert.
- Die Implantate werden von einer ähnlichen Mikroflora besiedelt wie die natürlichen Zähne.
- Parodontal erkrankte Zähne können als Reservoir für pathogene Mikroorganismen fungieren.
- Parodontal erkrankte Zähne sollten unbedingt vor einer Implantation behandelt werden.
- Aufgrund der möglichen Übersiedlung der pathogenen Mikroflora aus parodontalen Läsionen auf neu gesetzte Implantate ist eine Implantation bei einer aktiven Parodontalerkrankung kontraindiziert.
Die periimplantäre Mukosa um Titanimplantate hat viele Gemeinsamkeiten mit den gingivalen Geweben um natürliche Zähne. Wie die Gingiva bildet auch die periimplantäre Mukosa eine manschettenartige Barriere, die an der Oberfläche des Titanabutments anhaftet. Die periimplantäre Mukosa ist ein keratinisiertes orales Epithel, dessen Kollagenfasern auf Höhe des krestalen Knochens beginnen und parallel zur Implantatoberfläche verlaufen. Genau wie an natürlichen Zähnen verursacht die Akkumulation bakterieller Plaque in Kontakt mit der periimplantären Mukosa eine Entzündung und vergrößert die Sondierungstiefe. Nach längerem Kontakt mit dentaler Plaque weitet sich die periimplantäre Läsion nach apikal aus, ohne von Kollagenfasern eingekapselt zu sein, wie dies bei der Parodontitis der Fall ist.
Das entzündliche Infiltrat kann sich bei der Periimplantitis in die Tiefe bis an den Alveolarknochen, unter Umständen sogar bis in die Markräume ausdehnen, während es bei Parodontitis durch einen etwa 1 mm breiten, nicht entzündeten Bindegewebssaum vom Knochen getrennt bleibt. Das könnte auch das unterschiedliche Ausmaß und die Konfiguration der Knochendefekte bei periimplantären Entzündungen erklären.
Diagnostik mit zahnärztlicher Sonde und Röntgenbild
Die Sondierungsblutung als dasjenige klinische Zeichen, das eine Mukositis bestätigt, betrifft bis zu 90 Prozent der Implantate in Funktion. Die Definition von Periimplantitis ist leider nicht immer dieselbe. In der Literatur wird der Begriff Periimplantitis noch recht uneinheitlich gebraucht. Auf einer aktuellen Konsensuskonferenz kam man überein, dass die Definition der Periimplantitis als entzündliche Läsion, die zum Knochenverlust führt, akzeptabel ist, dass die diagnostischen Kriterien jedoch alles andere als eindeutig sind. So sollte beispielsweise berücksichtigt werden, dass es während der Einheilung von Implantaten zu einer Knochenremodellierung kommt, wobei der am weitesten koronal gelegene periimplantäre Knochen verloren gehen kann. Dieser physiologische Umbau dauert bis zu einem Jahr und ist nicht als pathologischer Vorgang zu betrachten. Aus klinischer Sicht sollte das Knochenniveau zum Zeitpunkt der prothetischen Versorgung als Referenzwert für spätere radiologische Veränderungen der Knochenhöhe festgelegt werden. Erst zu diesem Zeitpunkt sollte das Referenzröntgenbild angefertigt werden, das dann zur vergleichenden Bewertung des periimplantären Knochenverlustes dient. Zu beachten ist, dass selbst unter optimalen Bedingungen Messfehler möglich sind:
Bei Doppelmessungen wurde ein Messfehler von etwa 0,5 mm beschrieben. Bei radiologischem Knochenverlust von 2 mm gegenüber den Ausgangswerten in Kombination mit Blutung und/oder Pusaustritt beim Sondieren ist die Diagnose einer Periimplantitis gerechtfertigt. Bei sofort belasteten Implantaten ist eine Röntgenaufnahme nach einjähriger Belastung als Referenz für spätere Röntgenbilder geeignet.1
Periimplantäre Mukositis und Periimplantitis: Häufige Komplikationen bei Implantatpatienten Die periimplantäre Mukositits wird beschrieben als das Vorhandensein einer reversiblen entzündlichen Reaktion in der periimplantären Mukosa, ohne Anzeichen von periimplantärem Knochenverlust, vergleichbar mit der Gingivitis. Periimplantitis wird beschrieben als das weitere Fortschreiten der Plaqueakkumulation und damit das Übergreifen der bakteriellen Entzündung auf den periimplantären Knochen, gekennzeichnet durch entzündlich bedingte Knochendestruktion. Sie wird als Pendant zur Parodontitis gesehen.
- Etwa vier von fünf Implantatpatienten haben eine periimplantäre Mukositis.
- Nach zehn Jahren entwickelt einer von fünf Patienten eine Periimplantitis.
- Besonders häufig ist Periimplantitis bei Rauchern, bei Patienten mit schlechter Mundhygiene und bei Patienten, die bereits einmal an Parodontitis erkrankt waren.
- Implantate mit rauer Oberfläche lagern bei Exposition gegen die Mundhöhle mehr Plaque an als glatte Implantate.
- Es steht zu erwarten, dass die Periimplantitisprävalenz durch den zunehmenden Ersatz von Zähnen durch Implantate und die Verwendung von mäßig rauen Oberflächen in Zukunft steigen wird.
Unser Therapiekonzept
Bei der Therapie periimplantärer Infektionen sollte grundsätzlich eine zur systematischen Parodontaltherapie analoge Vorgehensweise, bestehend aus systemischer Phase, Hygienephase, korrektiver Phase und Betreuungsphase, eingehalten werden. In der schematischen Darstellung (Abb. 1) wird der Ablauf einer systematischen Therapie periimplantärer Infektionen, wie sie in unserer Klinik durchgeführt wird, dargestellt. Primär muss, um einer Progression der Erkrankung entgegenzuwirken, durch eine kausal gerichtete Therapie die pathogene Mikroflora reduziert werden.2 Die Entfernung subgingivaler Konkremente sowie des bakteriellen Biofilms von Titanimplantaten wird jedoch durch verschiedenste Implantatoberflächenmodifikationen erschwert.3 Auch die prothetischen Aufbauten und Suprakonstruktionen erschweren oft den Zugang zu den infizierten Oberflächen. In diesem Zusammenhang wird neben der mechanischen Entfernung des Biofilms zusätzlich eine Dekontamination oder Konditionierung der exponierten Implantatoberfläche gefordert, um die Entfernung von Bakterien und deren Lipopolysaccharide von der mikrostrukturierten Implantatoberfläche zu optimieren. Hierfür kann man einen nicht chirurgischen von einem chirurgischen Therapieansatz unterscheiden. Letzterer ist bei resektiven oder regenerativen Verfahren (gesteuerte Knochenregeneration, GBR) obligatorisch. Im Gegensatz hierzu kann die Entfernung des Biofilms als vorbereitende Maßnahme für resektive oder regenerative Verfahren sowohl nicht chirurgisch als auch unter Sicht nach Mobilisation eines Mukoperiostlappens erfolgen.4 In diesem Zusammenhang sollte jedoch beachtet werden, dass für die Therapie periimplantärer Infektionen bisher keine kritischen Sondierungstiefen definiert worden sind, anhand derer eine Entscheidungsfindung für nicht chirurgische oder chirurgische Therapieansätze getroffen werden könnte.5 Bei allen Therapiekonzepten sind eine adäquate Plaquekontrolle durch den Patienten sowie ein suffizientes Recallsystem Grundvoraussetzung für eine erfolgreiche Therapie.
Lasereinsatz in der Therapie periimplantärer Entzündungen
In unserer Klinik hat sich der Lasereinsatz in der Parodontologie klinisch bewährt. Das hohe bakterizide Potenzial des Laserlichtes im Gingivalsulkus und angrenzendem Weichgewebe ist hier ein großer Vorteil, was auch andere Autoren wie Ben Hatit et al. 1996, Coffelt et al. 1997 und Moritz et al. 1997, um nur einige zu nennen, beschrieben haben.6–8 Dringend zu beachten ist allerdings die Wirkung der unterschiedlichen Laserlichtwellenlängen auf die verschiedenen Implantatoberflächen. So verbietet es sich, einen Neodymium-YAG-Laser in der Nähe oder an der Oberfläche von Titanimplantaten zu verwenden. Der Nd:YAG-Laser zerstört die Implantatoberfläche und kann diese auch makroskopisch sichtbar aufschweißen. Dagegen ist der Er:YAG-Laser denkbar gut für die Verwendung in unmittelbarer Nähe von Titanimplantaten, insbesondere auch zum Säubern und Dekontaminieren der Implantatoberfläche, geeignet. Der Er:YAG-Laser wurde bereits 1974 von Zharikov et al. als Festkörperlaser mit einer Wellenlänge von 2.940 nm im nahen bis mittleren Infrarotbereich vorgestellt.9 Die Besonderheit dieser Wellenlänge liegt in der Tatsache, dass sie mit der maximalen Absorption in Wasser übereinstimmt und sogar 15 mal größer als die des CO2-Lasers ist. Je nach Auswahl der physikalischen Laserparameter durch den Behandler (damit sind Laserleistung, Fokus-Gewebe-Abstand, Applikationszeit, Pulsrate und Energiedichte gemeint), ergeben sich im lebenden Gewebe unterschiedliche biologische Vorgänge. Bei der thermomechanischen Ablation beruht das Prinzip des Abtrages von biologischem Gewebe darauf, dass der Anteil des im Gewebe enthaltenen Wassers bei Absorption von sehr kurzen Laserlichtpulsen einen sprungartigen Übergang vom flüssigen in den dampfförmigen Aggregatzustand erfährt. Begleitet durch die schnelle Expansion des Wassers entsteht hierbei kurzzeitig ein genügend hoher Druck, um Hart- und Weichgewebesubstanz effektiv wegzusprengen und damit in gewünschter Weise abzutragen.10,11 Natürlich muss die verwendete Arbeitsspitze bzw. Laserfaser gewährleisten, dass alle dekontaminierten Bereiche der Implantatoberfläche oder des entzündeten Implantatbettes im Alveolarknochen zielgerichtet erreicht werden. Hierzu verwende ich in meiner Praxis sowohl Faserspitzen (Abb. 2) als auch einen zylindrischen Arbeitsansatz, der über eine Abschrägung (Phase) das Laserlicht in einem Winkel von ca. 45 Grad abstrahlen lässt (Abb. 3), damit auch die Anteile der makroskopisch vorhandenen Implantatschraubenwindungen dreidimensional erfasst werden können. Bei sehr gut zugänglichen oder freiliegenden Implantatoberflächen oder Defektarealen des periimplantären Alveolarknochens nutze ich auch gerne das sogenannte Fensterhandstück, welches ohne Faser oder Saphirlichtkeil eine großflächige Laserlichtapplikation mit hoher Energiedichte ermöglicht (Abb. 4).
Falldarstellung
Im nachfolgenden Patientenfall soll aus didaktischen Gründen nur exemplarisch auf die resektiven und regenerativen Behandlungsabschnitte des komplexen Therapiekonzeptes eingegangen werden.
Anamnese und Befund
Weibliche Patientin, 56 Jahre alt, Raucherin, keine Allgemeinerkrankungen, Zustand 14 Jahre nach Implantatinsertion, bis vor 20 Monaten regelmäßige zahnärztliche Kontrollen, danach keine Prophylaxe und Kontrollmaßnahmen mehr in Anspruch genommen und Behandlungspause. Die Patientin stellte sich mit Verlust der implantatgetragenen Metallkeramikbrücke 35–37 vor (Abb. 5 und 6, seitliche und okklusale Ansicht). Die nachfolgende klinische Untersuchung ergab: leichte Lockerung von Implantat Regio 37 (Grad 1), bei Sondierung minimale Blutungsneigung und geringe Pus-Entleerung Regio 37. Dagegen war bei Implantat 35 keine Blutung oder Pus-Entleerung feststellbar. Insgesamt waren jedoch kaum eine Rötung der Gingiva, keine entzündliche Infiltration oder Schwellung oder Lockerung von Implantat 35, dessen Klopfschall hell und klar war, zu erkennen. Röntgenologisch zeigte sich eine periimplantäre Aufhellung in Form eines deutlich verbreiterten Spaltes im Verlauf der gesamten Implantatoberfläche zwischen Implantat und umgebenden Alveolarknochen (Abb. 7). Nach der modifizierten Anwendung unseres in Abbildung 1 dargestellten Therapiekonzeptes wurde aufgrund des Brückenverlustes relativ zeitnah der Versuch der chirurgischen Behandlung der periimplantären Infektion im Implantatbereich 37 angestrebt, wobei die Patientin über die nur begrenzte Erfolgschance für die Implantaterhaltung zu Beginn der Therapie aufgeklärt wurde. In Lokalanästhesie erfolgte nach Mukoperiostlappenbildung die schonende Freilegung des Alveolarfortsatzes Regio 36–38 und Darstellung des Knochendefektes im Implantatbettbereich 37 (Abb. 8). In der Übersicht des freigelegten OP-Areals kann im zervikalen Implantatareal Granulationsgewebe dargestellt werden (Abb. 9). Durch die vorgefundene Konfiguration des Knochendefektes war es notwendig, verschiedene Laserfaser-Arbeitsansätze zum Einsatz zu bringen. Genutzt wurde der Erbium:YAG-Laser KaVo KEY 3+ der Firma KaVo GmbH Deutschland. In der geräteeigenen Programmauswahl finden sich bereits vom Hersteller vorgegebene Einstellungen zur Therapie der „Implantitis“ (Abb. 10), die jedoch nach den Erfahrungen und dem Wissen des Behandlers modifiziert werden können (Abb. 11). So wurde im ersten Therapieschritt der Laseranwendungen eine dünne Arbeitsfaser genutzt (Abb. 2), die auch sonst für chirurgische Schnittführungen Anwendung findet, um das weiche Granulationsgewebe aus dem spaltförmigen Knochendefekt und von der Implantatoberfläche zu entfernen (Abb. 12 und 13). Danach kam eine spezielle zylinderförmige Saphirarbeitsspitze zum Einsatz (Abb. 3), die an ihrem Arbeitsende eine 45-gradige Abschrägung (Phase) hat (Abb. 3), damit das Laserlicht durch zirkuläre und seitliche Abstrahlung im Winkel von 45 Grad auch in normalerweise schwer zugängliche Bereiche, z.B. auch unter die Schraubenwindungen der Implantate, gelangt. Hierzu wurde die notwendige Energie auf 350 mJ bei einer Pulsrate von 15 Hz und 5,25 W erhöht. Abbildung 14 zeigt, wie das Arbeitsende parallel und entlang der Implantatoberfläche in die Tiefe des periimplantären Knochendefektes geführt wird. In der Abbildung 15 ist bereits eine deutliche Freilegung des Implantates zirkulär mit spaltförmigem Knochenverlust zu erkennen, was nach Spiekermann 1993 einer Klasse 4 entspricht.11 Nach der Laserdekontaminierung und Säuberung der Implantatoberfläche mittels Erbium: YAG-Laser und physiologischer NaCl-Lösung wurden klinisch das gesamte makroskopisch vorgefundene Granulationsgewebe und die infizierte, dem Implantat zugewandte Alveolarknochenoberfläche abgetragen. Danach erfolgte die Auffüllung des vierwandigen Knochendefektes mit xenogenem Knochenersatzmaterial, welches nach Vermischung mit patienteneigenem Blut zusätzlich zu einer minimalen vertikalen Augmentation bis zum Implantatschulterbereich angehäuft wurde (Abb. 16). Auf eine wie früher von anderen Autoren1,4 beschriebene Implantatplastik mit Abtragen der rauen Oberfläche wurde verzichtet, um keine Titanpartikel in den umgebenden Knochen zu verbringen, was man später als Titanpartikelwolke im Röntgenbild darstellen könnte. Dieses Vorgehen war bereits präoperativ ausführlich mit der Patientin besprochen worden und hat erfahrungsgemäß, nach primärer Deckung des Defektes, eine gute Erfolgsaussicht (Abb. 17). Nach dem Abdecken des xenogenen Augmentationsmaterials durch eine Kollagenmembran und primären Wundverschluss wurden die Implantate zunächst durch ein Langzeitprovisorium in Konfiguration der ehemaligen Brücke stabilisiert. Das in der Okklusionshöhe deutlich reduzierte Langzeitprovisorium wurde für sechs Wochen zur temporären Schienung genutzt. Diese Maßnahme sollte auch der Stabilisierung des minimal gelockerten Implantates 37 dienen. Die unmittelbare postoperative Kontrolle nach Laserdekontaminierung und Augmentation mit Bio-Oss®-Granulat Korngröße 0,25–1 mm und Deckung mittels Bio-Gide®-Membran wurde röntgenologisch nachkontrolliert und in der Abbildung 18 dargestellt.
Nach einer klinisch reizlosen Einheilphase von sechs Wochen wurde dann das Langzeitprovisorium gegen die definitive ursprüngliche Brückenversorgung ausgetauscht. Zunächst wurden in vier-, später in sechsmonatigem Abstand der Behandlungserfolg kontrolliert und professionelle Prophylaxemaßnahmen durchgeführt. Die klinische Kontrolle vier Jahre nach durchgeführter Lasertherapie und Augmentation in Regio 37 zeigte die Patientin subjektiv ohne Schmerzen, und der Implantatrückpfeiler Regio 37 war klinisch fest. Auch bei Sondierung kam es weder zur Blutung noch zum Pus-Austritt. Die Sondierungstiefe war und ist lediglich 2–2,5 mm (Abb. 19 und 20). Die röntgenologische Kontrolle nach fünf Jahren (Abb. 21 und 22) zeigt eine gute Anlagerung des umgebenden Knochens im Implantatbereich 37. Die Erfolgsaussichten, ein Implantat durch Laserdekontaminierung und kombiniertes GBR-Verfahren zu retten, sind aus meiner Erfahrung als günstig einzuschätzen. Wenn es gelingt, sowohl die Implantatoberfläche als auch das knöcherne Implantatbett zu dekontaminieren, kann man auf die hohe Regenerationsfähigkeit des Alveolarknochens bauen. Die zusätzliche Anwendung von xenogenem Augmentationsmaterial verspricht eine deutliche Verbesserung des Therapieerfolges, da sowohl eine Leitschienenfunktion für den neu zu bildenden Knochen als auch eine primäre mechanische Stabilisierung des Implantates unmittelbar nach Einbringen des Materials erreicht wird. Die Anwender von GBR-Techniken wissen, dass man für diesen biologischen Vorgang Raum und Stabilität schaffen muss sowie eine möglichst lange Ruhephase. Deshalb sollte auch eine Kaubelastung während der vier- bis sechswöchigen Einheilphase vermieden werden. Aus diesem Grunde ist es generell sicherer, die gesamte Suprakonstruktion mehrerer Implantate zu entfernen und die Wunde gedeckt abheilen zu lassen.
Fazit
Heute wird die Erfolgsrate der Implantattherapie allgemein als hoch angesehen. Dennoch sind infektiöse Komplikationen wie Mukositis und Periimplantitis häufig dokumentiert und gelten an Implantaten, die seit fünf bis zehn Jahren in situ sind, als üblich. Die periimplantäre Mukositis und die Periimplantitis haben eine infektiöse Ursache. Unbehandelt führen sie über kurz oder lang zum Implantatverlust. Sobald die Entzündung den periimplantären Knochen erreicht hat, sollte mit der Anwendung eines Er:YAG-Lasers die Implantatoberfläche gesäubert und dekontaminiert sowie der infizierte Knochen ablativ behandelt werden. Die kombinierte Anwendung von GBR-Methoden verbessert die klinische Situation und begünstigt eine biologische Regeneration.
Hier geht's zur Literaturliste.


























 Proto-Cam® Smart
Proto-Cam® Smart  Patientenbrille P07.P1P11.1001
Patientenbrille P07.P1P11.1001  Laserschutz-Lupenbrille F27P1M03
Laserschutz-Lupenbrille F27P1M03  IPL-Brille F22P5L04 für Behandlungspersonal
IPL-Brille F22P5L04 für Behandlungspersonal  F18P1C02 für Dentallaser Anwendungen
F18P1C02 für Dentallaser Anwendungen  WaterLase MDX
WaterLase MDX  Waterlase Epic X
Waterlase Epic X  Waterlase Express
Waterlase Express  Maskensystem Axess™
Maskensystem Axess™  Accutron-Doppelmaskensystem seda-view®
Accutron-Doppelmaskensystem seda-view®