Oralchirurgie 02.09.2013
Oraler Lichen planus (OLP) und orale lichenoide Reaktion (OLR)
share
Der Lichen planus ist eine weitverbreitete papulöse, juckende, nicht kontagiöse chronisch-entzündliche Erkrankung der äußeren Haut und der Schleimhäute mit dem Risiko der malignen Transformation in einen bösartigen Tumor. Grundsätzlich werden dabei die kutane Form (CLP – cutaneous lichen planus) und die orale Form (OLP – oral lichen planus) unterschieden. Der vorliegende Artikel beschäftigt sich vorwiegend mit der Epidemiologie, der Ätiopathogenese, der klinischen Symptomatik und Klassifizierung, der Diagnostik, der Therapie sowie der Prognose des oralen Lichen planus.
Der orale Lichen planus ist eine der am weitesten verbreiteten Erkrankungen der Mundhöhle. Die Prävalenz in der Bevölkerung liegt zwischen 0,5 bis 2,6 %.53,90 Das Prädilektionsalter liegt zwischen 40–50 Jahren, wobei Frauen ungefähr doppelt so häufig betroffen sind wie Männer. Kinder sind nur in Ausnahmefällen betroffen.55,109
Begriffsbestimmung „OLP“ und „OLR“
Über die Zuordnung der Begriffe „oraler Lichen planus“ (OLP) und „orale lichenoide Reaktion“ (OLR; englisch: OLL, oral lichenoid lesion) herrscht Unklarheit.55 Die orale lichenoide Reaktion wird dabei als Variante des oralen Lichen planus verstanden. Dabei lässt sich die orale lichenoide Reaktion einer entsprechenden Ätiologie, zum Beispiel Medikamenten wie BETA-Blocker, Sulfonylharnstoffe, nicht steroidale Antirheumatika (NSAR), Goldsalze und Phenothiazine oder dentale Wirkstoffe wie Amalgam zuordnen.71,99,116 Neben Amalgam wurden auch Überempfindlichkeitsreaktionen auf Komposite und Prothesenkunststoffe (Acrylate) beschrieben.8,11 Der orale Lichen planus an sich wird dabei als idiopathische Version des klinisch histologisch gleichen Krankheitsbilds verstanden.24,42 Einige Studien konnten nach Entfernung der dentalen Werkstoffe eine Abheilung der oralen lichenoiden Reaktion zeigen.56,124 Klinisch und histologisch lassen sich der orale Lichen planus und die orale lichenoide Reaktion nicht unterscheiden, in einigen Fällen ist eine Differenzierung über den Patch-Test möglich, mit dessen Hilfe Überempfindlichkeitsreaktionen bei oralen lichenoiden Reaktionen festgestellt werden können.70,116

In einer internationalen Konsensuskonferenz wurde vorgeschlagen, die oralen lichenoiden Läsionen (OLL) aufzuteilen in orale lichenoide Kontaktläsionen (oral lichenoid contact lesions, OLCL) und orale medikamentenassoziierte Läsionen (oral lichenoid drug lesions, OLDL). Die Graft-versus-Host-Reaktion (GvHR) nach Stammzelltransplantation gilt als eigene Krankheitsentität.119
Ätiologie
Die genaue Ätiologie des oralen Lichen planus und der oralen lichenoiden Reaktion ist weitestgehend unbekannt. Es scheint sich um eine T-zellvermittelte Autoimmunreaktion zu handeln, bei der zytotoxische CD8+-T-Lymphozyten die Apoptose basaler Keratinozyten in der Mukosa auslösen.120 Jedoch wurden einige prädisponierende Faktoren identifiziert (Abb. 1). Psychischer Stress, vor allem ausgeprägte Ängstlichkeit, wurde in mehreren Studien als auslösende Ursache für die Exazerbation eines oralen Lichen planus identifiziert.28,32 Jedoch sollte in diesem Kontext auch nicht unerwähnt bleiben, dass der orale Lichen planus als symptomatische Erkrankung selbst auch zu erheblichem emotionalem Stress und somit zu einer Somatisierungsreaktion führen kann, was wiederum die Chronifizierung der Erkrankung begünstigt.57
Eine genetische Prädisposition scheint beim idiopathischen oralen Lichen planus eine Rolle zu spielen. 1998 wurde eine verstärkte HLA-A3 Expression in Assoziation mit dem Auftreten eines Lichen planus beschrieben.102 Verschiedene Viren, das Herpes-simplex-Virus Typ 1 (HSV-1), das Epstein-Barr-Virus (EBV), das Zytomegalievirus (CMV) und auch verschiedene Typen des Humanen Papillomavirus (HPV) wurden mit der Entstehung des oralen Lichen planus in Verbindung gebracht, jedoch ließ sich kein ursächlicher Zusammenhang feststellen.16,79 Am besten dokumentiert in mehr als 90 Studien weltweit ist der Einfluss der chronischen Hepatitis-C-Infektion auf die Entstehung des oralen Lichen planus.4,10,22,25,94,111,125
Die Prävalenz bei Patienten mit oralem Lichen planus beträgt bis zu 62 %.92 Hepatitis C ist weltweit eine der häufigsten Ursachen für eine chronische Lebererkrankung, jedoch ergibt sich Morbidität zu einem erheblichen Anteil aus den extrahepatischen Manifestationen, zu denen auch der orale Lichen planus zählt.22 Die Assoziation zwischen einer chronischen Hepatitis-C-Infektion und dem oralen Lichen planus scheint jedoch stark geografischen Einflüssen unterworfen zu sein, wobei sich die stärksten Assoziationen in Japan und im Mittelmeergebiet zeigten, nicht jedoch in westeuropäischen Ländern wie Frankreich und Großbritannien.55 Über den pathophysiologischen Mechanismus herrscht nach wie vor keine Klarheit. Neben der Abhängigkeit von der Viruslast und viralen Faktoren, die direkt einen oralen Lichen planus induzieren, wird vor allem eine Immunreaktion auf das Hepatitis-C-Virus diskutiert, die gleichzeitig gegen körpereigene Epitope gerichtet ist.22 Klinisch und histologisch lassen sich der idiopathische orale Lichen planus und die HCV-induzierte Variante nicht unterscheiden, jedoch findet sich bei der HCV-induzierten Variante eine höhere Sekretion von inflammatorischen Zytokinen durch T-Lymphozyten, was auf die HCV-Infektion zurückzuführen ist.26,103
Zudem zeigte sich, dass sich die Hepatitis-C-Viren in der Mundschleimhaut replizieren können, was wiederum T-Lymphozyten anlockt.7 Nach allogenen Knochenmarktransplantationen, zum Beispiel nach ablativer Chemotherapie bei Leukämien, kann sich ein oraler Lichen planus entwickeln.49,95 Im Vergleich zum idiopathischen oralen Lichen planus und der oralen lichenoiden Reaktion handelt es sich beim oralen Lichen planus im Rahmen einer Graft-versus-Host-Reaktion (GvHR) um eine eigene Krankheitsentität mit klar abgrenzbaren klinischen und pathologischen Merkmalen.119 Wie in Abbildung 1 beschrieben, sind mehrere Medikamente mit dem Auftreten von oralen lichenoiden Reaktionen assoziiert.15,39,41,100,108
In diesem Kontext muss auch erwähnt werden, dass es im Rahmen einer Hepatitis-C-Therapie mit pegyliertem Interferon und Ribavirin durch diese Medikamente zu einer Verstärkung eines bestehenden oralen Lichen planus beziehungsweise
zum Auftreten einer oralen lichenoiden Reaktion kommen kann.93 Neben Amalgam, was in vielen Studien als Auslöser einer
oralen lichenoiden Läsion identifiziert wurde37,40,58,60,69,96 konnte auch für Komposite, Gold und Prothesenkunststoffe eine Assoziation mit dem gehäuften Auftreten von oralen lichenoiden Läsionen gezeigt werden.1,11,61
70 % der Überempfindlichkeitsreaktionen zeigten im Patch-Test ein positives Ergebnis für Amalgam oder Quecksilber, welches sich beim idiopathischen oralen Lichen planus nur in 4 % fand. Nach Entfernung der Amalgamrestaurationen kam es in 93 % zu einer Rückbildung der Läsionen.124 Pathogenetisch wird von einer Typ-IV-Überempfindlichkeitsreaktion ausgegangen.12,124 Die Abbildungen 2 bis 4 zeigen einen klinischen Fall, bei dem es nach Entfernung der Amalgamrestaurationen und einer suffizienten prothetischen Versorgung der Zähne zu einer Komplettremission der lichenoiden Reaktion kam.
Pathogenese
Beim oralen Lichen planus handelt es sich um eine chronisch-entzündliche Erkrankung der Mundschleimhaut, bei der es zu einer Zerstörung der Basalzellschicht kommt, vermittelt durch CD8+-T-Lymphozyten, die ein bisher nicht sicher identifiziertes Oberflächenantigen der Basalzellen angreifen.104 Dabei nimmt man an, dass die Antigenexpression der basalen Keratinozyten durch dentale Werkstoffe (OLR), durch Medikamente, bakterielle und virale Infektionen oder auch durch ein mechanisches Trauma (Köbner-Phänomen) hervorgerufen wird. Als ein mögliches Antigen gelten heat shock proteins (hsp 27, hsp 90) auf den mukosalen Keratinozyten, da es häufig bei oralem Lichen planus exprimiert wird und die Expression durch mechanische Reizung, Medikamente, bakterielle und virale Infektionen induziert werden kann.27,44
Durch die Antigenexpression der Keratinozyten kommt es zu einer Aktivierung von antigenpräsentierenden Langerhanszellen in der Mukosa, die wiederum die CD8+-T-Lymphozyten aktivieren.46,47 Die CD8+-T-Lymphozyten sezernieren TNF-Alpha, was wiederum die Apoptose der Keratinozyten auslöst.73 Für diesen Mechanismus gibt es verschiedene mögliche Erklärungen: Entweder das von den T-Lymphozyten sezernierte TNF-Alpha bindet an einen Rezeptor auf der Oberfläche der Keratinozyten oder ein Fas-Ligand (CD95L) auf der Oberfläche der T-Lymphozyten bindet an CD95 auf der Keratinozytenoberfläche. Alternativ wird auch diskutiert, dass die CD8+-T-Lymphozyten Granzyme B sezernieren, was über Perforine in die Keratinozyten eingeschleust wird. Alle diese Mechanismen führen zu einer Aktivierung einer Caspase, die die Apoptose induziert.55,120
Klinische Symptomatik und Klassifikation
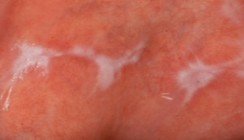
Der klinische Verlauf ist äußerst variabel und reicht von völliger Beschwerdelosigkeit bis zu quälendem Brennen und unerträglichen Schmerzen.55 Die meisten Patienten berichten von einer „rauen“ Mundschleimhaut und einer erhöhten Empfindlichkeit gegenüber heißen und scharf gewürzten Speisen.17,32 Beim oralen Lichen planus gibt es sechs Manifestationsformen, davon drei weiße und drei rote Formen. Zu den weißen Formen zählen die retikuläre (Abb. 5), die plaqueförmige und die papuläre Form, die roten Formen beinhalten die erosiv-ulzerierende (Abb. 6), die atrophische und die bullöse Form des OLP.5,8,115 Am häufigsten findet man die retikuläre Form. Klassischerweise zeigt sich ein bilateral symmetrischer Befall, vor allem im Bereich der bukkalen Mukosa mit der netzartigen weißen Streifung, der als Wickham’sche Streifung bezeichnet wird. Generell können alle anderen Bereiche der Mundhöhle befallen werden, jedoch sind neben der bukkalen Mukosa, die Umschlagfalte im Seitenzahnbereich, die Zunge, der Gaumen und die Unterlippe als Prädilektionsstellen zu betrachten. Die retikuläre Form verläuft häufig asymptomatisch.32,54
Bei symptomatischen Verläufen wird meist ein Rauigkeitsgefühl angegeben. Die Schleimhautveränderungen sind in der Regel dynamisch und verändern ihre Form und Größe, genauso wie auch die Beschwerden selten konstant bleiben. Der plaqueförmige OLP ist häufig mit Tabakkonsum assoziiert und tritt bevorzugt im Bereich von Zungenrücken und Wange auf. Klinisch ähnelt das Bild einer Leukoplakie, jedoch finden sich gerade im Randbereich flächenhafte Plaques, die eine Wickham’sche Streifung aufweisen.13,123 Die papuläre Form kommt eher selten vor und verläuft meist akut. Es finden sich multifokal kleine weiße Papeln mit einem Durchmesser von 0,5 – 1 mm und eine feine Wickham’sche Streifung in der Peripherie. Typischerweise geht die papuläre Form später in eine andere Form des OLP, meistens in die retikuläre Form, über. Selten treten klinisch Beschwerden auf.14 Die kutanen Formen heilen meistens nach ein bis zwei Jahren mit quälendem Juckreiz ab, in einigen Fällen kann es jedoch auch zu einer Chronifizierung kommen (Abb. 7). Extraorale Manifestationen bei Patienten mit einem OLP finden sich 15 % der Fälle.32
Betroffen sind vor allem die äußere Haut der Unterschenkelstreckseite, die Kopfhaut, die Fingernägel und die Genitalien. Im Bereich der Haut finden sich vor allem stark juckende rötliche Papeln mit der weißen, netzartigen Wickham’schen Streifung. Das Auftreten der Papeln lässt sich durch Kratzen induzieren, was als positiver isomorpher Reizeffekt (Köbner-Phänomen) bezeichnet wird. Im Bereich der Fingernägel finden sich eine Querstreifung und eine Onychorhexis.110
Diagnostik
Die Diagnose eines oralen Lichen planus erfolgt primär klinisch und histologisch.38,55 Bei bilateralem Auftreten der weißen Läsionen im Bereich der Wangenschleimhaut mit der typischen Wickham’schen Streifung lässt sich die Diagnose klinisch stellen. Häufig jedoch finden sich nicht diese typischen Zeichen, sodass eine histologische Sicherung der Diagnose erfolgen muss. Die histologischen Kennzeichen ähneln dem kutanen Lichen planus.55 Typische histologische Kennzeichen des oralen Lichen planus sind eine Hyperkeratose mit verbreitertem Stratum spinosum, eine Liquefikation der Basalzellschicht, ein bandförmiges eosinophiles subepitheliales Infiltrat aus Lymphozyten, ein Fehlen oder sägezahnförmiges Aussehen der epithelialen Reteleisten und das Vorhandensein von Civattekörperchen.35,36,109,126
Bei den Civattekörperchen handelt es sich um degenerierte Keratinozyten, die aus Kolloid bestehen und sich als homogene eosinophile Kügelchen darstellen.48 Zytomorphologische Kennzeichen der Dysplasie wie vermehrte und atypische Mitosefiguren sowie eine Zell- und Kernpolymorphie zählen hingegen nicht zu den Diagnosekriterien des oralen Lichen planus.55 Die direkte Immunfluoreszenz stellt ein weitverbreitetes Verfahren in der adjuvanten Diagnostik des oralen Lichen planus dar. Mit der direkten Immunfluoreszenz lassen sich Autoantikörper, die an das Gewebe gebunden sind, darstellen.6 Die Sensitivität beim oralen Lichen planus beträgt 66 %.106 Es finden sich lineare Ablagerungen von IgA, IgG, IgM und vom Komplementfaktor C3 im Bereich der Basalmembran.68,72 Eine Differenzierung des oralen Lichen planus und der oralen lichenoiden Reaktion sind durch die direkte Immunfluoreszenz nicht möglich, da die Befunde identisch sind.130
Die indirekte Immunfluoreszenz, bei der im Blut zirkulierende Antikörper gesucht werden, hat in der Diagnostik des oralen Lichen planus keine Funktion. Jedoch lassen sich manchmal zirkulierende Antikörper bei lichenoiden Reaktionen auf Medikamente nachweisen, die dazu beitragen, eine medikamenteninduzierte orale lichenoide Reaktion zu identifizieren.55 Wie bereits beschrieben, sind Überempfindlichkeitsreaktionen auf dentale Werkstoffe eine häufige Ursache für orale lichenoide Reaktionen. In seltenen Fällen liegen der oralen lichenoiden Reaktion auch lokale toxische Reaktionen auf die Dentalwerkstoffe zugrunde, die sich von Überempfindlichkeitsreaktionen durch einen negativen Patch-Test abgrenzen lassen.87,133 Mit dem Patch-Test lassen sich Allergene von Typ I- und Typ IV-Reaktionen zuverlässig identifizieren. 72 Stunden nach Auftrag der Testsubstanzen auf die Rückenhaut lassen sich die Ergebnisse ablesen. Als positiv wird ein Patch-Test beim Auftreten von erythematösen, ödematösen oder bullösulzerierenden Hautveränderungen im Untersuchungsareal gewertet.81,96 Die Angaben zu positiven Patch-Tests auf Amalgam bei oralem Lichen planus schwanken zwischen 34–79 %.55,76
Therapie
Die orale lichenoide Reaktion, ausgehend von Dentalwerkstoffen oder systemischen Medikamenten, lässt sich häufig erfolgreich dadurch behandeln, dass der entsprechende Werkstoff entfernt wird oder das Medikament gewechselt wird.124
Der idiopathische orale Lichen planus lässt sich nicht kausal behandeln und auch nicht heilen, hier steht die symptomatische Therapie im Vordergrund.2 Allerdings wurden in seltenen Fällen (2,5 %) Spontanheilungen beobachtet.21 Patienten mit einer retikulären Form des oralen Lichen planus ohne klinische Beschwerden bedürfen keiner Behandlung.112 Zunächst sollten Faktoren wie Tabakkonsum, schlecht sitzender Zahnersatz und Alkoholkonsum ausgeschaltet werden.23 Eine gute Mundhygiene und regelmäßige Mundspülungen mit Chlor hexidin verbessern die Symptomatik.51 Für die Behandlung des oralen Lichen planus sind circa 50 verschiedene Medikamente eingesetzt worden, wobei viele von ihnen nicht in klinischen Studien überprüft wurden.23 Dies liegt daran, dass fast alle eingesetzten Medikamente immunsuppressive Wirkung haben und nicht speziell für den Einsatz beim oralen Lichen planus entwickelt wurden. Bei solchen Medikamenten sind die Patienten vor Beginn einer Therapie auf den „off-label-use“ schriftlich hinzuweisen, dies gilt vor allem für Immunsuppressiva (z.B. Ciclosporin, Tacrolimus) und hochpotente Glucocorticoide (z.B. Clobetasol). Der Zahnarzt sollte sich über die rechtlichen Konsequenzen bei der Therapie im „off-label-Bereich“ im Klaren sein. Zu beachten ist außerdem, dass in der Regel eine Erstattung im Bereich GKV nicht erfolgt. Der topische Einsatz wird der systemischen Gabe im Allgemeinen vorgezogen, die nur bei schweren therapierefraktären Verläufen zum Einsatz kommt.23,55
Am besten untersucht und am weitesten verbreitet sind topische Steroide. Die antiinflammatorische Wirkung der Steroide beruht dabei vor allem auf einer proximalen Blockade der T-Zell-Aktivierungskaskade, indem die Transkription der Zytokine Interleukin-1, -2 und -6 gehemmt wird. Viele proinflammatorische Zytokine werden über den Transkriptionsfaktor NF-Kappa-B (Nuclear Factor Kappa-B) reguliert. Er besteht aus einer p50 und p65 Untereinheit. Wenn er an ein inhibitorisches Protein bindet, ist er inaktiv. Durch Substanzen wie TNF-Alpha oder IL-1-Beta wird er aktiviert, indem Kinasen wie IKK-Alpha und IKK-Beta ihn phosphorylieren. Es erfolgt die Proteolyse in beide Untereinheiten, sodass diese in den Zellkern wandern können und dort die Transkription proinflammatorischer Gene starten können. Glukokortikoide binden zum Beispiel an zytoplasmatische Rezeptoren, wodurch die Translokation des Komplexes in den Zellkern verhindert wird.91
Als besonders effektiv erwiesen haben sich Triamcinolon-Acetonid (Volon A Haftsalbe®) 0,1 %, ein mittelpotentes lokalwirksames Steroid, Fluocinolon-Acetonid 0,1 %, ein höherpotentes Steroid, und hochpotente Steroide aus der Gruppe der halogenierten Kortikoste roide wie Clobetasol-Propionat 0,05 %.20,84,122 Durch Clobetasol-Propionat ließ sich in bis zu 75 % eine Komplettremission der Beschwerden und der Schleimhautveränderungen erzielen.23 Fortgesetzter Gebrauch hochpotenter topischer Steroide kann jedoch zur To leranzbildung und somit zu einer Abnahme der Effektivität der Behandlung führen. Um diesem Phänomen entgegenzuwirken, empfiehlt es sich, initial ein hochwirksames Steroid wie Clobetasol einzusetzen und zur Erhaltungstherapie dann auf ein niedrigerpotentes Steroid wie Triamcinolon zu wechseln.33 Eines der Hauptprobleme in der Anwendung topischer Steroide liegt darin, einen ausreichend langen Kontakt zwischen dem Medikament und der Mukosa herzustellen. Aus diesem Grunde wurden Haftpasten auf dem Boden Carboxmethylzellulose und Hydroxyethylzellulose entwickelt.128 Nach Anwendung, die zwei- bis dreimal täglich vorgesehen ist, sollten die Patienten für eine halbe Stunde auf Sprechen, Essen und Trinken verzichten und danach den Mund gründlich umspülen, um ein Verschlucken der Substanzen zu vermeiden.24 Bei erosiven Formen ist auch eine intraläsonale Injektion von Triamcinolon möglich.74 Obwohl von einer systemischen Resorption bei lokaler Therapie mit Steroiden berichtet wurde, ließe sich selbst in der Langzeittherapie mit hochwirksamen Steroiden wie Clobetasol keine sekundäre Nebennierenrindeninsuffzienz feststellen.20,97 Eine häufige Nebenwirkung: in bis zu 30 % der Fälle kommt es zu einer sekundären Candidiasis, die sich in der Regel gut mit Mundspül lösungen (wie Chlorhexidin und Octenisept®) sowie lokal wirksamen Antimykotika (Miconazol) behandeln lässt.80 Erweisen sich die Mundschleimhautläsionen als therapierefraktär gegenüber topischen Steroiden, so kann ein Wechsel auf andere topisch wirksame Substanzen vorgenommen werden.
Weitverbreitet ist der topische Einsatz von Calcineurin-Inhibtor Ciclosporin A als Mundspüllösung (50–1.500 mg/Tag) oder als Haftsalbe (26–48 mg/Tag).34,129 Ciclosporin A ist hydrophobes zyklisches Polypeptid, das die humorale und zelluläre Immunantwort hemmt, indem die Synthese von Interleukin-2 aus T-Helferzellen gehemmt wird. In den T-Helferzellen bindet Ciclosporin an das Ciclophilin und bildet einen Komplex, der die kalziumabhängige Proteinphosphataseaktivität des Calcineurin-Calmodulin-Komplexes hemmt, der in T-Helferzellen normalerweise zwei Phosphatgruppen vom NF-AT (nukleärer Faktor aktivierter T-Zellen) abspaltet. Dadurch wird die Translokation dieses Interleukin-2-Transkriptionsfaktors in den Zellkern gehemmt.91 Aufgrund der starken Nebenwirkungen ist der Einsatz von Ciclosporin A nur schwerer Symptomatik und Therapieresistenz gegenüber topischen Steroiden indiziert. Bei systemischer Resorption umfassen die Nebenwirkungen eine dosisabhängige Nierenschädigung, Hypertonie, Kardiotoxizität, Tremor, periphere Ödeme und Gingivahyperplasie.30,83,91

Abbildung 8 im Vollbild.
Eine weitere weitverbreitete immunsuppressive Substanz, die bis zu 100-mal potenter als Ciclosporin A ist, ist Tacrolimus.82,114,117 Bei Tacrolimus handelt es sich um ein Macrolid-Lacton mit einem hemiketal-maskierten Alpha-, Beta-Diketonamid in einem Ring. Die Wirkung ist ähnlich dem Ciclosporin, jedoch bindet Tacrolimus einen Komplex mit einem anderen Immunophilin, dem FK-Bindungsprotein-12 (FKBP-12), einem Macrophilin. Die weitere Wirkung ist identisch. Außerdem hemmt Tacrolimus die humorale Immunantwort, indem es die Aktivierung der B-Lymphozyten unterbindet, einerseits über eine Hemmung der T-Helferzellen, andererseits, indem es die Synthese von TNF-Alpha hemmt.75
Die Dosierung der Mundspüllösung variiert zwischen 0,03 und 0,1 %. Als lokale Nebenwirkung ist zu berücksichtigen, dass ungefähr 20 % der Patienten über ein Brennen der Mundschleimhaut klagen.50 Der Einsatz sollte aufgrund der Gefahr systemischer Resorption auf steroid-refraktäre erosive Formen beschränkt bleiben.29,50,105 Aus der neuesten Generation der Calcineurin-Inhibitoren kommt auch Pimecrolimus zum Einsatz, welches einen ähnlichen Wirkmechanismus wie Tacrolimus aufweist. Die immunsuppressive Wirkung ist geringer als bei Tacrolimus und mit der von Triamcinolon zu vergleichen. Studien belegen die Wirksamkeit einer 1 % Pimecrolimus-Creme bei erosiven Formen des oralen Lichen planus.82,127
Jedoch wurden in der letzten Zeit Fälle bekannt, bei denen es unter einer langfristigen Behandlung mit Tacrolimus 0,1 % zur malignen Transformation in ein orales Plattenepithelkarzinom kam.9 Aus diesen Gründen wird bei therapierefraktären erosiven Läsionen topisch Sirolimus (Rapamycin) eingesetzt, das durch Blockade der Interleukin-2-Synthese die Aktivierung von B- und T-Lymphozyten unterbindet. Im Gegensatz zu Tacrolimus und Pimecrolimus wird Sirolimus aber neben der immunsuppressiven Wirkung auch eine antikanzerogene Wirkung nachgesagt.118 Der Einsatz von lokal wirksamen Retinoiden wie Acitretin und Fenretinin spielt aufgrund massiver Nebenwirkungen in der Behandlung des oralen Lichen planus nur eine untergeordnete Rolle.19,107 Die systemische Gabe von Medikamenten spielt in der First-Line Therapie des oralen Lichen planus keine Rolle.24 Die systemische Kortisongabe ist bei ausgedehnter Form des oralen Lichen planus, vor allem in Kombination mit extraoralem Befall der Haut, der Genitalien und des Ösophagus, indiziert.3,18,33
Meist zeigt sich nach einwöchiger Behandlung mit täglichen Dosen von 40–80 mg Prednison ein gutes Ergebnis. Wird über einen längeren Zeitraum ein orales Glukokortikoid verabreicht, so ist darauf zu achten, dass das Medikament über einen Zeit raum von mehreren Wochen langsam ausgeschlichen wird, um eine sekundäre Nebennierenrindeninsuffizienz zu vermeiden.24 Seit einiger Zeit werden auch monoklonale Antikörper wie Basiliximab und Etanercept zur systemischen Behandlung des oralen Lichen planus eingesetzt. Aufgrund der hohen Kosten bleibt der Einsatz dieser Substanzen auf therapierefraktäre Einzelfälle beschränkt.24,132 In Abbildung 8 ist ein entsprechender Algorithmus für die Behandlung des oralen Lichen planus dargestellt.
Maligne Transformation
Der Aspekt der malignen Transformation eines oralen Lichen planus ist nach wie vor kontrovers, da es keine prospektiven Beobachtungsstudien gibt. Die momentane Datenlage geht auf retrospektive Nachbeobachtungsuntersuchungen zurück.45,78 Drei unabhängige prospektive Studien mit jeweils mehreren Hundert Patienten konnten ein signifikant erhöhtes Risiko der Entwicklung eines oralen Platten epithelkarzinoms bei Patienten mit oralen Lichen planus im Vergleich zur nicht be troffenen Bevölkerung zeigen.43,52,101 Je nach Studie wird die Rate an malignen Transformationen mit 0,2–5,3 % angegeben, wobei sich das höchste Risiko für Patienten mit erosiven und erythematösen Läsionen ergab.43,77,98 Eine mögliche Erklärung für die recht unterschiedlichen Ergebnisse dieser Studien mag sein, dass es keine einheitlichen Diagnosekriterien für den oralen Lichen planus gibt. In einigen Studien wurde die Diagnose nur auf dem Ergebnis einer klinischen Untersuchung gestellt, wohingegen andere Studien histologische Kriterien zur Diagnosesicherung herangezogen hatten. Momentan gilt die histologische Beurteilung der epithelialen Dysplasie als Goldstandard in der Beurteilung des Risikos einer malignen Transformation bei Patienten mit oralen Lichen planus.13,89 Jedoch muss hierbei beachtet werden, dass es keine festen Kriterien gibt, um das Spektrum der Dysplasie exakt in leichte, mittlere und schwere Dysplasien einzuteilen. Studien haben ausgeprägte Unterschiede in der Beurteilung des Vorhandenseins und des Ausprägungsgrades der Dysplasien durch verschiedene Untersucher zeigen können.63,67,121
Aus diesem Grunde wurde in den letzten Jahren verstärkt versucht, Biomarker zu finden, an denen man das Risiko einer malignen Transformation von Patienten mit einem oralen Lichen planus zuverlässig abschätzen kann, was am folgenden Beispiel erläutert wird. Im Jahre 2010 konnte in einer Studie an 110 Patienten gezeigt werden, dass eine hohe Podoplaninexpression in Läsionen des oralen Lichen planus signifikant mit einem erhöhten Entartungsrisiko assoziiert ist.113 Podoplanin ist ein 43 kDa schweres transmembranäres Glykoprotein, das häufig in verschiedenen Kopf-Hals-Plattenepithelkarzinomen und deren Vorläuferläsionen exprimiert wird.59,62,64–66,131,134 Dabei wurden bei hoher Podoplaninexpression eine erhöhte Rate von malignen Transformationen in oralen Leukoplakien, ein gehäuftes Auftreten von zervikalen Lymphknoten metastasen und ein reduziertes Überleben in Kopf-Hals-Plattenepithelkarzinomen beobachtet. Diese klinischen Effekte scheinen auf ähnliche Mechanismen zurückzugehen wie beim oralen Lichen planus: Podoplanin steuert das Remodelling des Aktinzytoskeletts und erhöht dadurch die Motilität der Zellen. Zudem führt eine Podoplaninüberexpression zu einer Erhöhung der Aktivität von GTPasen der Rho-Familie, vor allem Rho A, wodurch die Zellbeweglichkeit ebenfalls erhöht wird.85,86,131
Fallbeispiel
Im vorliegenden Fall wird der Krankheitsverlauf einer jungen Patientin dargestellt. Im Mai 2012 stellte sich die damals 30-jährige Patienten mit einem Infiltrat im Bereich der linken Wange und reduziertem Allgemeinzustand im zahnärztlich-chirurgischen Notdienst der Universitätsklinik Köln vor. Die klinische Untersuchung ergab bei einer geschränkter Mundöffnung eine ulzeröse Schleimhautveränderung im Bereich der linken Wange (Abb. 9). Ein dentogener Fokus war im OPG nicht zu erkennen. Nach stationärer Aufnahme unter intravenöser Antibiose mit Unacid® kam es zu einem raschen Abklingen der Wangenschwellung. Klinisch zeigte sich nun im Bereich der linken Wange eine ausgedehnte malignom verdächtige Veränderung (Abb. 10). Die Probebiopsie bestätigte den Verdacht auf ein orales Plattenepithelkarzinom. In der Anamnese fanden sich weder Zeichen von Tabak- und/oder Alkoholkonsum. Die Gewebeanalyse ergab keinen Hinweis auf eine Infektion mit humanen Papilloma-Viren, zeigte jedoch eine starke Podoplaninexpression im Primärtumor (Abb. 11). Jedoch litt die Patientin bereits seit mehr als zehn Jahren an einem erosiven oralen Lichen planus. Aufgrund des histopathologischen Befundes des Operationsresektats mit dem Stadium pT4a pN2b (3/63 Lymphknoten tumorinfiltriert, davon einer mit extrakapsulärem Tumorwachstum) erfolgte eine postoperative Radiochemotherapie mit 65 Gy und Cisplatin in der ersten und fünften Woche der Bestrahlung. Nur zwei Monate nach Abschluss der Radiochemotherapie stellte sich die Patientin mit akuter Luftnot nachts in unserer zentralen Notaufnahme vor. Im Röntgen-Thorax zeigte sich im rechten Oberlappen der Lunge ein neu aufgetretener Rundherd. Das nachfolgende Re-Staging ergab eine disseminierte pulmonale und hepatische Metastasierung (Abb. 12 und 13). Dieser Krankheitsverlauf soll die große Bedeutung einer adäquaten Verlaufskontrolle bei Patienten mit einem oralen Lichen planus verdeutlichen.
Die Literaturliste finden Sie hier.