Parodontologie 28.04.2014
Aktuelle Behandlungsmethoden in der Parodontologie – Teil II
share
Teil 2: Antiinfektiöse Therapie
Im folgenden Beitrag handelt es sich um eine Artikelreihe zum Thema „Parodontale Diagnostik und Therapie – Ein Überblick über aktuelle Behandlungsmethoden“. Teil 1: Aktuelle Behandlungsmethoden, Teil 3: Chirurgische Parodontitistherapie.
Antiinfektiöse Therapie
Initialtherapie
In der ersten Phase der Parodontitistherapie, der Initialtherapie, wird der Patient ausführlich über die Bedeutung der regelmäßigen und gründlichen Mundhygiene zur Beseitigung des Biofilms als entscheidende Voraussetzung für den Therapieerfolg und die Langzeitprognose aufgeklärt. Es erfolgen Mundhygienedemonstrationen, bei denen die für den Patienten optimale Putztechnik bestimmt wird und geeignete Hilfsmittel für die Interdentalpflege ausgewählt werden (Abb. 2.2).
Motivation und Instruktion
Die praktische Durchführbarkeit wird in Anwendungstrainings geschult. In mehreren aufeinanderfolgenden Sitzungen im Abstand von zwei bis drei Wochen wird der Erfolg kontrolliert und der Patient wiederholt instruiert und motiviert. Bewährte Mittel zur Überprüfung der Mundhygiene und zur Optimierung der erlernten Techniken sind die Aufnahme eines Plaqueindex sowie ggf. eines Gingivaindex (Abb. 2.3). Dabei dienen Plaqueindizes der quantitativen Beurteilung der Plaqueanlagerungen. Die Gingivaindizes beurteilen den Entzündungsgrad der marginalen Gingiva als Reaktion auf die bakterielle Plaque. Empfehlenswert ist in der täglichen Praxis die Verwendung eines dichotomen Index, um bei einfacher und rascher Erhebungsmöglichkeit für die Verlaufskontrolle prozentuelle Angaben vergleichen zu können. Um dem Patienten die Effektivität seiner Mundhygiene zu verdeutlichen, werden die Zahnoberflächen mit einer Farbstofflösung touchiert (Abb. 2.4). Diese Farbstoffe haften an der Plaque und Schleimhaut, nicht aber am belagfreien Schmelz. Einige dieser Plaquerelevatoren können auch anhand von Farbunterschieden jüngere Plaquebeläge von älteren abgrenzen, wodurch systematische Lücken in der häuslichen Plaquekontrolle aufgedeckt werden. Der Erfolg der häuslichen Mundhygiene wird entscheidend von der individuellen Plaquebildungsrate beeinflusst, die mit dem Schweregrad der parodontalen Entzündung korreliert. Der Hintergrund dieses Zusammenhangs ist die parodontitisbedingte vermehrte Exsudation von proteinreicher Sulkusflüssigkeit, die als Substrat für parodontale Bakterien wirkt.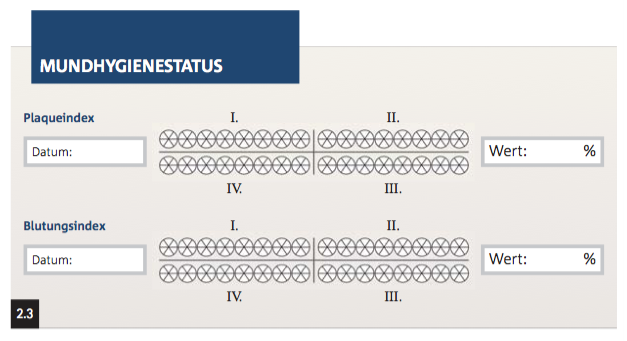
Abb. 2.3: Formblatt zur Dokumentation des Plaque- und Gingivaindex: Es bietet sich an, an sechs Stellen pro Zahn die Mundhygieneparameter zu erheben und diese in einem Formblatt zu dokumentieren, um sich im Therapieverlauf einen schnellen Überblick verschaffen zu können. So können systematische Putzfehler aufgedeckt und persistierende Entzündungen identifiziert werden.
Reduktion von irritierenden Faktoren
Raucher sollten zur Teilnahme an einem Raucherentwöhnungsprogramm motiviert werden, ggf. in Zusammenarbeit mit dem Hausarzt. Parallel zu den ersten Sitzungen sollten insuffiziente Füllungen, kariöse Läsionen und Restaurationsüberhänge entfernt und/oder ausgetauscht werden, um die Mundhygienefähigkeit zu verbessern und potenzielle Keimreservoirs zu eliminieren. Bei der Rekonturierung an sich suffizienter, aber überhängender Füllungen sind oszillierende, einseitig diamantierte Feilen sehr praktisch (z.B. KaVo Proxoshape-System).
Bei insuffizienten Füllungen bieten sich – sofern die erforderliche Trocken-legung zu gewährleisten ist – zunächst adhäsive (Aufbau-)Füllungen an. Bei erheblich insuffizienten oder stark überstehenden Kronenrändern sowie bei Notwendigkeit zur Extraktion und darauffolgendem Ersatz eines oder mehrerer Zähne ist die Eingliederung laborgefertigter langzeitprovisorischer Kronen bzw. Brücken ein sehr zu empfehlender Ansatz (Abb. 2.6). Zudem sollten grobe okklusale Diskrepanzen behoben werden. Unter Umständen, zum Beispiel wenn der Kaukomfort des Patienten eingeschränkt ist, kann eine Schienung gelockerter Zähne erfolgen. Diese erfolgt heute am sinnvollsten adhäsiv mit infiltrierter Glasfaser (z.B. everStick, LOSER & CO) und Komposit. Dabei ist peinlichst genau auf eine optimale Mundhygienefähigkeit zu achten.
Welche Zähne müssen raus?
Weiterhin sollte während der Initialphase die Extraktion nicht erhaltungswürdiger Zähne erfolgen. Es empfiehlt sich, die Prognoseeinschätzung in vier Kategorien vorzunehmen und zwischen einer ungünstigen Prognose, also weniger wahrscheinlichen erfolgreichen Therapie, und einer hoffnungslosen Prognose zu entscheiden. Wird der Zahnerhalt ausschließlich aus parodontaler Sicht betrachtet (in der Regel nur bei Vorliegen einer geschlossenen Zahnreihe ohne Notwendigkeit zur Restauration), konnte allerdings gezeigt werden, dass durch eine parodontale Behandlung auch zunächst als hoffnungslos eingestufte Zähne bei stringenter Nachsorge und Compliance des Patienten über mehrere Jahre erhalten werden konnten (Konig, Plagmann et al. 2002, Pretzl, Kaltschmitt et al. 2008). Daher sollte in der Entscheidungsfindung ebenfalls die endodontische und restaurative Versorgbarkeit sowie die strategische Bedeutung des Zahns berücksichtigt werden. Sobald ein Zahn zwingend als prothetischer Pfeiler Verwendung finden muss, um eine Versorgung des Patienten mit Zahnersatz zu ermöglichen, ist dies nach entsprechender Aufklärung des Patienten zu berücksichtigen.
Supragingivales Debridement
Zu Beginn jeder parodontalen Behandlung sollte eine professionelle Zahn-reinigung (PZR) durchgeführt werden, in der alle harten und weichen supragingival gelegenen Beläge sorgfältig entfernt werden. Somit werden die Zahnoberflächen geglättet und neu entstehender Biofilm kann sich nicht so schnell anheften. Die professionelle Zahnreinigung wird mit Handinstrumenten, Schall- und Ultraschallscalern, Pulver-Wasser-Spray bzw. fluoridhaltiger Polierpaste und Gummikelch durchgeführt.
Subgingivales Debridement
Wenn der Patient eine für seine individuelle Situation optimale Mundhygiene aufweist, kann mit der subgingivalen Instrumentierung aller pathologisch vertieften Taschen begonnen werden. Hier müssen alle Taschen ≥ 4 mm mit Blutung auf Sondierung behandelt werden. Der genauen Aufnahme des Attachmentstatus an sechs Stellen nach Ende der Initialtherapie (vgl. Abbildung 2.6a–j) kommt hierbei eine tragende Rolle zu, da die subgingivale Instrumentierung flacher Taschen (bis 3 mm) zu Attachmentverlust und Rezessionsbildung führt (Lindhe, Socransky et al. 1982).
Je nach Tiefe der Tasche und Patien-tenempfindlichkeit sollte das subgingivale Debridement unter lokaler Anästhesie erfolgen. Der Einsatz von topischen Lokalanästhetika, das heißt die Einlage von schmerzlindernden Gelen in die Tasche als Ersatz für eine Injektion, ist möglich und zeigt in einer aktuellen Studie ähnliche klinische Ergebnisse wie eine konventionelleAnästhesie (Derman, Lowden et al. 2014). Allerdings ist diese Anästhesie teuer, aufwendig in der Anwendung und wurde von den Patienten in der oben angeführten Studie der „Spritze“ nicht vorgezogen.
Ablauf – Ist eine Full Mouth Disinfection sinnvoll?
Parodontale Erkrankungen sind auf eine Infektion mit spezifischen Pathogenen bei für die Infektion empfänglichen Individuen zurückzuführen. Daher wäre es biologisch plausibel, die Behandlung dieser Infektion innerhalb des Mundes auf wenige Sitzungen zu begrenzen, um eine Reinfektion bereits gereinigter Stellen von noch nicht bearbeiteten Taschen aus zu verhindern. Auf Basis dieser Überlegung wurde von Prof. Marc Quirynen von der Universität Leuven (Belgien) das Konzept einer Gesamtdesinfektion der Mundhöhle, die sogenannte Full Mouth Disinfection (FMD) propagiert. Hierbei werden alle Taschen innerhalb von 24 Stunden instrumentiert und für einen längeren Zeitraum chlorhexidinbasierte Antiseptika eingesetzt.
Allerdings macht es nach neueren Übersichtsarbeiten keinen wesentlichen klinischen Unterschied, ob alle pathologischen Taschen innerhalb von 24 Stunden oder an mehreren Terminen zum Beispiel quadrantenweise in Ein- bis Zwei-Wochen-Intervallen behandelt werden. Der Einsatz der FMD führte in den meisten Studien zu einem gegenüber dem Standardprotokoll verbesserten klinischen Erfolg, allerdings war dieser je nach durchführendem Zentrum relativ heterogen und in der Summe wahrscheinlich nicht klinisch relevant (Eberhard, Jepsen et al. 2008). Trotzdem kann eine Behandlung nach dem Konzept der FMD sinnvoll sein, denn sie ist häufig durch eine geringere Anzahl von Sitzungen rationeller und kann positive Einflüsse auf die Patientenmotivation haben. In jüngster Zeit wurde aufbauend auf dem Konzept der FMD eine gezielte Rekolonisierung der nach Therapie „desinfizierten“ Wurzeloberflächen mit Probiotika, also nicht pathogenen oder sogar nützlichen Mikroorganismen, propagiert (Guided Pocket Recolonization; [Teughels, Newman et al. 2007]). Dieser Einsatz von Probiotika scheint klinisch relevante positive Effekte zu haben (Teughels, Durukan et al. 2013), allerdings ist die Studien-lage noch nicht ausreichend, um eine generelle Empfehlung für ihren Einsatz auszusprechen.
Instrumente und Verfahren für das subgingivale Debridement
Das subgingivale Debridement besteht darin, den mineralisierten und nicht mineralisierten Biofilm von der Wurzeloberfläche zu entfernen. Häufig wird allerdings der Terminus Scaling und Wurzelglättung oder das Wort Kürettage synonym verwendet, wodurch der Abtrag von kontaminiertem Wurzelzement und die zusätzliche Entfernung von Granulationsgewebe impliziert wird. Beides ist nach heutigem Kenntnisstand jedoch nicht für die parodontale Ausheilung nötig (Heitz-Mayfield und Lang 2013).
Das subgingivale Debridement kann mithilfe von Hand-, Schall- oder piezoelektrischen oder magnetostriktiven Ultraschallinstrumenten durchgeführt werden. In diversen Studien konnte gezeigt werden, dass die Verwendung all dieser Instrumente zu einer suffizienten subgingivalen Reinigung geeignet ist und zu vergleichbaren klinischen und mikrobiologischen Ergebnissen führt. Die klinische Effektivität des in den 1990er-Jahren für die subgingivale Reinigung eingeführten Erbium:Yttrium-Aluminium-Granat-Lasers (Er:YAG-Laser) zeigt keine Überlegenheit zu den oben genannten Methoden (Sgolastra, Petrucci et al. 2012). Eine weitere Methode zur subgingivalen Reinigung ist die antimikrobielle photodynamische Therapie, die in den späten 1990er-Jahren eingeführt wurde und entweder allein oder in Kombination mit der subgingivalen Instrumentierung angewendet werden kann. Bei der photodynamischen Therapie wird ein Photosensibilisator in die parodontale Tasche appliziert und die anschließende Belichtung mit einem niedrigenergetischen Laser führt zur Abtötung parodontaler Bakterien. Bislang konnte ein kurzzeitiger klinischer Effekt der photodynamischen Therapie in Kombination mit der subgingivalen Instrumentierung gezeigt werden. Die alleinige Anwendung dieser Therapie führt hingegen zu keinen besseren Ergebnissen als das subgingivale Debridement (Sgolastra, Petrucci et al. 2013).
Bringt der Einsatz von Antiseptika etwas?
Eine zusätzlich zum Debridement durchgeführte Spülung von antibakteriellen Spüllösungen oder Instillation von Gelen in die parodontale Tasche bringt nach heutigem Kenntnisstand keinen weiteren klinischen Vorteil (Oosterwaal, Mikx et al. 1991, Greenstein, Research et al. 2005).
Systemische Effekte der Parodontitistherapie
In seltenen Fällen kann es nach der subgingivalen parodontalen Therapie zum Auftreten von Fieberschüben kommen, was als Reaktion (Shwartzman-Reaktion) auf das plötzliche Freisetzen relativ großer Mengen parodontopathogener bakterieller Endotoxine angesehen wird (Quirynen, Mongardini et al. 2000). Ebenso ist bekannt, dass direkt im Anschluss an ein Scaling eine sehr kurzzeitige Verschlechterung der kardiovaskulären Parameter auftritt (Tonetti, D'Aiuto et al. 2007), wahrscheinlich über denselben Mechanismus vermittelt. Langfristig scheint die Behandlung der Parodontalerkrankung durch eine antiinfektiöse Therapie hingegen nur positive Effekte zu haben (Kebschull, Demmer et al. 2010, Jepsen, Kebschull et al. 2011).
Adjuvante Antibiose
Beim Großteil der Parodontitispatienten stellt die mechanische Instrumentierung eine ausreichende Form der Biofilmentfernung dar. In speziellen Situationen ist es allerdings sinnvoll, ergänzend zum subgingivalen Debridement eine adjuvante Antibiose durchzuführen. Hier ist zu unterscheiden, ob das Antibiotikum lokal oder systemisch verabreicht wird. Entscheidend bei beiden Anwendungsformen ist, dass zuvor der subgingivale Biofilm zerstört wurde. Durch die Organisation der Bakterien kann das Antibiotikum sonst nicht ausreichend in den Biofilm penetrieren und sich speziell gegen die parodontalpathogenen Bakterien richten. Daher sollte der Patient die Antibiose nach Abschluss des subgingivalen Debridements beginnen. Eine aktuelle Studie zeigt einen klinischen Vorteil, wenn schwere Fälle direkt – und nicht erst im zweiten Schritt, also nach Fehlschlagen der initialen antiinfektiösen Therapie ohne adjuvante Antibiose – in Kombination mit einem systemischen Antibiotikum behandelt werden (Griffiths, Ayob et al. 2011).
Eine adjuvante Antibiose wird insbesondere bei schwerer generalisierter chronischer (Ehmke, Moter et al. 2005, Cionca, Giannopoulou et al. 2009) und aggressiver (Guerrero, Griffiths et al. 2005) Parodontitis sowie bei Parodontitiden als Manifestation einer Systemerkrankung empfohlen. Der Wirkstoffcocktail aus Metronidazol und Amoxicillin hat sich hierbei am besten zur Reduktion der Taschentiefen bewährt (Sgolastra, Gatto et al. 2012, Zandbergen, Slot et al. 2013), und zwar unabhängig (Cionca, Giannopoulou et al. 2010, Mombelli, Cionca et al. 2013) von der subgingivalen Keimflora (vgl. Ausführungen zur mikrobiologischen Diagnostik im Teil 1 des Artikels). Insgesamt führt der Einsatz von adjuvanten systemischen Antibiotika bei Patienten mit schwerer Parodontitis zu einer Reduktion der Anzahl von Taschen, die nach der antiinfektiösen Therapie einer weitergehenden korrektiven (chirurgischen) Therapie bedürfen (Mombelli, Cionca et al. 2011).
Reevaluation
Zeitpunkt
Nach vier bis zwölf Wochen sollte eine erneute Messung des Attachmentstatus erfolgen. Ein früherer Zeitpunkt ist nicht sinnvoll, da das parodontale Gewebe einen drei- bis vierwöchigen Zeitraum für erste Reorganisationsvorgänge benötigt. Nach drei Monaten kommt es zu keiner zusätzlichen klinischen Attachmentbildung (Caton, Proye et al. 1982).
Erwartete Ergebnisse
Die parodontale Ausheilung erfolgt histologisch hauptsächlich reparativ, also durch Ausbildung eines langen Saumepithels. Der Erfolg des mechanischen Debridements zeigt sich in einer Reduktion der Sondierungswerte. Diese Reduktion ergibt sich zum einen durch den Gewinn an klinischem Attachment sowie einer Ausprägung von Rezessionen. Bei der Effektivität der Debridements wird zwischen einwurzeligen und mehrwurzeligen Zähnen unterschieden. Das Ausmaß der Sondierungstiefenreduktion ist abhängig von der initialen Sondierungstiefe. Bei Ausgangssondierungswerten von 4 mm bis 6 mm kann eine durchschnittliche Sondierungstiefenreduktion von 1,29 mm mit einem Gewinn an klinischem Attachment von 0,55 mm erreicht werden. Initiale Taschentiefen von ≥ 7 mm zeigen eine durchschnittliche Reduktion der Sondierungswerte von 2,16 mm mit einem Attachmentgewinn von 1,19 mm. Werden hingegen Zähne mit Sondierungswerten bis zu 3 mm instrumentiert, kommt es sogar zu einem Attachmentverlust (Cobb 1996). Der Therapieerfolg wird auch durch andere Faktoren beeinflusst. Der Zahntyp und die Zahnform spielen ebenfalls eine Rolle. So ist bekannt, dass furkationsbetroffene mehrwurzelige Zähne aufgrund der schwer zu reinigenden Furkationsregion ein schlechteres Ansprechen auf die mechanische Therapie zeigen. Ebenso beeinflussen anatomische Besonderheiten wie Schmelz- oder Zementperlen sowie Wurzelkonkavitäten oder auch patientenbezogene Faktoren wie das Vorliegen von systemischen Faktoren (unter anderem Diabetes mellitus, Stress, Aids, Immundefizienz) den Erfolg der subgingivalen Instrumentierung.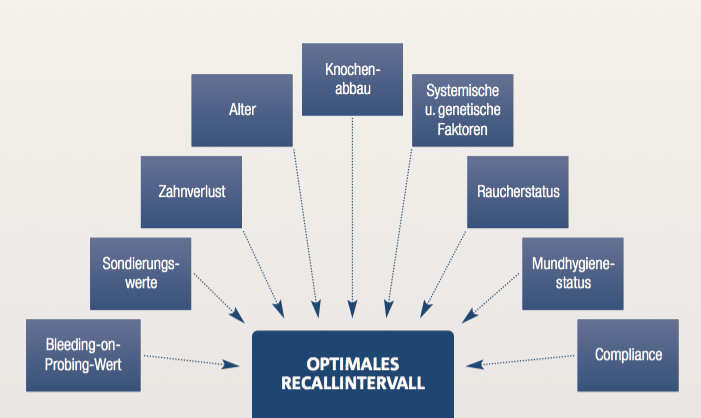
Abb. 2.10: Faktoren, die das optimale UPT-Intervall bestimmen: Das parodontale Recallintervall wird durch das individuelle Parodontitisrisiko unter Berücksichtigung von zahn- und patientenbezogenen Faktoren festgelegt. Hierdurch ergeben sich je nach Risiko UPT-Intervalle von zwölf, sechs oder drei Monaten. Das Risiko wird im Laufe der Zeit regelmäßig reevaluiert und die Intervalle des unterstützenden Parodontitisprogramms bei Bedarf angepasst. Die korrekte Festlegung und Einhaltung des Intervalls ist für den langfristigen Zahnerhalt von entscheidender Bedeutung, da ein Wiederauftreten der parodontalen Erkrankung frühzeitig erkannt werden kann.
Was tun bei Resttaschen?
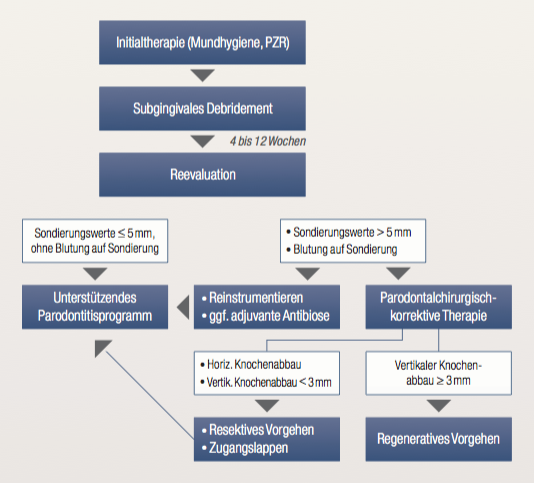
Werden bei dem Reevaluationsattachmentstatus Sondierungswerte > 4 mm oder 4 mm mit Blutung auf Sondieren gemessen, müssen diese Taschen erneut instrumentiert werden. In Abhängigkeit vom Ausmaß der Resttaschen muss über den weiteren Therapieverlauf entschieden werden. Liegen nur wenige Resttaschen mit ≤ 5 mm vor, kann der Patient in das unterstützende Parodontitisprogramm überführt werden. Beim Vorhandensein von Taschen > 5 mm sowie fortgeschrittener Furkationsbeteiligung sollte ein korrektiv-parodontalchirurgisches Vorgehen in Betracht gezogen werden (siehe Abbildung 2.1 und Teil 3 dieser Artikelserie).
Während der Reevaluation erhält der Patient erneute Mundhygieneinstruktionen. Aufgrund der mit der parodontalen Ausheilung einhergehenden Rezessionsbildung kann es durchaus vorkommen, dass die freiliegenden Interdentalräume breiter werden, was eine Anpassung der Interdentalpflegehilfsmittel zur Folge hat, um den Biofilm effektiv in diesem Bereich zu entfernen.
Unterstützende Parodontitistherapie (UPT, Recall)
Die regelmäßige professionelle supra- und subgingivale Entfernung des Biofilms ist eine grundsätzliche Voraussetzung für den Langzeiterfolg der Parodontitistherapie. Daher ist es entscheidend, dass der Patient in ein für seine parodontale Situation angepasstes UPT-Intervall einbezogen wird (Axelsson, Nystrom et al. 2004).
Welches Intervall für meinen Patienten?
Das parodontale Recallintervall wird anhand verschiedener Faktoren festgelegt, die das Parodontitisrisiko beurteilen. Berücksichtig werden neben der Anzahl an Resttaschen und dem Bleeding-on-Probing-Wert, die Anzahl verlorener Zähne (ohne Weisheitszähne) sowie der vorhandene durchschnittliche Knochenabbau (siehe Abbildung 2.10). Weiterhin spielen patientenbezogene Faktoren eine Rolle, wie das Alter, der Zigarettenkonsum und systemische wie genetische Faktoren. So ergibt sich ein niedriges, mittleres oder hohes Parodontitisrisiko mit UPT-Intervallen von zwölf, sechs oder drei Monaten (Lang und Tonetti 2003). Das Risiko wird im Laufe der unterstützenden Parodontitistherapie ebenfalls regelmäßig überprüft und die Intervalle bei Bedarf angepasst. Um ein Wiederauftreten der parodontalen Erkrankung frühzeitig zu erkennen und Zahnverlust zu vermeiden, ist die korrekte Festlegung und Einhaltung des Intervalls von entscheidender Bedeutung (Drisko 2001). 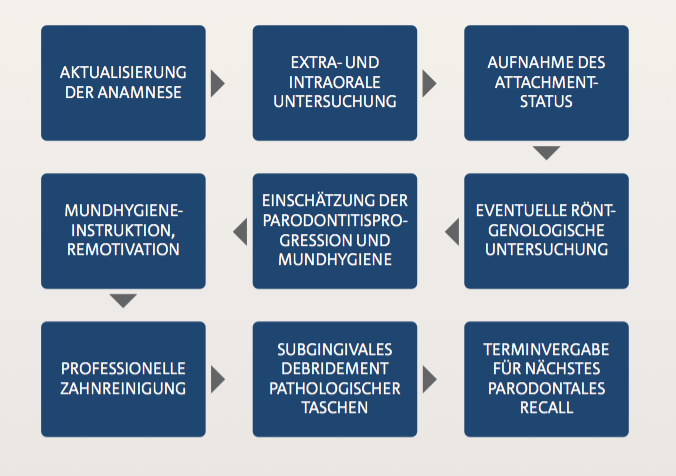
Abb. 2.11: Ablauf einer Sitzung der unterstützenden Parodontitistherapie: Die regelmäßige Aktualisierung der allgmeinen Anamnese sollte neben der eingehenden intra- und extraoralen Untersuchung integraler Bestandteil der unterstützenden Parodontitistherapie sein. Nach der Aufnahme des Attachmentstatus erfolgt die supragingivale Reinigung aller Zähne sowie die subgingivale Instrumentierung von Taschen mit Sondierungswert > 4 mm oder 4 mm mit Blutung auf Sondieren. Essenziell ist die Aufnahme der Mundhygieneparameter mit einer erneuten Mundhygieneinstruktion und -motivation. Die röntgenologische Verlaufskontrolle ist kein obligater Bestandteil der unterstützenden Parodontitistherapie, allerdings im Einzelfall sinnvoll unter anderem zur Beurteilung vertikaler Defekte, regenerativer Prozesse oder bei Verdacht auf Paro-Endo-Läsionen.
In der Abbildung 2.11 sind die durchzuführenden Behandlungsschritte im parodontalen Recall dargestellt. Die regelmäßige Aufnahme der Plaque- und Blutungsindizes ist ein wichtiger Bestandteil des parodontalen Recalls. Durch diese Indizes ergeben sich Hinweise auf die Effektivität der häuslichen Mundhygiene des Patienten, die gegebenenfalls durch erneutes Training oder Adaption der Mundhygienehilfsmittel optimiert werden muss. Im Anschluss erfolgt die Entfernung aller harten und weichen supragingivalen Beläge. Nach der Messung des klinischen Attachmentstatus werden alle pathologischen Taschen, also alle Stellen mit Sondierungswerten von 4 mm mit Blutung und mit Sondierungswerten ≥ 5 mm, reinstrumentiert, um das subgingviale Keimreservoir zu reduzieren. Die subgingivale Reinigung kann mit Hand-, Schall- oder Ultraschallinstrumenten erfolgen (vgl. Abbildung 2.8).
Pulverstrahlgeräte bei der UPT
Seit einigen Jahren rücken zu diesem Zweck Luft-Pulverstrahlgeräte immer mehr in den Fokus (Abbildung 2.9). Vorteil dieser Pulverstrahlgeräte ist eine sehr gründliche und dabei minimal traumatisierende Entfernung des mikrobiellen Biofilms bis in eine subgingivale Tiefe von 5 mm bei weitgehender Schonung des Hartgewebes der Zahnwurzel (Petersilka 2011). Um Weichgewebsschäden zu vermeiden, ist es wichtig, dass für die subgingivale Reinigung ausschließlich wenig-abrasives Glyzinpulver verwendet wird und nicht Natriumbicarbonatpulver, welches häufig für die supragingivale professionelle Zahnreinigung benutzt wird. Da die Zahnoberfläche durch die Anwendung des Glyzin-Wasser-Gemischs bereits feinpoliert ist, ist eine zusätzliche Nachpolitur mit einer Polierpaste nicht notwendig, wodurch es zur Kosten- und auch Zeitersparnis kommt.
Die röntgenologische Verlaufskontrolle während der unterstützenden Parodontitistherapie ist nicht in jedem Fall als obligat anzusehen. Sinnvoll ist die zusätzliche Anfertigung eines Röntgenbildes, unter anderem zur Beurteilung vertikaler Defekte, regenerativer Prozesse oder bei Verdacht auf Paro-Endo-Läsionen. Anzeichen für eine Rekurrenz der Parodontitis sind, wenn der Bleeding-on-Probing-Wert ansteigt, die Sondierungstiefen größer werden, röntgenologisch ein Knochenabbau erkennbar ist und die Zahnmobilität ansteigt (Chace 1977). Daher ist es wichtig, alte Befunde gut zu dokumentieren und mit den aktuellen zu vergleichen, um so schneller ein Parodontitisrezidiv zu identifizieren und therapieren zu können.
Eine aktuelle Literaturliste finden Sie hier.
Bitte beachten Sie, dass CME-Tests nach zwei Jahren ihre Gültigkeit verlieren.