Parodontologie 26.03.2013
Pathogenese der Parodontitis bei rheumatologisch erkrankten Patienten
share
In letzter Zeit wurde immer deutlicher, dass eine Assoziation zwischen Parodontitis (PD) und dem Risiko von systemischen Erkrankungen besteht. PD und rheumatologische Erkrankungen wie rheumatoide Arthritis (RA) weisen gemeinsame pathogenetische und immunpathologische Aspekte auf. Von Jacqueline Detert*, Nicole Pischon** und Frank Buttgereit*, Berlin.
80 bis 90 Prozent der Bevölkerung weisen chronische, plaqueassoziierte Entzündungen der Gingiva und des Parodonts auf.1–9 Somit gehören diese Entzündungen zu den häufigsten Erkrankungen des Zahnhalteapparates.1–9 Dabei entwickelt sich zunächst eine primär bakteriell verursachte Entzündung des marginalen Parodontiums, die Gingivitis. Einerseits ist die Menge und Virulenz der Mikroorganismen und andererseits der Immunstatus des Betroffenen Grundlage dafür, ob sich die Gingivitis bis zur parodontalen Destruktion als Parodontitis (PD) weiterentwickelt3, 10, 11
Wichtigste Risikofaktoren
Neben allgemeinen Funktionsunterschieden im angeborenen sowie erworbenen Immunsystem zur Abwehr pathogener Bakterien spielen neben der Mundhygiene nach gegenwärtigem Wissensstand noch weitere Risikofaktoren eine Rolle für die Entwicklung einer PD und deren Erscheinungsbild. Als Risikofaktoren wurden Adipositas, Unterschiede in der Ernährungsform als auch alterstypische Veränderungen identifiziert, aber auch Stress, Nikotin- und Alkoholabusus, der sozioökonomische Status, eine Reihe genetischer Faktoren (u.a. Polymorphismen, HLA-Gen-Assoziationen) als auch systemische Erkrankungen (u.a. Diabetes mellitus, Osteoporose, Atherosklerose, Myokardinfarkt, Apoplex) identifiziert werden.12, 140, 141 Aber auch Patienten mit einer PD weisen ein erhöhtes Risiko für systemische Erkrankungen auf.23 Die „parodontale Medizin“ beschäftigt sich mit der Untersuchung dieser Zusammenhänge. In den vergangenen Jahren ist auch eine Assoziation zwischen der PD und rheumatologischen Erkrankungen (RA, Sjögren-Syndrom) bekannt.
Chronische PD
Entzündliche Parodontalerkrankungen wurden lange Zeit als unspezifische Infektionskrankheit angesehen. Inzwischen wird davon ausgegangen, dass nicht primär die Quantität bakterieller Plaques,25 sondern qualitative Plaqueveränderungen sowie das Überwuchern von parodontalpathogenen Keimen die Entzündungsreaktion verursachen.26 Insbesondere gram-negative, anaerobe Bakterien bilden auf der Zahnoberfläche als bakterielle Plaque einen Biofilm,27 wobei derzeit 20 Bakterienspezies bekannt sind, die eine PD auslösen können. Dazu gehören Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythia oder Aggregatibacter actinomycetemcomitans.28–30 Die Bakterien erhalten mit dieser Biofilmbildung einen Schutz vor immunologischen Abwehrmechanismen des Wirtes als auch vor antibiotischen Wirkstoffen33 und Mundhygienemaßnahmen, wodurch deren Pathogenität enorm gesteigert wird.32 Unter Umgehung der Abwehrmechanismen mit Leukotoxinen und immunglobulinspaltende Substanzen32 synthetisieren sie eine Reihe toxischer Substanzen (LPS; Zytokine), und Enzyme (neutrale Phosphatasen, Kollagenasen), die gewebedestruierend wirken34, 35 und die Immunantwort mit der Bildung von verschiedenen Abwehrzellen und Antikörperbildungen provozieren.31–34 Die Unterbrechung des Entzündungskreislaufes mit Progress der PD ist nun abhängig von der Immunreaktion des Wirtes und therapeutischer Möglichkeiten. 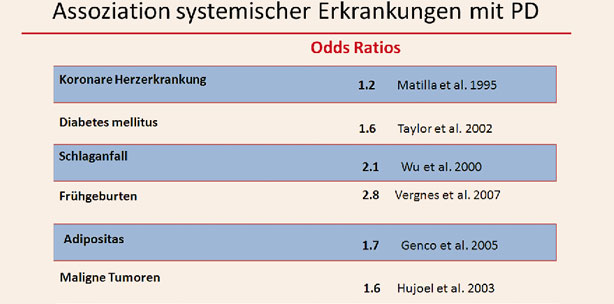
PD und rheumatoide Arthritis (RA)
Die RA weist ähnlich wie die PD als chronisch entzündliche Gelenkerkrankung einen Verlust von bindegewebigen und mineralisierten Strukturen auf. Klinisch und histologisch stellt sich das Bild einer Synovitis als Ausdruck der Akkumulation eines proinflammatorischen Zellinfiltrates dar. Diese wird als Ursache für den Abbau von Knochen- und Knorpelgewebe im Gelenk angesehen. Die Ätiologie der RA ist unverändert unklar, wobei auch hier individuelle Faktoren, wie z. B. Alter und Geschlecht, genetische Faktoren (z.B. HLA-Genotyp) als auch Umweltfaktoren (Nikotin- und Alkoholkonsum) diskutiert werden.65–67, 90 Bei beiden Erkrankungen scheint die Reaktion auf einen Entzündungsreiz überschießend und möglichweise fehlgesteuert zu sein. Auch für die RA konnten ebenso wie bei der PD hohe Anteile entzündungsfördernder Zytokine (IL-1, IL-6 und TNF-a) nachgewiesen werden. Eine PD kann möglicherweise den Verlauf einer RA beeinflussen, aber nicht den Schweregrad der Synovitis.92–94
Periodontale Infektionen und RA
Durch den Nachweis bakterieller anaerobischer DNA und hohem Antikörpertiter gegen Anaerobier im Serum als auch in der Synovialflüssigkeit68–70, 89, 91, 141 und die Behandlungserfolge mit verschiedenen Antibiotika bei RA-Patienten (z. B. Ornidazol, Levofloxacin und Clarithromycin)78–80 werden Infektionen, vor allem orale Infektionen,71–73 immer wieder ursächlich für die Erkrankung diskutiert. Dabei wird angenommen, dass pathogene Bakterien der Mundhöhle eine chronische Bakteriämie unterhalten und zu einer potenziellen Schädigung anderer Organe (Gelenk, Endokard) führen können.74, 75 Vor allem weisen PD-Patienten ein höheres Risiko für eine Bakteriämie auf.76 Insbesondere P. gingivalis scheint sowohl in der Entstehung und Progression der PD als auch im Prozess dieser Bakteriämie eine Rolle zu spielen.77 Das Bakterium kann die Epithelintegrität beeinträchtigen78 und in humane Endothelzellen eindringen als auch die Transkription und die Proteinsynthese beeinflussen.79, 80 Damit ist der systemische Zugang der Bakterien zum Blutkreislauf und anderen Organsystemen gewährleistet. Mithilfe der LPS sind sie in der Lage, den Abbau von extrazellulärer Knorpelmatrix in Knorpelexplantatkulturen zu initiieren.81–84 P. gingivalis ist das derzeit einzige bekannte Bakterium, welches die Peptidyl-Arginin-Deiminase (PAD) exprimieren kann und somit einen wichtigen Pathogenitätsfaktor der RA darstellt.85–88 Die PAD existiert beim Menschen in fünf Isoformen, wobei die Isoform 4 (PADI4) als die wichtigste für die Autoimmunität gilt. Die PADI4 findet sich in vielen Zellen, wie T- und B-Lymphozyten, Neutrophilen, Eosinophilen, Monozyten und natürliche Killer(NK)-Zellen als auch in den Makrophagen der Synovia. Eigentlich ist das PADI4-Enzym inaktiv, aber bei oxidativem Stress oder während der Apoptose gelangt Kalzium in die Zellen und aktiviert dieses Enzym.95 Es kommt zur Citrullinierung von Vimentin, Fibrin, Kollagen und der a-Enolase und somit zur Erhöhung der Antigenität.
Die Citrullinierung ist ein weit verbreitetes Phänomen in der normalen Physiologie und bei der Entzündung.87 Daraus entstehende modifizierte Proteine (Anti-Protein-Citrullin-Antikörper; APCA) werden in mehr als 80 Prozent der RA-Patienten gefunden.96, 97 Die PAD von P. gingivalis weist keine vollständige Homologie zur humanen PAD auf,88 aber die Fähigkeit von P. gingivalis, Proteine zu citrullinieren, ist einzigartig. Dabei generiert es citrullinierte Wirtspeptide durch proteolytische Spaltung von Arg-X-Peptidbindungen mit Arginin-Gingipainen, worauf die Citrullinierung der carboxy-terminalen Arginine durch die bakterielle PAD97 folgt. Diese durch P. gingivalis vermittelte Citrullinierung von Bakterien- und Wirtsproteinen kann somit einen molekularen Mechanismus zur Erzeugung von Antigenen darstellen, der die autoimmune Antwort bei RA triggern könnte.97 Möglicherweise fördern parodontale Infektionen mit Pathogenen wie P. gingivalis in Assoziation mit einer genetischen Prädisposition entzündliche Erkrankungen wie die RA bzw. wirken sich immunregulierend auf den RA-Verlauf aus.89, 98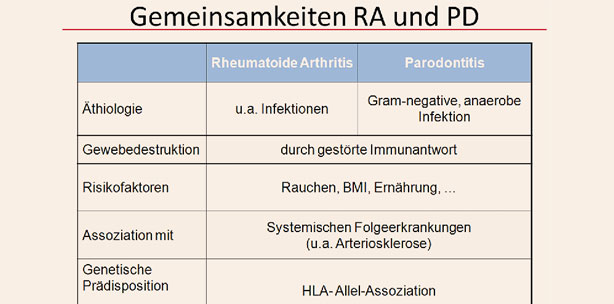
Rheumafaktor bei der PD
Interessanterweise konnte der Rheumafaktor in der Gingiva, der subgingivalen Plaque und im Serum von PD-Patienten nachgewiesen werden, der üblicherweise bei der RA und anderen chronischen Erkrankungen vorhanden ist.99 Dabei lassen sich bei seropositiven PD-Patienten erhöhte IgG- und IgM-Antikörpertiter gegen orale Mikroorganismen nachweisen.100 Des Weiteren zeigte der Rheumafaktor seropositiver Patienten eine Kreuzreaktion mit oralen bakteriellen Epitopen.101 Die P. gingivalis Proteinase als wichtigster Virulenzfaktor für das Wachstum und die Gewebezerstörung ist für die Epitop-Entwicklung in der RF-Fc-Region verantwortlich.102 Der Rheumafaktor hat allerdings keinen Einfluss auf die parodontale Situation und auf die Mikroorganismen.103
Genetische Assoziation, Virulenzfaktoren und PD
- HLA-DR: Wie bei der RA gibt es Kandidatengene, HLA-DR-Polymorphismen, die möglicherweise mit einer erhöhten wirtsgebundenen erhöhten Anfälligkeit des Immunsystems für eine PD verbunden sind, insbesondere HLA-DR4 codierende DRB1*04-Allele.104 Dabei wurde insbesondere ein Zusammenhang zwischen HLA-DRB1 Shared Epitope (SE) und schwerer PD (chronische/aggressive), stratifiziert nach ethnogeografischer Herkunft gefunden.105 Bei PD-Patienten wurde mit einem Anteil von 42 Prozent häufiger einer der DRB1-Subtypen *0401, *0404, *0405 oder *0408105 nachgewiesen, wobei diese Subtypen auch bei anderen Entzündungskrankheiten (unter anderem RA) vorkommen.106 Beim Subtypus HLA-DRB1*0401 kommt es zur CD4+-T-Zellen-Aktivierung, die ihrerseits den Prozess der ACPA-Bildung initiieren,107 wobei Vimentin ein Kandidatenprotein für die T-Zell-Erkennung ist.108
- Protein Tyrosin Phosphatase Gen – PTPN22: Das Gen kodiert die Tyrosin-Phosphatase mit einer wichtigen Funktion in der Regulation der T- und B-Zellaktivierung. Insbesondere beim Rauchen, das vor allem für die ACPA-positive RA mitverursachend scheint und einen nachweisbaren Zusammenhang zu HLA-DRB1-Allele – SE zeigt,109 liegt offenbar eine additive Interaktion zu PTPN22 vor.110
- Terminaler Galaktosemangel des IgG RF: Immunglobuline der Klasse IgG fungieren als Antigene, wobei bei RA-Patienten das IgG anders glykolysiert vorliegt. Bei 60 Prozent fehlt in den Kohlenhydratgruppen des Fc-Teils die terminale Galaktose im Vergleich zu Gesunden und geht mit einer schlechteren Prognose im Krankheitsverlauf einher.111 Prevotella melaninogenica kann als saccharolytisches Bakterium an der Fc-Region des IgG-Moleküls binden und Galaktose mit seinem Enzym metabolisieren.112 Andererseits gibt es auch Bakterien, die durch Galaktose (Gal) oder Nacetylgalaktosamine (GalNAc), unter anderem Kohlehydrate, gehemmt werden.113 Untersuchungen zeigen, dass hypogalaktosylierte Glykoformen vor allem im Stadium der Gingivitis vorkommen111 und Patienten schwerer PD ebenfalls weniger Galaktose in ihren Zuckerketten enthalten.112
- Superantigene und Hitzeschockproteine: Am variablen Teil der beta-Kette des T-Zellrezeptors (TCR) befindet sich die Region V beta (Vb), die als Bindungsstelle für Superantigene identifiziert wurde. Superantigene als hitzestabile, hydrophile Moleküle sind imstande, TCR und MHC II-Molekül quasi miteinander zu „verkleben“,113 wodurch ein Dauersignal in der T-Zelle ausgelöst wird.114 T-Zellrezeptoren des Vß-Genes (Vß -6, -8,-14, -17) sind bei RA-Patienten häufiger als in der Kontrollgruppe.115, 116 P. intermedia kann ähnlich die Expression von Vß-8 und Vß-17 Gene in CD4(+)-T-Zellen spezifisch stimulieren.117 P. gingivalis und P. intermedia steigern die Expression von Vß-6 und Vß-8 (Superantigene bei RA).118
Hitzeschockproteine (HSPs), die die Zelle vor Stress schützen, werden ebenfalls mit der Pathogenese der RA in Verbindung gebracht119–123 und im Serum als auch der Synovia von RA-Patienten ein hoher Level oraler bakterieller 70 kDa-HSP gefunden.90, 124 P. melaninogenica-HSP und P. intermedia-HSP wurden ebenfalls im periodontalen Erkrankungsprozess nachgewiesen.126 Allerdings sind Superantigene und HSP nicht spezifisch für orale Bakterien.125
Neben diesen genannten Virulenzfaktoren gibt es eine Reihe weiterer Enzyme und genetischer Polymorphismen, die sowohl den Entzündungsprozess bei RA und PD unterhalten als auch für den Abbau der Interzellularsubstanzen und des kollagenen Stützgerüstes ursächlich sind und im Zusammenhang beider Erkrankungen weiter erforscht werden müssen.
Autoimmunerkrankungen und parodontale Mikrozirkulation
Bei vielen Autoimmunerkrankungen sind mikrovaskuläre Veränderungen oft die ersten Veränderungen im Erkrankungsverlauf. So zeigte sich bei RA-Patienten im Vergleich zu den gesunden Probanden kaliberreduzierte und elongierte Kapillaren als auch eine erhöhte Anzahl,127 im Gegensatz zu Patienten mit einer progressiven Sklerodermie mit einer reduzierten Kapillaranzahl, einem größeren Kapillardurchmesser und einer vermehrten Schlängelung.128 Mit dem Sjögren-Syndrom ist eine Änderung an den Kapillaren und die Beschaffenheit der interdentalen Mikrozirkulation in Form von reduzierten Kapillarkalibern mit einer größeren Anzahl an Kapillaren und eine vermehrte Schlängelung der Kapillarschlingen verbunden.129 Eine aktuelle Untersuchung zeigte bei Patienten mit einem systemischen Lupus erythematodes eine vermehrte Kapillardichte.130 Bei den bisher untersuchten Erkrankungen gibt es zu dieser nachweisbaren veränderten Mikrozirkulation deutliche Zusammenhänge im Auftreten von PD.
Hier geht's zur Großansicht.
PD und weitere Autoimmunerkrankungen
- Sjögren-Syndrom: Im Verlauf des Sjögren-Syndroms akkumulieren die Patienten sehr schnell bakterielle Zahnplaque aufgrund der abnehmenden Speicheldrüsensekretion.131 Dabei zeigen sich häufig höhere Plaquewerte, Sulkusblutungen, höhere Sondierungstiefen und ein vermehrter Parodontalindex sowie ein damit verbundender erhöhter Attachmentverlust im Vergleich zu gesunden Probanden. Antikörper gegen Streptococcus oralis sind bei Sjögren-Patienten deutlich niedriger, dagegen zeigen sie höhere Antikörpertiter gegen Actinobacillus actinomycetemcomitans und P. gingivalis.132, 133 Auch für Sjögren-Patienten wurde ein erhöhtes Risiko für die Entwicklung einer parodontalen Erkrankung (Odds Ratio 5.5) nachgewiesen,134 wobei die gingivale Inflammation beim primären Sjögren-Syndrom häufiger vorhanden ist.135
- Progressive systemische Sklerose (PSS): Bei PSS-Patienten zeigt sich eine mangelhafte gingivale Durchblutung im Bereich der Gingiva, die sowohl in der Kapillarmikroskopie als auch durch einen verminderten vaskulären endothelialen Wachstumsfaktornachweis (insbesondere VEGF-A und VEGF-C) dargestellt werden kann. Als PD-Vorstufe zeigen sich häufig entzündliche Infiltrate.136, 137 Als Folge der Xerostomie und Mikrostomie ist bei diesen Patienten mit weiteren entzündlichen Veränderungen und Verlusten des Zahnhalteapparates zu rechnen.166
- Spondyloarthritis ankylosans (AS): Die AS gehört zu den bewegungseinschränkenden Erkrankungen, die in der Folge durch eine eingeschränkte Mundhygiene zu einer Plaqueakkumulation und somit zu einer PD führen kann.138, 139
Die vollständige Literaturliste finden Sie hier.
Autoren: Jacqueline Detert*, Nicole Pischon** und Frank Buttgereit*
* Charité – Universitätsmedizin Berlin, Klinik m.S. Rheumatologie und Klinische Immunologie
**
Charité – Universitätsmedizin Berlin, Centrum für Zahn-, Mund- und
Kieferheilkunde, Abt. für Zahnerhaltungskunde und Parodontologie










