Prophylaxe 28.02.2011
Leitlinien mikrobiologischer Untersuchungen
share
Dank der breiteren Anwendung im Bereich der parodontologischen Diagnostik erlaubt das bakteriologische und immunologische Labor nun klare Aussagen bezüglich der Prognose einer Parodontitis. Vielfach bestehen in Praxen aber noch Fragen zur korrekten Anwendung der Tests.
Der folgende Artikel soll als praktischer Leitfaden dienen, der dem Leser in der Parodontitistherapie und auch im Bereich der Implantologie klare Vorschläge macht zu den Themen:
- Anwendung der Tests
- wie korrekt interpretiert wird
- welche Konsequenzen in der Praxis aus den Testergebnissen gezogen werden können.
Parodontologie
Leitlinien für die Anwendung der bakteriologischen Tests:
- Wann im Behandlungsablauf ist der mikrobiologische Test angebracht?
- Der optimale Zeitpunkt für einen Bakterientest ergibt sich aus der Frage: Was will man wissen?
Beispiele:
Wie ist die Ausgangsposition vor Beginn der Initialtherapie, wie stark die Keimbelastung?
- Test unmittelbar nach PZR, vor Beginn der PA-Therapie.
Ist es zu einer Reinfektion nach der Therapie gekommen?
- Test ca. drei bis vier Monate nach abgeschlossener aktiver Behandlungsphase der PA.
Wie viele Markerbakterien konnten durch die Initialtherapie beseitigt werden?
- Test unmittelbar nach Abschluss von Scaling/OP etc.
Der Zeitpunkt mit der höchsten Aussagekraft des Tests ergibt sich aus diesen Fragestellungen. Aus der mikrobiologischen Erfahrung lassen sich bestimmte Faustregeln für den Zeitpunkt der höchsten Empfindlichkeit des Tests formulieren: Testet man vor Beginn der Hygienisierungsphase, so kann evtl. Actinobacillus actinomycetemcomitans (A.a.) nicht nachgewiesen werden. Das hat nichts mit der Sensitivität der Tests zu tun, sondern mit den speziellen Virulenzfaktoren dieses Erregers. A.a kann anhand von Epitheliotoxinen die Gingivaepithelzellen invadieren und sich dort mittels Leukotoxinen gegen das Wirtsimmunsystem schützen. Insbesondere unter Bedingungen einer starken Keimbelastung des Sulkus wird Actinobacillus stärker gewebsinvasiv und ist dann unter Umständen in subgingivalen Proben nicht mehr nachweisbar. Zum Nachweis wäre dann in der Tat eine Gewebsbiopsie des Saum- oder Taschenepithels notwendig.
Einfacher ist es, den mikrobiologischen Test nach der Taschenreinigung durchzuführen. Dann nämlich wird A.a. wieder aus dem Gewebe in den Sulcus gingivalis freigesetzt und ist dann ohne Weiteres nachweisbar. Unter diesem wichtigen Aspekt sollte die Testung erst nach der Hygienisierungsphase oder weit in der aktiven Behandlungsphase erfolgen, nicht vor Beginn der Behandlung.
Durch den Test nach der Initialtherapie wird auch klarer, wie stark die Markerkeime durch die mechanische Behandlung beim einzelnen Patienten reduziert werden können. Dies ist individuell sehr unterschiedlich, abhängig vom lokalen Immunsystem. Praktisch gesehen heißt das, dass ein Patient mit der gleichen Belastung ( z.B. mit Tannerella forsythensis) mittels mechanischer Behandlung parodontal stabil zu halten ist, während ein anderer bei gleicher Therapie parodontalen Abbau erlebt. Eine zentrale Arbeit zum Thema Effizienz der mechanischen PA-Therapie stammt von Renvert und Kollegen. In einer Studie zum Effekt der mechanischen Therapie auf die subgingivale Keimbelastung prüften diese Autoren die Keimbelastung bei Patienten vor Initialtherapie und nach einem halben Jahr, am Endpunkt der aktiven Behandlungsphase. Die Patienten erhielten dabei innerhalb dieser halbjährigen Phase eine Schulung zur oralen Hygiene sowie PZR und subgingivale Reinigung ohne Limitierung, je nach klinischem Befund.
Daraus geht hervor, dass Actinobacillus durch mechanische Therapie nicht zu beseitigen war. Im Gegenteil wurde eine höhere Belastung am Ende der Behandlungsphase gefunden, was den Effekt der Rückverteilung von Actinobacillus aus dem Gewebe in den Sulkus nach der Therapie unterstreicht.
Die Belastung mit Porphyromonas gingivalis konnte durch die mechanische Therapie signifikant beeinflusst werden. Ob die Restbelastung klinisch relevant wird im Sinne der weiteren Destabilisierung des Parodonts, hängt von individuellen Faktoren ab, primär vom lokalen Immunsystem des Patienten. Einige Patienten sind auch unter Anwesenheit von P.g. zu stabilisieren, andere benötigen eine antibiotische Therapie zur weiteren Reduktion bzw. Eradikation dieses Erregers. Hier spielen auch Risikofaktoren eine entscheidende Rolle, vor allem das Rauchen.
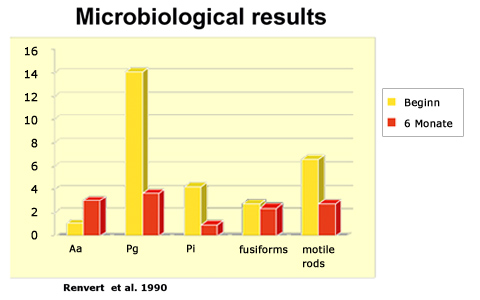
Abb. Subgingivale Belastung mit Markerbakterien vor und nach mechanischer PA-Behandlung. Gelbe Balken zeigen die Bakterienbelastung vor Beginn der Behandlung, rote Balken die Situation nach der aktiven Behandlungsphase von sechs Monaten Dauer. (A.a.: Actinobacillus, P.G.: Porphyromonas, P.i.: Prevotella intermedia, fusiforms: z.B. Fusobacterium nucleatum)
Der Nachweis von fakultativ pathogenen Erregern, z.B. Fusobakterien etc. bedeutet per se keine Gefahr für das Parodont. Aufgrund ihrer viel geringeren Virulenz genügt bei diesen Erregern in der Regel die mechanische Therapie, d.h. eine regelmäßige Reduktion der Gesamtbelastung mit Bakterien, um Stabilität zu erhalten. Achtung ist geboten lediglich bei signifikanter Beeinträchtigung des lokalen Immunsystems (Diabetes, Immunsuppressiva, Cytostatikatherapie, Nikotinabusus). Unter solchen Bedingungen können auch „nur“ fakultativ pathogene Bakterien klinisch relevant werden und eine aggressive Parodontitis auslösen.
Standardvorgehen bei der mikrobiologischen Testung
Zwanglos ergibt sich aus diesen Daten ein Vorschlag, wann am günstigsten eine mikrobiologische Testung bei PA-Patienten erfolgt:
- Mit der letzten Sitzung einer initialen Therapie, bei der die Hygienisierung/Wurzelglättung/full mouth desinfection abgeschlossen ist. Dabei ergibt sich die höchste Sensitivität für den Nachweis der hochagressiven PA-Markerkeime.
- Ein Tipp: bei der ersten mikrobiologischen Untersuchung die Endodontie-Papierspitzen poolen, d.h. an mehreren Entnahmestellen beproben und die Spitzen zusammenfassen zur Austestung. Dies erhöht die Nachweiswahrscheinlichkeit insbesondere für A.a., der oft nicht in jedem Sulkus anzutreffen ist.
- Nachtestung nach ca. drei bis sechs Monaten, um feststellen zu können, ob, und wenn ja, in welchem Ausmaß es zu einer Reinfektion gekommen ist (Reinfektion ist möglich durch direkten menschlichen Kontakt oder durch Persister, das sind Bakterien, welche die Antibiotikabehandlung z.B. in anatomischen Nischen überstanden haben.
- Zum Thema Persistenz von Erregern nach antibiotischer Therapie ist Folgendes zu beachten: Vor der antibiotischen Therapie ist die Keimbelastung mit mechanischen Mitteln so weit wie möglich zu reduzieren, um eine optimale Ausgangsbasis für die Wirkung des Antibiotikums zu erzielen. Dies ist insbesondere von Bedeutung bei Taschen >6mm an den Molaren. Hier befindet sich bis zu 80% der gesamten Keimbelastung des Parodontiums.
Implantologie
Immunologische Testung vor Implantologie
Wir berichteten bereits von ersten Daten zur Bedeutung des proinflammatorischen Botenstoffes IL-IB bei der Implantologie. Eine neue Arbeit von Laine et al. (Clin. Oral Impl. Res. 17, 2006/380–385) zeigt nun, dass eine Änderung in der Expression von IL-IRN (Interleukin-I-Rezeptor-Antagonist) mit Periimplantitis assoziiert ist. Solche Normvarianten von Genen werden Polymorphismen genannt.
Schon früher gab es Hinweise auf gehäufte Implantatprobleme bei bestimmten Personengruppen. Patienten, die bereits ein Implantat verloren haben, tragen z. B. ein höheres Risiko für weiteren Implantatverlust (Weyant and Burt, 1993), unabhängig von weiteren Risikofaktoren wie z.B. Rauchen und Stress (Lindquist et al. 1997).
Der immunologische Hintergrund dieser Beobachtung wird nun weit klarer. Der Regelkreis entzündungsfördernder und entzündungshemmender Mediatoren mit den Regulatoren Interleukin Beta und Interleukin-Rezeptorantagonist bestimmt das inflammatorische Geschehen auch im Sulcus gingivalis entscheidend mit. Bei einer bakteriellen Infektion reagiert der Körper mit der Bildung von Entzündungs-Mediatorsubstanzen, die durch Oberflächenproteine der Bakterien getriggert werden. Das proinflammatorische Cytokin IL-IB ist einer der wichtigsten Mediatoren. IL-IB regt die Knochenresorption an (Osteoklastenaktivität) und beeinflusst die Fibroblasten-Proliferation (Bindegewebsaufbau) negativ. Interleukin 1 ist bei Patienten mit Parodontitis im Sulkusfluid erhöht. Diese Wirkung wird herabreguliert durch den IL-IB-Rezeptor-Antagonisten IL-IRA, der an die gleichen Rezeptorstellen wie IL-IB bindet und dessen intrazelluläre Wirkung hemmt. Es handelt sich hier also um eine entzündungshemmende Botensubstanz.
Entgegen erster Hoffnungen, mit IL-IB einen Prognosemarker für die Parodontitis gefunden zu haben, zeigte sich, dass mit der Beurteilung von IL-IB alleine keine sicheren Aussagen bezüglich des Parodontitis-Risikos möglich waren. Die Situation änderte sich, sobald der Einfluss des Rezeptor-Antagonisten IL-IRA mit berücksichtigt wurde. Ab diesem Zeitpunkt war der Regelkreis vollständiger beurteilbar, also nicht nur der entzündungsfördernde Schenkel, sondern auch der entzündungshemmende. Die Arbeitshypothese, dass bei Personen mit erhöhter Entzündungsreaktion und zusätzlich verminderter Entzündungshemmung (also „ungebremster Hochregulation“) eine besonders starke Neigung zu aggressiv verlaufender generalisierter Parodontitis vorliegen könnte, bestätigte sich in weiteren Untersuchungen.
Als weiterer Schritt konnte nun die Bedeutung von IL-IRA als Prognosemarker nicht nur in der Parodontologie, sondern auch in der Implantologie überprüft werden. Der physiologische Zusammenhang sieht folgendermaßen aus:
Die Produktion des Interleukin-I Rezeptor-Antagonisten (IL-IRA) wird durch das Interleukin I RN-Gen (IL-IRN) reguliert. Bei einem Bevölkerungsanteil von 33% besteht eine Normvariante, ein sogenannter Polymorphismus dieses Gens, der dazu führt, dass diese Personen eine verminderte IL-IRA-Produktion haben. Das heißt, dass die Herabregulierung von entzündlichen Reaktionen weniger gut funktioniert. Entzündungsreaktionen verlaufen ungebremster. Dies hat keinen unmittelbaren Krankheitswert, aber beeinflusst unter Umständen den Verlauf von Infektionserkrankungen.
Laine et al. konnten nun an einer Gruppe von 120 Personen zeigen, dass Periimplantitis an Brånemark-Implantaten signifikant häufiger bei Personen mit dem IL-IRN-Genpolymorphismus auftrat. Der Einfluss von anderen wichtigen Risikofaktoren, wie z.B. Rauchen, Alter, Geschlecht, wurde berücksichtigt und die Ergebnisse um diese Faktoren korrigiert. Das heißt, dass damit ein eindeutig bestimmbarer Risikomarker für die Periimplantitis verfügbar ist: der Gentest auf IL-IRN – Interleukin-I Rezeptor-Antagonist. Prospektive Studien an Implantatträgern werden zeigen, ob dieser vielversprechende Marker praxistauglich ist.
Periimplantitis: ein zunehmendes Problem
Unabhängig von den Prognosemöglichkeiten entwickelt sich die Implantologie zu einem Hauptthema der oralen Mikrobiologie. Immer mehr osseointegrierte Implantate werden zum Ersatz verlorener natürlicher Zähne verwendet. Diese sinnvolle Therapie ist jedoch häufig mit Folgeproblemen behaftet: den periimplantären Infektionen. Dies kann zum Beispiel eine Infektion des implantatnahen Bindegewebes sein (Mukositis), aber auch eine Periimplantitis mit Verlust des Alveolarknochens, welcher wiederum zu einer Verminderung der Implantatintegration und in letzter Konsequenz zum Implantatverlust führt. Diese Situation ist sowohl für den Patienten als auch für den Zahnarzt wegen der verlängerten Behandlungsdauer, einhergehend mit neuen chirurgischen Eingriffen, äußerst unbefriedigend, abgesehen von den erhöhten Kosten und dem Zeitaufwand.
Seitenanfang
Frühversagen
Eine verhinderte Osseointegration kann zu einem Frühverlust innerhalb der ersten sechs Monate nach der Implantation führen. Gründe für das Frühversagen können sein:
- bakterielle Infektion während des Eingriffs
- schlechte Compliance/schlechte Nachsorge nach der Implantation, speziell bei „one-stage“ Implantaten
- mangelhafte chirurgische Technik
- zu frühe Belastung.
Spätversagen
Spätversagen ist bedingt durch pathologische Prozesse, die an einem vorher osseointegrierten Implantat auftreten. Häufig sind dies bakterielle Infektionen, die bedingt sind durch die Plaqueakkumulation an den Implantaten oder den Suprastrukturen. Diese Bakterienansammlungen führen zur Mukositis und eventuell Periimplantitis.
- Bei Patienten, die keine natürlichen Zähne mehr haben, ist die Periimplantitis mit einem Biofilm assoziiert, der fakultativ pathogene Bakterien wie z.B. Prevotella intermedia, Fusobacterium nucleatum und Peptostreptococcus micros beinhaltet. Hier können auch seltenere Erreger wie Enterobakterien (z.B. Escherichia coli) eine Rolle spielen.
- Bei Patienten, die noch natürliche Zähne besitzen, sind in der Regel die gleichen Bakterien die Verursacher einer Periimplantitis, welche auch die Parodontitis verursachen.
Beziehung zwischen Parodontitis und Periimplantitis
Wenn Parodontitis-Bakterien vor der Versorgung eines Patienten mit Implantaten nicht vollständig beseitigt werden, trägt dieser Patient ein höheres Risiko für die Entwicklung einer Periimplantitis. Wie bei der Parodontitis sind die wichtigsten Erreger Actinobacillus actinomycetemcomitans und Porphyromonas gingivalis (van Winkelhoff et al. 1999, 2001)
Konsequenz: Infektionskontrolle vor Implantatversorgung!
- vollständige Parodontalbehandlung mit Scaling, Wurzelglättung und Anleitung des Patienten zu verbesserter persönlicher Zahnhygiene
- mikrobiologischer Test auf Parodontitis-Bakterien und eventuell eine systemische antibiotische Therapie entsprechend des Testergebnisses
Kosten-Nutzen
Wenn eine Periimplantitis vorliegt, ist die Behandlung zeitaufwendig, teuer und der Erfolg sehr unsicher. Daher kommt der Prävention durch den Bakterientest und ggf. antibiotische Behandlung die größere Bedeutung zu, weil sie nachweisbar das Risiko für eine Periimplantitis verringert.
Wie wird getestet?
Probenahme in Zahntaschen von allen vier Quadranten und Übersendung zum mikrobiologischen Labor. Der Nukleinsäuretest erkennt mit höchster Sensitivität die wichtigsten Erreger für die Periimplantitis. Alternativ steht in speziellen Fällen auch die Kultur zur Verfügung, wenn der Verdacht auf das Vorliegen atypischer Erreger besteht.
Was tun bei einer Periimplantitis?
Vor der Behandlung sollte eine mikrobiologische Testung stattfinden, um entscheiden zu können, ob eine antibiotische Behandlung notwendig ist, und wenn ja, welche, oder ob die mechanische Behandlung ausreicht.
Seitenanfang
Leitsätze
- Verursacher der Periimplantitis sind die gleichen Bakterien, die auch zur Parodontitis am natürlichen Zahn führen: Actinobacillus actinomycetemcomitans/Porphyromonas gingivalis/Tannerella forsythensis/Peptostreptococcus micros/Fusobacterium nucleatum.
- Die Besiedlung der periimplantären Mukosa erfolgt rasch nach Versorgung mit dem Implantat.
- Der fehlende Desmodontalspalt und die erfolgte Osseointegration schützen nicht vor der Besiedlung mit Markerbakterien.
- Die Flora der Periimplantitis entspricht derjenigen der marginalen Parodontitis.
- Vor der Versorgung mit Implantaten muss die Mundhöhle frei sein von Parodontitis-Markerbakterien, sonst ist der Misserfolg vorprogrammiert.
- Die genetische Disposition zu einer starken Entzündungsreaktion trägt neben der Besiedlung mit Markerbakterien entscheidend zur Periimplantitis bei. Diese Disposition ist messbar (Interleukin-Gentest).
Der sichere Weg zum implantologischen Erfolg ist präoperativ das Vorhandensein von Parodontitis-Bakterien auszuschließen. Wenn Bakterien nachgewiesen werden, gibt die folgende Tabelle Anhaltspunkte für das korrekte Vorgehen in Abhängigkeit von Art und Anzahl der nachgewiesenen Markerkeime.
Mikrobiologische Testung vor Implantologie
Leitlinien für die Beurteilung des Mikrobiologischen PA-Tests vor Implantologie: Welche therapeutischen Konsequenzen müssen aus dem Ergebnis des Bakterientests (PMT) vor der Implantation gezogen werden?
Nachweis von Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis.
Risiko: Erhöhtes Risiko für Periimplantitis.
Konsequenz: Eradikation, ggf. auch mit antibiotischer Therapie, diese Erreger dürfen zum Zeitpunkt der Implantation nicht in der Mundhöhle vorhanden sein, auch nicht in geringer Zahl.
Vorgehen: Etwa zwei bis vier Wochen vor Implantat-OP vollständige subgingivale Reinigung, antibiotische Therapie entsprechend der Therapieempfehlung, ein bis zwei Wochen nach Abschluss der Therapie Nachtestung. Wenn Actinobacillus und/oder Porphyromonas nicht mehr nachweisbar sind, kann implantiert werden.
Bemerkung: Wenn Patienten eine antibiotische Therapie ablehnen, müssen sie über das erhöhte Risiko einer Periimplantitis und damit in letzter Konsequenz eines Implantatversagens informiert werden. Dies gilt insbesondere, wenn weitere Risikofaktoren, wie z.B. Rauchen, psychischer oder physischer Stress oder systemische Erkrankungen vorliegen, wie z.B. Diabetes.
Nachweis von Tannerella forsythensis, Prevotella intermedia, Treponema denticola, Peptostreptococcus micros, Fusobacterium nucleatum in mittlerer bis hoher Anzahl.
Risiko: Mittleres Risiko für Periimplantitis, wenn keine weiteren Risikofaktoren vorliegen (Rauchen, Stress etc.).
Konsequenz: Reduktion durch mechanische PA-Therapie, Full-mouth Desinfection, engmaschiger Recall zur PZR, minutiöse persönliche Oralhygiene (Chlorhexidin-Spülungen empfohlen).
Vorgehen: Keine spezielle zeitliche Abfolge, der erhöhte Behandlungsaufwand muss während der gesamten Erhaltungsphase gewährleistet sein.
Bemerkung: Der Erfolg ist von individuellen Faktoren abhängig, die das lokale Immunsystem beeinflussen. Daher engmaschige Überwachung erforderlich. Wenn zusätzliches Risiko durch Rauchen, Stress etc., ist ggf. auch eine antibiotische Therapie zur Stabilisierung und zum Erhalt des Implantats notwendig.
Nachweis von: Prevotella intermedia, Treponema denticola, Peptostreptococcus micros, Fusobacterium nucleatum in geringer Anzahl.
Risiko: Kein erhöhtes Risiko für Periimplantitis.
Konsequenz: Kein besonderes Vorgehen, normale Recall-Frequenz.
Vorgehen: Etwa jährliche Kontrolle des mikrobiologischen Status. Auf mögliche Änderungen der lokalen Immunität achten (klinisches Bild).
Allgemeine Leitlinien der mikrobiologischen und Immunologischen Testung bei Parorontitis und Periimplantitis
- Parodontitis (Periimplantitis) ist eine bakterielle Infektionserkrankung mit mehreren auslösenden Erregern (Markerbakterien).
- Einige der Markerbakterien, z.B. Actinobacillus actinomycetemcomitans und Porphyromonas gingivalis, können durch mechanische Therapie allein nicht beseitigt werden.
- Patienten, die mit Actinobacillus und/oder Porphyromonas belastet sind, haben ein signifikant höheres Risiko für fortschreitende Zerstörung des Parodonts.
- Diese Patienten sollten für eine antibiotische Therapie selektiert werden.
- Ziel der Behandlung ist die Reduktion der bakteriellen Gesamtbelastung, sowohl supra- als auch subgingival.
- Fakultativ pathogene Erreger, z.B. Prevotella intermedia, Fusobacterium nucleatum, Peptostreptococcus micros können auch mittels rein mechanischer Behandlung (ggf. einschl. chirurg. Therapie) kontrolliert werden.
- Patienten, die klinisch unter aggressiver Parodontitis leiden, bei denen aber nur fakultativ pathogene Erreger nachweisbar sind, können unter Umständen genetisch stark prädisponiert sein im Sinne einer überschießenden Entzündungsreaktion. Der Gentest auf den sog. Interleukin-I Beta-Polymorphismus gibt Aufschluss über die zu erwartende Erkrankungs-Progression
Ziel der mikrobiologischen Diagnose ist:
- die Patienten zu selektieren, die von einer unterstützenden antibiotischen Therapie profitieren;
- die Recall-Intervalle individuell zu optimieren;
- vor implantologischen Eingriffen sicherzustellen, dass Actinobacillus und/oder Porphyromonas nicht in der Mundhöhle nachweisbar sind.
Zusammenfassung
Mikrobiologische und immunologische Laboruntersuchungen dienen im Rahmen der Parodontologie und Implantologie zur Prognoseeinschätzung und exakten Therapieplanung. Wenn mittels mikrobiologischer Untersuchungsmethoden (z.B. DNA-Analyse oder Kultur) bestimmte Parodontalmarkerkeime (Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis, Tannerella forsythensis) im Sulkus in hoher Zahl nachgewiesen werden, ist eine rein mechanische Therapie in der Regel nicht mehr ausreichend zur parodontalen Stabilisierung. Diese Patienten haben ein signifikant erhöhtes Risiko für fortschreitende Zerstörung des Parodonts. In diesen Fällen muss eine antibiotisch unterstützte Therapie in Betracht gezogen werden. Fakultativ pathogene Erreger, z.B. Prevotella intermedia, Fusobacterium nucleatum, Peptostreptococcus micros, können auch durch rein mechanische Behandlung kontrolliert werden. In jedem Fall ist Ziel der Infektionskontrolle im Rahmen der PA-Behandlung die Reduktion der bakteriellen Gesamtbelastung, sowohl supra- als auch subgingival.
Bei Anwesenheit von Actinobacillus actinomycetemcomitans und/oder Porphyromonas gingivalis im Parodont sollte erst nach deren Eradikation implantiert werden. Das Risiko für ein Implantatversagen ist sonst sehr hoch. Eine bestimmte genetische Normvariante für den Interleukin-IB-Rezeptor-Antagonisten (Allel 2 von IL-IRN) führt zu verminderter Produktion dieser antiinflammatorischen Mediatorsubstanz und damit zu verstärkten entzündlichen Reaktionen dieses Patienten. Diese Normvariante stellt einen Risikofaktor für die Periimplantitis dar und kann unter Umständen vor Implantation als Prognosemarker herangezogen werden. Bei Vorliegen des Allel 2 von IL-IRN und zusätzlich weiteren Risikofaktoren, welche die lokale Immunität beeinträchtigen (Rauchen, Diabetes), sollte die Indikation für Implantate vorsichtig gestellt werden.
Autor: Dr. med. Rudolf Raßhofer, München








