Prophylaxe 17.11.2011
Die Leukoplakie der Mundschleimhaut
share
Diagnostik – Therapie – Prognose
Eine Leukoplakie wird oftmals zufällig im Rahmen zahnärztlicher Routineuntersuchungen festgestellt. Von größter Wichtigkeit ist die Unterscheidung zwischen einer einfachen homogenen und einer inhomogenen Form, da letztere zu den potenziell malignen Erkrankungen zählt. Die histopathologische Untersuchung ist dabei von entscheidender Bedeutung.
Die Leukoplakie ist ein klinischer Begriff und stellt somit keine Diagnose dar. Die WHO definierte im Jahr 1997 die Leukoplakie als eine vorwiegend weiße Läsion der Mundschleimhaut, die nicht als eine andere definierbare Läsion charakterisiert werden kann. In der 2005 erschienenen WHO-Klassifikation der Tumoren des Kopfes und des Halses (Barnes et al. 2005) wurde die Leukoplakie nicht erneut definiert, sodass davon ausgegangen werden kann, dass die o.g. Definition unverändert gilt. Die Leukoplakie wird unter dem Begriff der präkanzerösen Läsionen abgehandelt. Eine präkanzeröse Läsion ist ein morphologisch alteriertes Gewebe, in dem das Auftreten von Krebs wahrscheinlicher ist als in entsprechend normalem Gewebe.
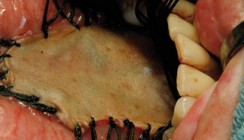
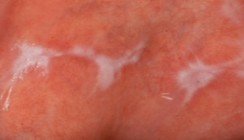
Leukoplakien treten in der männlichen Bevölkerung mit einer Prävalenz von etwa 4%, in der weiblichen Bevölkerung von 1% auf (Reichart 2000). Orale Leukoplakien werden am häufigsten bei Männern mittleren und älteren Lebensalters beobachtet. Die oralen Leukoplakien können isoliert oder multipel auftreten. Prädeliktionsstellen sind in absteigender Häufigkeit die Wangenschleimhaut, die Mukosa des Alveolarfortsatzes, der Mundboden, die Zunge (insbesondere der Zungenrand), die Lippen und der Gaumen. Die Leukoplakie tritt klinisch in zwei makroskopisch zu unterscheidenden Varianten auf: die homogene (Abb. 1) und die inhomogene Form. Übergänge zwischen beiden Varianten werden beobachtet (Abb. 2).
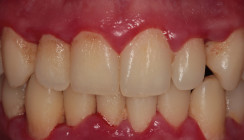
Die homogene Leukoplakie tritt als homogene weißliche Veränderung der Mundschleimhaut mit flachem Relief
in Erscheinung. Die Oberfläche ist glatt oder wellig und weist eine konsistente Textur auf. Diese Form der Leukoplakie ist zumeist asymptomatisch. Die inhomogene Leukoplakie wird als eine vorwiegend weiße oder als weiße und rote Veränderung (Erythroleukoplakie, Abb. 3) definiert. Diese kann unregelmäßig flach, nodulär oder exophytisch sein. Diese Formen der Leukoplakie können zu leichten Beschwerden wie Schmerzen oder Brennen der Mundschleimhaut führen. Darüber hinaus ist die proliferative verruköse Leukoplakie (Abb. 4) beschrieben worden. Sie ist gekennzeichnet durch ausgedehnte und multifokale, zunächst homogene, später verruköse Veränderungen der Mundschleimhaut. Häufig liegen hier keine bekannten Risikofaktoren vor. Bei der proliferativen verrukösen Leukoplakie handelt es sich um eine aggressive Form der oralen Leukoplakie, die in fast allen Fällen maligne transformiert. Diese Entwicklung läuft in vier Stadien ab: Hyperorthokeratose ohne Epitheldysplasie, verruköse Hyperplasie, verruköses Karzinom und schließlich das konventionelle Plattenepithelkarzinom (Bagan et al. 2010).
Im Allgemeinen entwickeln sich aus einer inhomogenen Leukoplakie häufiger Karzinome als aus einer homogenen Leukoplakie. Grundsätzlich kann sich das orale Plattenepithelkarzinom jedoch aus jeder Form der Leukoplakie entwickeln. Darüber hinaus ist zu beachten, dass sich ein Teil dieser Karzinome auch ohne erkennbare assoziierte Leukoplakie entwickeln kann. Die meisten oralen Leukoplakien können sich zurückbilden, wenn die ätiologischen Faktoren vermieden werden.
Ätiologie
Hauptfaktor für die Entstehung der Leukoplakie ist der Tabak. Die schädigenden Stoffe wie Teer, Nikotin und Nitrosamine sind in allen Zigaretten, Zigarren und Pfeifentabak enthalten. Auch der sogenannte smokeless tobacco, der in Form von Schnupftabak angewandt wird, und die Blätter der Betelnuss enthalten kanzerogene Stoffe. Es wird geschätzt, dass das Rauchen das Risiko zur Entwicklung eines oralen Plattenepithelkarzinoms um den Faktor 20 erhöht. Der Mechanismus der Wirkung der kanzerogenen Stoffe aus dem Zigarettenrauch wird in einer Beeinflussung der DNA-Replikation der Stammzellen der Keratinozyten der Mundschleimhaut gesehen (Johnson 2001). Das Risiko der malignen Transformation einer plattenepithelialen Dysplasie wird durch die Kombination von Rauchen und übermäßigem chronischen Alkoholkonsum um Faktor 50 erhöht. Auch Mikroorganismen, wie humane Papillomaviren (D’Souza 2007), Herpes-simplex-Viren und Candida albicans, scheinen die maligne Transformation zumindest mit zu beeinflussen.
Differenzialdiagnosen der Leukoplakie
Die Leukoplakie ist ein klinischer Begriff, sodass zur Stellung der Diagnose eine Reihe von Differenzialdiagnosen zu bedenken ist. Die Dignität dieser Erkrankungen ist sehr unterschiedlich und erfordert neben einem geschulten Untersucher auch klinische Erfahrung. Die Differenzialdiagnosen der Leukoplakie sind in Tab. 1 zusammengefasst.
Die Herausarbeitung einer Arbeitsdiagnose erfordert zunächst das Erheben der Anamnese. Zu erfragen sind Grunderkrankungen wie Diabetes mellitus und Bluthochdruck, der Raucherstatus, Hauterkrankungen (z.B. Lichen, Abb. 5 und 6), regelmäßige Medikation und insbesondere in der jüngeren Vergangenheit neu hinzugekommene Medikamente. Der Patient sollte befragt werden, seit wann die Läsion besteht, ob sie schmerzhaft ist oder ob andere Symptome mit dieser Läsion in Zusammenhang gebracht werden.Bei der klinischen Untersuchung sind die Lokalisation der Leukoplakie, ihre Größe und der palpatorische Eindruck zu notieren. Liegt eine homogene oder eine inhomogene Leukoplakie vor? Wichtig sind ebenfalls die Symmetrie der Läsion und der Status der zervikalen Lymphknoten (Driemel et al. 2008, Kunkel et al. 2010). In problematischen Fällen der Leukoplakie sei auf die internetbasierte Hilfe der DGZMK hingewiesen. Hier können per E-Mail (mundschleimhaut@dgzmk.de) digitale intraorale Aufnahmen einer Konsultation zugesandt werden.
Methoden der Zell-/Gewebegewinnung
Bei homogenen Leukoplakien ohne Malignitätsverdacht kann als primäre diagnostische Methode die Bürstenbiopsie jeder Zahnarztpraxis empfohlen werden. Diese Methode liefert Aussagen zu einer eventuell bestehenden Entzündung, zu Mikroorganismen, insbesondere Candida (Abb. 7), zu Verhornungsstörungen (Abb. 8) und zur Frage einer Epitheldysplasie (Abb. 9). Aus der täglichen Praxis erscheint der dringende Hinweis wichtig, dass die anatomische Lokalisation der Läsion dem Oralpathologen unbedingt mitgeteilt werden muss, da beispielsweise eine Parakeratose in der Wangenschleimhaut einen pathologischen Befund begründet, eine Parakeratose der Gingiva jedoch physiologisch ist. Um eine sinnvolle zytologische Diagnostik zu ermöglichen, sollte je Bürste nur eine (!) Läsion untersucht werden, bei mehreren Läsionen sind entsprechend mehrere Bürsten zu verwenden. Dies sollte auf dem Einsendeschein auch vermerkt werden. Die Anwendung eines Bürstenabstriches für die gesamte Mundschleimhaut ist in keinem Falle zielführend.
Bei inhomogenen Leukoplakien, bei Leukoplakien, in denen zytologisch mittels Bürstenbiopsie eine Epitheldysplasie befundet wurde, eine ausreichende Diagnose nicht zu erzielen war oder die Genese der Leukoplakie auch nach dem Wegfall etwaiger Reize (z.B. Tabak, mechanische Irritationen, Medikamente) unklar bleibt, ist die chirurgische Biopsatgewinnung der Goldstandard. Je nach Größe bzw. Zugänglichkeit der Leukoplakie ist eine Exzisions- oder Inzisionsbiopsie indiziert. In jedem Falle ist bei der Schnittführung darauf zu achten, dass zumindest an einem Resektionsrand makroskopisch gesund erscheinende Schleimhaut mit entnommen wird.
Mikroskopische Diagnostik
Die mikroskopische Diagnostik sollte von oralpathologisch spezialisierten Pathologen durchgeführt werden. Den Pathologen, der „alles weiß und alles kann“, gibt es im 21. Jahrhundert nicht mehr („Pathologists who believe that they never need a second or specialist opinion are dangerous. Increasingly this becomes true in surgical pathology which is ever more subspecialized and in which the days of the true generalists are numbered.“ Fletcher 2007). Sowohl am Zellmaterial der Bürstenbiopsie als auch an dem chirurgisch gewonnenen Biopsatmaterial sind in der spezialisierten pathologischen Praxis fundierte Aussagen zu morphologischen Veränderungen, die klinisch als Leukoplakie imponieren, möglich. So werden z.B. Verhornungen in Form von Parakeratosen (Abb. 10) oder Hyperorthokeratosen (Abb. 11) unterschieden.
Obligat gefordert werden muss eine Aussage zum Vorliegen einer Epitheldysplasie. Falls diese nachweisbar ist, wird zur Graduierung der Dysplasie am histologischen Schnittpräparat die WHO-Klassifikation empfohlen, die gering-, mittel- und hochgradige Epitheldysplasien unterscheidet. Daneben existieren weitere Schemata, wie z.B. die Ljubljana-Klassifikation, die sich jedoch international nicht durchgesetzt haben. In die histologische Beurteilung der Dysplasie fließen eine Reihe von pathologischen Veränderungen ein, die in den Zellkernen erkennbar sind, und Veränderungen der Architektur, die in Form von Störungen der Epithelschichtung nachweisbar sind (Tab. 2). Eine geringgradige Epitheldysplasie liegt vor, wenn die zytologischen Veränderungen der Keratinozyten auf das basale Drittel des Plattenepithels begrenzt sind (Abb. 12). Die mittelgradige Epitheldysplasie wird diagnostiziert, wenn zytologische und architekturelle Veränderungen bis in das mittlere Drittel des Epithels reichen (Abb. 13), sich darüber hinaus ausbreitende Veränderungen werden als schwere Epitheldysplasie bezeichnet (Abb. 14). Am Zellmaterial der Bürstenbiopsie kann eine Epitheldysplasie zweifelsfrei diagnostiziert, jedoch nicht graduiert werden, da aufgrund der Zellvereinzelung in dieser Methode die Schichtung des Epithels nicht vorhanden ist und somit nicht beurteilt werden kann.
Neben den konventionellen Färbungen (Pap, HE, PAS) sind auch weiterführende Methoden anwendbar, die die Aussagekraft und die diagnostische Sicherheit der in der Zahnarztpraxis gewonnenen Proben wesentlich erhöhen. Dazu zählen z.B. immunzytologische Untersuchungen zum Nachweis extrazellulärer Matrixmoleküle (z.B. Laminin-5) am Zellmaterial der Bürstenbiopsie (Driemel et al. 2007) und der immunhistologische Nachweis von Chemokinrezeptoren (Meng et al. 2010), die in Zukunft möglicherweise als Biomarker eine Aussage zur Prognose oraler Plattenepithelkarzinome erlauben. Zudem kann bei speziellen Fragestellungen molekularbiologisch der Nachweis und die Typisierung von Humanen Papillomaviren (HPV) erbracht werden. In Fällen histologisch nachgewiesener Epitheldysplasie ist die DNA-Zytometrie indiziert. Bei Nachweis eines aneuploiden Chromosomensatzes in den dysplastischen Zellen ist im Vergleich zu Zellen mit diploidem Chromosomensatz das Risiko zur Entwicklung eines oralen Plattenepithelkarzinoms wesentlich erhöht (persönliche Mitteilung EW Odell, London).
Therapie
Vor der Therapie steht obligat die oralpathologische Diagnostik eines Bürstenbiopsates oder eines Inzisions- bzw. Exzisionsbiopsates des leukoplakisch veränderten Mundschleimhautareals. Die Therapie richtet sich nach der mikroskopischen Diagnose unter Berücksichtigung der klinisch-anamnestischen Befunde. Im (häufigsten) Falle einer Raucherkeratose erscheint der dringende Hinweis auf den Verzicht dieser Gewohnheit naheliegend. Die Patienten reagieren zumeist positiv auf die Mitteilung, dass sich die Raucherkeratose, die voll erhaltene Regenerationsfähigkeit der oralen Mukosa vorausgesetzt, nach Beendigung des Rauchens zurückbilden kann.
Die Candidiasis, die als Superinfektion einer Leukoplakie auftreten kann, wird mit antimykotischen Medikamenten therapiert. In einigen Fällen kann auf diese Weise eine inhomogene Form in eine homogene überführt werden. Oftmals ist bei „hartnäckigen“ Fällen auch ein Wechsel der antimykotischen Medikation erforderlich. In besonderen Fällen kann die Typisierung der Candidaspezies in Betracht gezogen werden.
Häufig wird in der Praxis eine lichenoide Reaktion als Differenzialdiagnose der Leukoplakie vermutet. Hier ist eine ausführliche Medikamentenanamnese erforderlich, insbesondere ist auf Medikamente zu achten, die erst in der jüngeren Vergangenheit neu von dem Patienten eingenommen werden. In Tab. 3 werden Medikamente aufgeführt, die häufig zu lichenoiden Reaktionen führen. Ein Medikamentenwechsel sollte immer mit dem Hausarzt abgesprochen werden.
Die Therapie der Epitheldysplasie richtet sich nach dem Grad der Dysplasie. So können Läsionen mit einer geringgradigen Dysplasie unter klinischer Kontrolle verbleiben, dabei sollten die Untersuchungsintervalle sechs Monate nicht überschreiten (van der Waal 2010). Bei Läsionen mit mittel- oder hochgradiger Dysplasie ist die zeitnahe vollständige Exzision unter Mitnahme von randlich gesundem Epithel indiziert. Auch hier sind nachfolgende Kontrolluntersuchungen unerlässlich. In den derzeit vorliegenden klinischen Studien gibt es jedoch keinen wissenschaftlichen Beweis, dass die chirurgische Exzision einer oralen Epitheldysplasie die Entwicklung eines oralen Plattenepithelkarzinoms ausschließen kann (Brennan et al. 2007).
Prognose der Dysplasie
Folgende Faustregel gilt für die Prognose der plattenepithelialen Dysplasie der oralen Mukosa: In etwa 20% der Fälle entwickelt sich ein Plattenepithelkarzinom, etwa 20% der Dysplasien gehen in eine Regression über, in 40% der Fälle zeigt sich keine Veränderung und in 20% muss mit einer Vergrößerung der Läsion gerechnet werden. Ein generell erhöhtes Risiko für eine maligne Transformation liegt in folgenden Fällen vor: weibliche Patienten, zeitlich länger bestehende Leukoplakie, Nichtraucher, Leukoplakie am Zungenrand oder Mundboden, inhomogene Leukoplakien, Superinfektion mit Candida albicans und höhergradige Epitheldysplasie (Ebhardt und Reichart 2009). Grundsätzlich erscheint ein großer Teil der Leukoplakien vermeidbar, wenn die Aufklärung über die negativen gesundheitlichen Wirkungen des Rauchens weiter vorangetrieben wird. Noch wichtiger für die Diagnostik der Leukoplakie ist die Stimulation der Zahnärzteschaft für die routinierte Untersuchung der gesamten Mundschleimhaut. Dazu beitragen wird auch die Verbreitung der aktuellen S2k-Leitlinie der DGZMK zur Diagnostik und Therapie von Vorläuferläsionen des oralen Plattenepithelkarzinoms, auf deren Publikation ausdrücklich verwiesen wird (Kunkel et al.; www.dgzmk.de).
Die Abbildungen 1 bis 4 stammen aus dem Lehrbuch „Spezielle Pathologie für Zahnmediziner“ von Ebhardt und Reichart, 1. Auflage 2009, mit freundlicher Genehmigung des Quintessenz Verlages in diesem Beitrag abgedruckt.