Implantologie 19.06.2014
20 Jahre membrangeschützte Knochenregeneration
share
Ein Erfahrungsbericht
Die zahnärztliche Implantologie hat sich zu einem überaus zuverlässigen und ergebnissicheren klinischen Routineverfahren für all jene Fälle entwickelt, in denen ein in Höhe und Breite adäquates Knochenangebot gegeben ist. Diese Voraussetzung ist jedoch nicht immer erfüllt. Gleichwohl wünschen heute auch Patienten, deren knöcherne Situation das Einbringen von Implantaten eigentlich nicht gestattet, eine Verbesserung der Funktion und der Ästhetik – sie erwarten diese sogar als selbstverständlich.
Der Einsatz von Barrieremembranen zur Regeneration von Knochendefekten hat die dentale Implantologie im Verlauf der letzten 20 Jahre stark verändert. Das meist als „membrangeschützte Knochenregeneration“ (Guided Bone Regeneration, GBR) bezeichnete Prinzip wurde erstmals im Jahre 1959 von Hurley und Mitarbeitern beschrieben. Bereits in den 1960er-Jahren testeten und beschrieben die Forschergruppen um Bassett und Boyne mikroporöse Zelluloseazetat-Laborfilter (Millipore) bei der Behandlung kortikaler Defekte an Röhrenknochen und der knöchernen Rekonstruktion des Kiefers. Der Grundgedanke der Autoren war es, Filtermaterial zu benutzen, um durch Isolierung der Knochendefekte gegen die Zellen des angrenzenden, fibrösen Bindegewebes zu gewährleisten und ein geeignetes Milieu für die Osteogenese zu schaffen. Diese Pionierstudien führten allerdings nicht unmittelbar zu einer breiten klinischen Anwendung von Barrieremembranen am Patienten. Tatsächlich wurden die klinischen Möglichkeiten der Membrantechnik erst in den frühen 1980er-Jahren erkannt, als die Forschergruppe um Karring und Nyman in verschiedenen experimentellen und klinischen Studien zur parodontalen Regeneration die Verwendung von Barrieremembranen systematisch untersuchte.
Gerade die Möglichkeiten einer parodontalen Regeneration interessierten mich bereits zum Ende meines Stomatologie-Studiums. Man setzte damals große Hoffnung in die sogenannte GTR- (Guided Tissue Regeneration-)Technik bei ausgedehnten parodontalen Knochendefekten. Wenige Jahre später wurde die Membrantechnik im Rahmen experimenteller Studien zur Knochenregeneration auch bei größeren Alveolarfortsatzdefekten getestet. Auf Grundlage der vielversprechenden Ergebnisse dieser Studien begann in den späten 1980er-Jahren der klinische Einsatz von Membranen bei Implantatpatienten (Nyman et al. 1990).
Doch erst Anfang der 1990-er Jahre wurde auf Kongressen mehr darüber berichtet und die Membrananwendung kontrovers diskutiert. Aus dieser Zeit sind auch die Arbeiten von Wachtel und Bernimoulin zu nennen (Wachtel 1990, Wachtel und Bernimoulin 1991). 1994 legte ich mir das erste Buch zu diesem Thema von Buser, Dahlin und Schenk für meine private wissenschaftliche Bibliothek zu. Nach fünf Jahren intensiver experimenteller und klinischer Vorarbeit wurde von diesen Autoren im Jahr 1994 unter dem Titel Guided Bone Regeneration in Implant Dentistry die erste englische Ausgabe dieses Buches veröffentlicht, welche bei mir und in der implantologischen Fachwelt ein gesteigertes Interesse für dieses Thema wachrufen konnte. Seit dieser Zeit hat sich die GBR-Technik kontinuierlich weiterentwickelt.
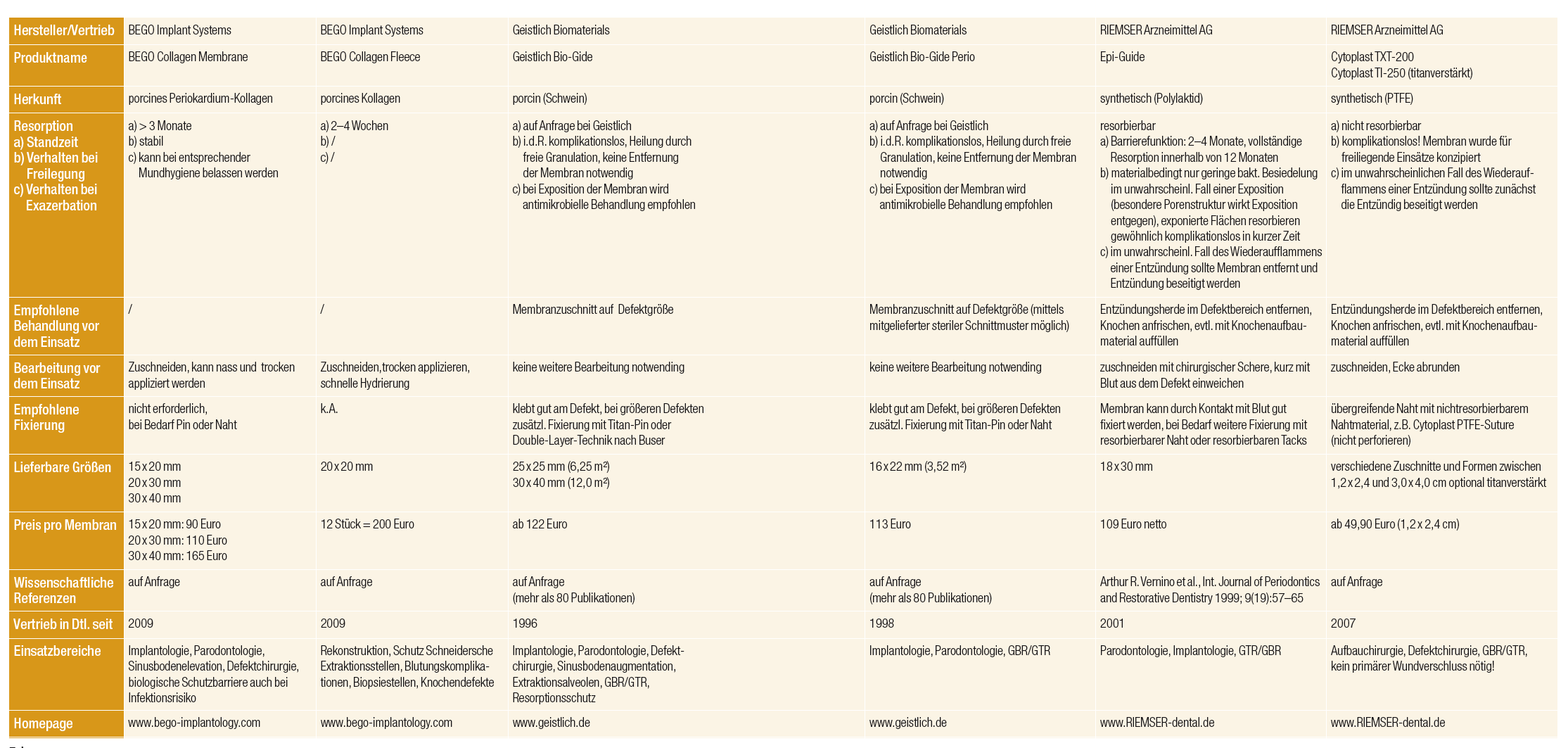
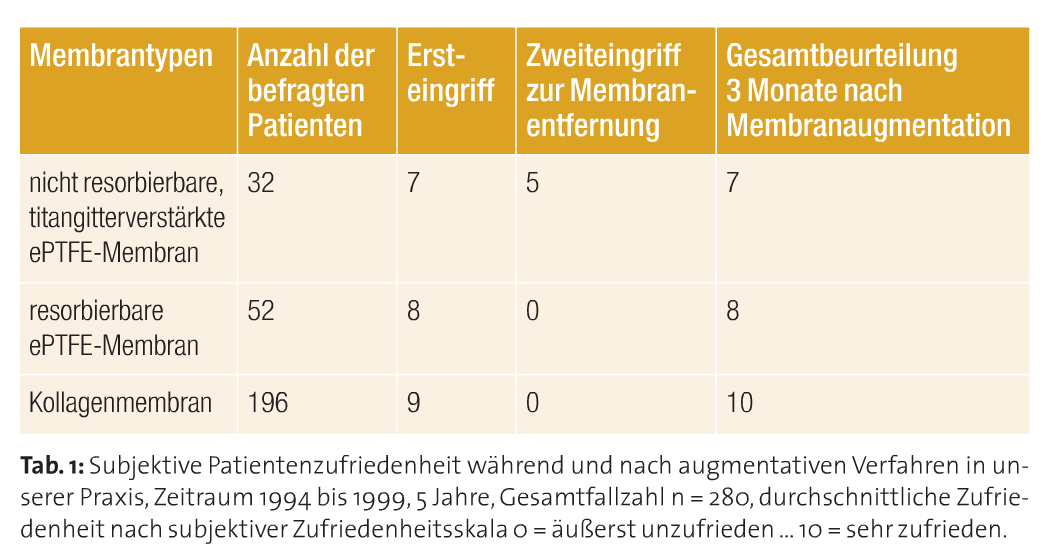
Immer auf der Suche nach besseren und für den Patienten schonenderen Behandlungsmethoden habe ich so in den letzten 20 Jahren verschiedenste Membrantypen im klinischen Alltag eingesetzt (Tab. 3), deren Tauglichkeit und Anwendungsparameter verglichen und daraus resultierend entweder wieder verworfen oder beibehalten (Tab. 2). Auch das subjektive Empfinden des Patienten war für die Auswahl der OP-Methode und welche Membran ich nutze, ein bedeutendes Kriterium (Tab. 1).
Ziele der Membrananwendung
– ungestörte Knochenregeneration durch Barrierefunktion gegen das angrenzende Weichgewebe
– Verhinderung von Augmentatresorption, insbesondere bei autologen Knochentransplantaten
– Schutz vor Verlust oder Dislokation von Knochen- oder Knochenersatzmaterialpartikeln
– Schutz des Regenerates im Falle von Wunddehiszenzen
Somit wird, je nach verwendetem Membrantyp, der gewünschten Knochenregeration die benötigte Zeit und Ruhe in einem abgegrenzten Raum gegeben. Gerade das Freihalten eines bestimmten, vom Operateur vorgegebenen Raumvolumens, lässt sich hervorragend mit titanverstärkten Membranen gewährleisten (Abb. 1 und 2). Diese Membranen können vor dem Einbringen in das OP-Gebiet beschnitten und auch vorgebogen werden, was in der Abbildung 3 nur exemplarisch dargestellt wurde.
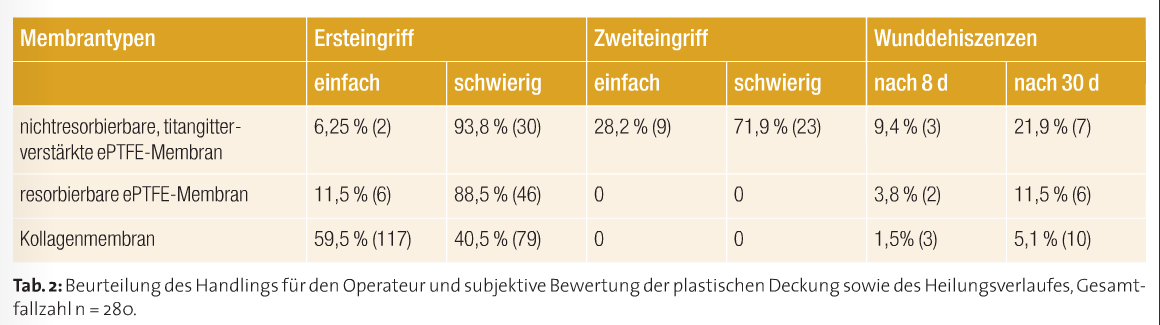
So verwendete ich von 1994 bis 1996 zunächst nichtresorbierbare, titangitterverstärkte Membranen der Firma W.L.Gore and Associates, Inc., Arizona, USA. Wenngleich ich als Anwender mit dem klinischen Ergebnis der Knochenregeneration in 94 Prozent der Fälle sehr zufrieden war, war der notwendige Zweiteingriff für die meisten Patienten subjektiv mehr belastend als der Ersteingriff. So ergab eine Befragung meines Patientenstammes, dass diese therapeutische Maßnahme im Ganzen betrachtet, mit dem Ersteingriff und der Gesamtbehandlung zwar relativ zufrieden waren, aber eine beachtenswerte Anzahl der Patienten den Zweiteingriff zur Entfernung des nichtresorbierbaren Membranmaterials als störend, sogar subjektiv belastender als den ersten Eingriff wahrnahmen (Tab. 1). Dies verbesserte sich bereits mit der Einführung und Verwendung von resorbierbaren ePTFE- Membranen. Diese waren und sind in verschiedenen Konfigurationen auf dem Dentalmarkt, je nach Anwendungsgebiet. Soweit kein Eingriff zur Membranentfernung erfolgte, waren die Patienten vom Beginn bis zum Ende der Therapie relativ zufrieden, wie ebenfalls in Tabelle 1 zu erkennen ist. Auch das Handling einer titangitterverstärkten ePTFE-Membran mit deren vollständigen plastischen Deckung stellt an oralchirurgisch tätigen Operateur je nach Wundregion erhöhte Anforderungen. Die plastische und spannungsfreie Deckung gestaltet sich oft schwierig (Tab. 2). Allerdings ist hier der wesentliche Vorteil, die deutliche Raumstabilisierung und der Volumenerhalt (Abb. 3), besonders hervorzuheben.
Nur der Vollständigkeit halber möchte ich erwähnen, dass ich auch eine direkt applizierbare GTR-Barriere, im damaligen Dentalfachhandel unter dem Namen Atrisorb® von der Firma Atrix Laboratories, Inc., Fort Collins, CO, USA, für die Abdeckung parodontaler Knochendefekte, insbesondere bei Bifurkationsbefall, zum Abdecken von Augmentationsmaterial verwendet habe. Der klinische Heilungsverlauf war zwar unauffällig, aber eine Dimensionsstabilität nach Aushärtung dieses zähfließend aufgetragenen Barrierematerials war nicht nachweisbar. Zumindest kam es aber auch nicht zu einer Dislokation von Partikeln des in den Defekt platzierten Materials, was ich wiederum positiv anmerken muss. Wegen der nur geringen Anzahl der so therapierten Patienten wurden diese nicht in die Auswertung unserer Patientenbefragung einbezogen.
Bereits seit 1996 wechselte ich zunehmend zur klinischen Anwendung von Kollagenmembranen über. Neben der effektiven Barrierefunktion waren und sind bis heute die guten Wundheilungseigenschaften der Grund dafür, dass ich diese Materialien nun fast ausschließlich zur Behandlung meiner Patienten nutze. Sowohl das Handling als auch die Patientencompliance sind den alten Methoden mit den titangitterverstärkten ePTFE-Membranen in den meisten Fällen überlegen (Tab. 1 und 2).
Natürliche Kollagenmembranen beeinflussen die Gewebeintegration positiv, wie bereits Plöger 2003 beschrieb. So traten in unserem Behandlungsgut nach acht Tagen nur bei 1,5 Prozent der Fälle und nach 30 Tagen nur bei circa 5 Prozent der Membranapplikationen geringe Dehiszenzen auf. Dies war im Vergleich zu den titangitterverstärkten nichtresorbierbaren ePTFE-, aber auch zu den resorbierbaren ePTFE-Membranen eine revolutionäre Verbesserung.
Unter lokaler antiphlogistischer Behandlung heilen die gering freiligenden Kollagenmembranen noch unkompliziert ab, während ich die anderen Membrantypen zeitnah entfernen musste, wenn eine Wunddehiszenz auftrat. Prinzipiell sind alle Membranexpositionen oder Wunddehiszenzen klinisch zu beherrschen, bedingen aber das häufige Einbestellen der Patienten und mindestens wöchentliche Nachkontrollen und Wundsäuberungen, was sich auch in der schlechteren Patientenbewertung in Tabelle 1 niederschlägt. Der Grund kann darin gesehen werden, dass Kollagen auf Fibroblasten chemotaktisch wirkt und so den primären Wundverschluss fördert. Es ist heute wohl unumstritten, dass es die Bildung und Stabilisierung des Wundkoagulums unterstützt und auch die Proliferation, Migration und Adhäsion von Zellen begünstigt. Außerdem sind auch keine Irritationen des Gewebes oder des anzustrebenden Regenerationsprozesses beim Abbau des Membranmaterials zu befürchten, wie sie aber bei synthetischen Materialien auftreten können. In Tabelle 3 sind die in den Jahren 2001 bis 2014 in meiner Praxis verwendeten Membranmaterialien mit ihren verschiedenen Eigenschaften der Vollständigkeit halber aufgeführt.
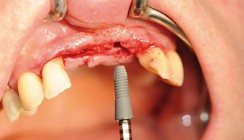
Im direkten klinischen Vergleich schien das Handling der nativen Kollagenmembran, in unserem Fall die Bio-Gide® der Geistlich Pharma AG, Wolhusen, Schweiz, deutlich einfacher. Dieses Material lässt sich nach dem Auspacken aus der angelieferten Sterilbox problemlos zuschneiden und damit der Defektgröße und -konfiguration anpassen (Abb. 4–6). Ein Einweichen oder Anfeuchten mit jeglichen Flüssigkeiten entfällt ebenfalls vor der Applikation. Kurze Zeit nach der Applikation saugt sich das Membranmaterial voll Blut aus der Umgebung und dem darunter befindlichen Defektareal (Abb. 7 und 8). Auch die Anhaftung an den Knochenwänden und die Adaptation auf dem Augmentationsgut, gleichwohl ob es sich um autologen Knochen oder aber Knochenersatzmaterial verschiedenen Ursprungs handelt, ist deutlich besser als bei synthetischen Membranen oder überhaupt nur hier gegeben. So habe ich nur in der Anfangszeit meiner augmentativen Tätigkeit resorbierbare Pins zur Membranbefestigung genutzt. Heute adaptiere ich das Barrierematerial unter das angrenzende Periost, wie in Abbildung 7 meines Patientenfalls dargestellt. Allerdings benötigen Kollagenmembranen immer dimensionsstabiles Knochenersatzmaterial oder autologen Knochen, um wie bei Zeltstangen das angestrebte Raumvolumen vor einem Kollaps zu bewahren.
Wenn der Operateur wie in den Abbildungen 9 und 10 einen primären und spannungsfreien Wundverschluss erreichen kann, dann sind Nahtdehiszenzen eine seltene Ausnahme und möglicherweise bei subjektiven Patientenfaktoren zu suchen. Normalerweise nutze ich 5/0 oder 6/0 Nahtmaterial in der Augmentationschirurgie. Die von mir oft verwendete Bio-Gide-Membran gibt es in den Abmessungen 13 x 25 mm, 25 x 25 mm oder sogar 30 x 40 mm. Somit hat der Operateur für nahezu alle denkbaren Indikationen eine Auswahlmöglichkeit und kann auch im finanziellen Interesse des Patienten die wirtschaftlichste, d.h. hier preisgünstigste Variante auswählen.
Nicht unerwähnt möchte ich lassen, dass diese Membran auch außergewöhnlich gute Materialeigenschaften bezüglich ihrer Reisfestigkeit und Faltbarkeit mitbringt, was nicht bei jedem Mitbewerber gegeben ist. So führe ich externe Sinuslift-Operationen oft mit sehr kleinem lateralem Knochenfenster durch. Bei dieser OP-Variante falte ich die Membran ähnlich der Methode, wie ein Schiff in eine Flasche eingeführt wird, zusammen und entfalte diese dann wieder, bevor sie sich mit Flüssigkeit vollsaugt. So wird dadurch die Schneider’sche Membran in der Nasennebenhöhle über lange Zeit stabilisiert und eine Perforation mit unerwünschter Dislokation von Augmentationsmaterial erfolgreich verhindert (Liebaug und Wu 2011).
Fazit
Ohne die Anwendung augmentativer Behandlungsverfahren, insbesondere aber die membrangeschützen Knochenregenerationen, hätte ich in den letzten 20 Jahren nur einer deutlich geringeren Anzahl von Patienten zu festsitzendem oder hochwertigem implantatgetragenen Zahnersatz verhelfen können. Die erfolgreiche zahnärztliche Implantologie beginnt in meinem Therapiekonzept bereits oder bestenfalls mit der Socket Preservation und Ridge Preservation zeitgleich mit der Zahnentfernung. Diese Maßnahmen machen aber auch Sinn, wenn danach eine herkömmliche prothetische Rehabilitation mit festsitzenden Brücken oder kombiniert festsitzenden und abnehmbaren Teleskop- oder Geschiebeprothesen geplant wird.
Die Verwendung von Barrieremembranen, insbesondere aber Kollagenmembranen, hat sich zu einem überaus zuverlässigen und ergebnissicheren klinischen Routineverfahren für all jene Fälle entwickelt, in denen ein in Höhe und Breite adäquates Knochenangebot für spätere Therapiemaßnahmen geschaffen werden soll.