Implantologie 02.01.2020
PRF: Dos and Don’ts in der Herstellung und Prozessierung
share
Der Fokus des vorliegenden Fachbeitrags soll insbesondere auf den technischen Aspekten der PRF-Anwendung („Handling“) liegen. Es sollen die PRF-Herstellung (Blutentnahme, Zentrifugation) und die PRF-Prozessierung – bis hin zur Applikation, in Abhängigkeit der klinischen Indikation erörtert werden.
Blutkonzentrate, insbesondere das Platelet Rich Fibrin (PRF) werden immer häufiger zur Unterstützung der Wundheilung und der Regeneration eingesetzt.1 PRF wird aus dem patienteneigenen peripheren Blut ohne Zugabe von Antikoagulanzien hergestellt. Durch eine einmalige Zentrifugation kann je nach verwendeten Entnahmeröhrchen eine solide oder flüssige PRF-Matrix gewonnen werden.2 Durch die Zentrifugation werden die Blutkomponenten entsprechend der verwendeten Zentrifugalkraft getrennt.
Die roten Blutkörperchen gelangen hierbei in Richtung Röhrchenboden.3 In dem verbliebenen Überstand werden die Thrombozyten und Leukozyten in einer Fibrinmatrix konzentriert. Zusätzlich sind weitere Plasmaproteine in der PRF-Matrix enthalten. Dieses autologe Blutkonzentrat ist somit in der Lage, unterschiedliche Wachstumsfaktoren z. B. Vascular Endothelial Growth Factor (VEGF), Epidermal Growth Factor (EGF) oder Platelet Derived Growth Factor (PDGF) aktiv über einen relativ langen Zeitraum (bis zu 15 Tage) freizusetzen.4,5 Diese Wachstumsfaktoren spielen eine entscheidende Rolle für die Wundheilung und Regeneration, da sie zur Gefäßneubildung, Epithelialisierung, sowie Anregung weiterer regenerativer Zellen beitragen.6,7
Die Zusammensetzung und Bioaktivität des PRF hängt primär von der angewendeten Zentrifugalkraft ab.3 Mehrere aktuelle Studien konnten den Einfluss der Zentrifugalkraft auf die Zusammensetzung und Bioaktivität des resultierenden PRFs nachweisen.8–12 Somit konnte gezeigt werden, dass die Anwendung einer niedrigen Zentrifugalkraft zur Akkumulation eine signifikant höherer Anzahlen an Thrombozyten und Leukozyten im Vergleich zur mittleren oder hohen Zentrifugalkraft führt.3,10
Ähnlich verhält sich die Wachstumsfaktorfreisetzung. PRF-Matrizen, die mittels einer niedrigen Zentrifugalkraft hergestellt wurden, setzen im Vergleich zur PRF-Matrix mit höherer Zentrifugalkraft signifikant höhere Konzentrationen unterschiedlicher Wachstumsfaktoren (z. B. VEGF, PDGF, EGF, TGF-b1) frei.8–12 Infolgedessen wurde das sogenannte Low-Speed Centrifugation Concept (LSCC) eingeführt, um die Herstellung der Blutkonzentrate zu standardisieren und reproduzierbare Behandlungsprotokolle bzw. klinische Ergebnisse zu ermöglichen.3
Der Fokus des vorliegenden Fachbeitrags soll insbesondere auf den technischen Aspekten der PRF-Anwendung („Handling“) liegen. Die zu verwendenden PRF-Röhrchen wurden speziell für die Herstellung von PRF entwickelt. In Abhängigkeit der klinischen Indikation existieren zwei unterschiedliche Varianten der PRF-Matrizes. PRF-Röhrchen mit einer Glasoberfläche fördern die Koagulation. Im Rahmen der Zentrifugation entsteht hierbei eine solide PRF-Matrix. Im Gegensatz dazu kann mittels Kunststoff-beschichteten PRF-Röhrchen die Koagulation verlangsamt werden. Entsprechend kommt es während der Zentrifugation zu einer verlangsamten Koagulation. Bei Raumtemperatur bleibt die PRF-Matrix nach der Zentrifugation für circa 30 Minuten flüssig, bis sie schließlich koaguliert.
Blutentnahme
Für die Herstellung von PRF wird patienteneigenes venöses Blut benötigt, welches nach adäquater Patientenaufklärung aus den peripheren Venen entnommen wird. Diese Blutentnahme ist eine Routinemethode und findet insbesondere in der Diagnostik Anwendung. Die Blutentnahme sollte nach den Richtlinien der Weltgesundheitsorganisation (WHO) durchgeführt werden.13 Um eine geeignete Punktionsstelle zu finden, sollte zunächst die anatomische Lage der peripheren Venen palpiert werden, wobei sich die in der Ellenbeuge gelegene Vena mediana cubiti hierfür optimal eignet. Nach Anziehen von Handschuhen, Platzieren des Stauschlauches circa 5 cm über der Punktionsstelle der Vene und Desinfektion der Punktionsstelle mit einem Hautantiseptikum gemäß Herstellerangabe, wird die Butterfly-Nadel in einem Winkel von 30° zur Hautoberfläche in die Vene eingeführt (Abb. 1).
Um ein Durchstechen der Vene zu vermeiden, sollte der Winkel abgeflacht werden sobald die Vene getroffen wurde. Durch das Vakuumsystem des PRF-Röhrchens befüllt sich dieses in der Folge mit venösem Blut bis ein Blutvolumen von 10 ml erreicht wird und die Blutzufuhr sich automatisch stoppen lässt. Nach Lockerung des Stauschlauches kann die Butterfly-Kanüle entfernt werden. Anschließend soll adäquater Druck auf die Punktionsstelle mit einem sterilen Tupfer ausgeübt werden, um Nachblutungen unter der Haut zu vermeiden.

Zentrifugation
Um eine frühzeitige, physiologische Koagulation des Bluts zu vermeiden, müssen im Anschluss an die Blutentnahme die PRF-Röhrchen zügig in einer entsprechenden Zentrifuge zentrifugiert werden. Die Zentrifugation ist ein Trennverfahren, welches der Sedimentation von Zellen und/oder Biomolekülen aus einer Suspension (z. B. Blut) dient, abhängig von der relativen Zentrifugalkraft sowie von der Größe, Form und Dichte der verschiedenen Suspensionsbestandteile. Die relative Zentrifugalkraft (RCF = Relative Centrifugal Force) stellt die Zentrifugationskraft als Vielfaches der Erdbeschleunigung dar und wird häufig in der Einheit g ausgedrückt. Außerdem ist sie für die resultierende Konzentration der sedimentierten Zellen und Biomoleküle im PRF entscheidend. Der Wert g gibt genau die Kraft an, welche für eine optimale Zentrifugation einer entsprechenden Suspension (hier Blut) benötigt wird, um das gewünschte Sediment (hier PRF) als Endprodukt zu erhalten und erlaubt die Berechnung der notwendigen Geschwindigkeit des Zentrifugen-Rotors für ein entsprechendes Röhrchen und eine entsprechende Zentrifuge. Bei Zentrifugen, an denen lediglich die Rotationsgeschwindigkeit (RPM = Umdrehungen des Zentrifugen-Rotors pro Minute) eingestellt werden kann, muss die RCF bzw. der notwendige g-Wert zunächst mithilfe einer festgelegten Formel ausgerechnet werden. Der Zusammenhang zwischen Rotationsgeschwindigkeit (RPM) und relativer Zentrifugalbeschleunigung (RCF) ist dabei abhängig von der Größe des Rotors (r = Rotationsradius = Distanz zwischen der Drehachse und dem Röhrchenboden). Folgende Formel dient hier der Umrechnung:14 RCF = 1,12 x Radius x (RPM/1.000)2.
Die relative Zentrifugalkraft, welche für die PRF-Herstellung mittels des etablierten Low-Speed Centrifugation Concepts benötigt wird, ist in Tabelle 1 angegeben und sollte entsprechend der Indikation an der Zentrifuge (r=110 mm)eingestellt werden. Generell sollte die Zentrifuge auf einer stabilen und geraden Unterlage platziert werden. Beim Beladen der Zentrifuge mit den mit Blut befüllten Röhrchen muss zwingend darauf geachtet werden, dass jedes Ungleichgewicht ausgeschlossen ist. Das bedeutet, dass die Röhrchen so in den Rotor gestellt werden müssen, dass das Gewicht des genau gegenüber platziertem Röhrchen jeweils identisch ist (Abb. 2). Sollte die Röhrchenanzahl ungerade sein, so muss ein mit äquivalentem Volumen gefülltes Röhrchen (z. B. mit NaCl) hinzugefügt werden, um das Gewicht auszugleichen.
Prozessierung von PRF
Direkt nach der Zentrifugation werden die Röhrchen vorsichtig aus der Zentrifuge entnommen und in einen entsprechenden Röhrchenhalter überführt. Aufgrund der angewendeten RCF und abhängig von Größe, Form und Dichte der Blutbestandteile, sind nun zwei Phasen erkennbar: eine untere rote Phase, welche hauptsächlich Erythrozyten enthält und eine obere, an die rote angrenzende PRF-Phase.
Im Falle des soliden PRFs, welches aus der Zentrifugation des Bluts in den roten PRF-Röhrchen resultiert, koagulieren diese zwei Phasen sehr schnell. Um die solide PRF-Matrix von der unteren roten Phase zu trennen, empfiehlt es sich, zunächst mit einer Schere eine grobe Trennung der zwei Phasen vorzunehmen. Dafür greift man die feste obere PRF-Phase vorsichtig mit einer sterilen Pinzette und hebt diese an (die untere rote Phase wird dabei mit angehoben) und durchtrennt die beiden Phasen grob im oberen Bereich der roten Phase (Abb. 3) und überträgt die PRF-Phase (mit Resten der roten Phase) in eine dafür vorgesehene PRF-Box.
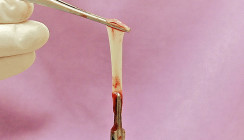
Die PRF-Box besteht aus einem Edelstahlbehälter, einem Deckel mit Eigengewicht sowie einem großen und einem kleinen Stempel und ist speziell für verschiedene PRF-Indikationen entwickelt worden. In dieser Box kann nun mithilfe eines stumpfen Gegenstands (z. B. mit einer geschlossenen Schere) vorsichtig der verbliebene Rest der roten Phase abgestrichen werden. Je nach Indikation können solide PRF-Matrizen dann entweder in einen PRF-Plug (Abb. 4) oder in eine dünngepresste PRF-Matrix (Abb. 5) weiterprozessiert werden.
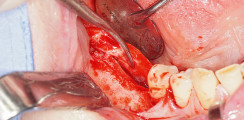
Für die PRF-Anwendung in die Extraktionsalveolen von Weisheitszähnen wird das Fibrin-Clot in die für diese Indikation vorgesehenen Behälter in der Box eingebracht und mithilfe des kleinen Stempels vorsichtig komprimiert, bis die geeignete Größe des PRF-Plugs erreicht ist. Für die PRF-Prozessierung zu einer gepressten PRF-Matrix wird das Fibrin-Clot vorsichtig auf das Gitter der PRF-Box gelegt und mit dem Eigengewicht des Deckels der PRF-Box zu einer gepressten PRF-Matrix verarbeitet. Diese gepresste PRF-Matrix kann dann zum Beispiel als Wundverband auf die Entnahmestellen von freien Schleimhautransplantaten am Gaumen gelegt werden, um die Wundheilung zu fördern. Sie kann zudem auch im Rahmen der Implantation als Unterstützung des Schleimhautlappens dienen.
Im Gegensatz zum oben beschriebenen soliden PRF, welches durch Blutzentrifugation in den Glasröhrchen entsteht, bleiben die zwei Phasen des Bluts, welches in den Plastikröhrchen zentrifugiert wurde, zunächst flüssig. Die Herstellung von flüssigem PRF eröffnet die Möglichkeit weiterer Einsatzbereiche für PRF im Bereich der regenerativen Medizin wie z. B. die Kombination von PRF mit Knochenersatzmaterialien und Kollagenmembranen. Das noch flüssige PRF (obere Phase) wird hierfür vorsichtig mit einer Spritze von der verbleibenden roten unteren Phase abgenommen. Am besten eignet sich hierfür eine 5 ml-Spritze mit einer langen und breiten Kanüle mit einer Größe von 21 Gauge (Abb. 6). Es empfiehlt sich, das Röhrchen leicht zu kippen, um die Grenze zwischen den zwei Phasen besser erkennen zu können und so möglichst viel flüssiges PRF – ohne die rote Phase – abnehmen zu können. Mit der flüssigen Matrix wird die Benetzung der Biomaterialoberfläche reproduzierbarer ablaufen.
Im Gegensatz dazu wird, aufgrund der vorläufigen Ergebnisse der laufenden klinischen Studien, nicht mehr empfohlen, die solide PRF-Matrix zu zerkleinern, um sie mit dem Knochenersatzmaterial im Sinne des sogenannten „Sticky Bone“ zu vermischen.
Die vorliegenden Ergebnisse haben zeigen können, dass es hierbei zu einem Volumenverlust kommen kann, da das Fibrin nach zehn bis 15 Tagen resorbiert wird und damit im Augmentationsgebiet Hohlräume entstehen können. Hierdurch kann es in Folge zu einem Volumenverlust kommen.
Für die Biologisierung von Biomaterialien mit PRF können Biomaterialien verschiedener Klassen und Herkunft, z. B. Knochenersatzmaterialien, kollagenbasierte Membranen (allogen, xenogen, synthetisch), mit solidem oder flüssigem PRF kombiniert werden. Idealerweise sollten Biomaterialien benutzt werden, die keine Fremdkörperreaktion induzieren. Mithilfe des PRFs ist es möglich, diese Materialien zu biologisieren bzw. zu funktionalisieren, da die Materialien selbst über keine bioaktiven Komponenten verfügen, sondern lediglich als Gerüst dienen. Die Funktionalisierung von Biomaterialien mit körpereigenen Zellen, Plasma und Wachstumsfaktoren, welche im PRF enthalten sind, soll zu einer verbesserten Integration des Biomaterials in dem Defekt und somit zu einer erhöhten Regenerationsfähigkeit führen. Die Kombination von PRF mit Knochenersatzmaterialien und kollagenbasierten Membranen erfolgt mittels flüssigem PRF. In diesem Falle wird das in der Spritze gesammelte, flüssige PRF auf die entsprechenden Membranen „geträufelt“, wodurch diese sowohl biologisiert als auch stabilisiert werden, was nicht zuletzt auch die klinische Handhabung vereinfacht (Abb. 7).
Eine ausführliche Literaturliste ist bei den Autoren erhältlich.
Der Beitrag ist im Implantologie Journal erschienen.