Implantologie 14.12.2016
3-D-Formen zur Anpassung konfektionierter, starrer Biomaterialmembranen
share
Der 3-D-Druck ist eine neue und kostengünstige Erweiterung der vormals nur als CAD/CAM-Technologien bekannten Ansätze aus der Industrie. Im folgenden Artikel wird dargestellt, wie diese Techniken zum neuen Ansatz der 3-D-Anpassung von Biomaterialien genutzt werden können. Ein patientenspezifisch gedrucktes Modell der gewünschten Augmentation wird genutzt, um eine konfektionierte Biomaterialschale individuell anzupassen. Das Proof of Concept ist erfolgreich und ermöglicht so eine einfachere und in der Materialdicke dünnere Schale als direkt gedrucktes Biomaterial.
Die Erhöhung des Alveolarkammes oder große seitliche Anlagerungen sind herausfordernde Operationen in der dentalen Implantologie und können als komplexe Knochenaugmentationen zusammengefasst werden.1 Sinnvolle Techniken umfassen ein mechanisch stabilisiertes oder stabiles Augmentat und entsprechende Fixierung im Empfängerlager. Es kann bei der Betrachtung dieser Techniken eine Aufteilung in chirurgisches Vorgehen und Materialkonzept erfolgen.
Beim Knochenaufbau wird entweder autologer Knochen vom selben Individuum oder Fremdmaterial verwendet.2 Das Fremdmaterial kann entweder natürlichen Ursprungs (z. B. Spenderknochen) oder künstlich hergestellt sein (z. B. Hydroxylapatit-Produkte) und entweder partikulär oder als Block aufbereitet sein. Im Falle eines partikulären Knochenaufbaus kann körpereigener Knochen mit Fremdmaterial gemischt werden.
Der klassische lokale Knochenblock kann an einer Entnahmestelle (z. B. Kieferwinkel) entnommen und in der Regel mit Osteosyntheseschrauben im ortsständigen Knochen fixiert werden. Bei einem zweiten Eingriff wird dann die Schraube entfernt und das betreffende Zahnimplantat eingesetzt. Der Nachteil dieser alten Technik besteht in der oft massiven Kortikalis, welche komplett umgebaut werden muss und a priori totes Gewebe darstellt, da die Blutversorgung nicht zeitnah wiederhergestellt werden kann. Der dann eingewachsene Block hat auch im Verlauf über lange Zeit eine hohe mechanische Verlustgefahr. Eine Ausnahme stellt hier der autologe, spongiöse Block dar, welcher meist nur aus dem Beckenkammgebiet sinnvoll zu entnehmen ist. Diese Sonderform des Autografts wird überdies nachgewiesenermaßen fast vollständig umgebaut.3
Im Gegensatz dazu ist mangelnde Resorption, auch bei gegebener Resorbierbarkeit, der explizite Nachteil mutmaßlich aller bisherigen spongiosa-ähnlichen Biomaterialien mit interkonnektierendem Porensystem.3,4 Dies ist bei natürlichen, nicht deproteinisierten, mineralisierten Knochenmatrizen, meist allogenen Ursprungs, besonders fatal, da mit der prothetischen Freilegung und Belastung Proteinmatrix den Keimen der Mundhöhle umfangreich offen gelegt wird und auch bei Ausbleiben initialer Komplikationen später zu frühzeitigen Periimplantitisproblemen führt.5 Nissan et al. zeigten in humanen Histologien, dass bis zu 29 Prozent allogener Spongiosamaterialien nicht resorbiert, sondern lediglich von neuem Knochen umgebaut werden, wohingegen autologer Knochen fast vollständig resorbiert und umgebaut wird.4 Spin-Neto et al. zeigten ebenso in humanen Histologien ähnliche Ergebnisse nach sieben Monaten (n = 17 allogen und n = 12 autolog).3
Aus diesen Gründen sind Techniken, die zum überwiegenden Teil partikulären Eigenknochen verwenden, anderen Techniken überlegen. Da aber bei einer Erhöhung des Alveolarkammes oder großen seitlichen Anlagerungen eine mechanische Stabilisierung nötig ist, verwendet man dünne stabile Elemente zu diesem Zweck, welche das partikuläre Material umschließen. Diese Techniken werden unter dem Begriff Schalentechniken zusammengefasst, da die dünne, stabilisierende Barriere wie eine Schale funktioniert. Neben dem Beckenkammknochen, welcher aufgrund der Entnahmemorbidität zunehmend weniger Anwendung findet, ist daher die biologisch sinnvollste Vorgehensweise eine Schalentechnik.
Es sind verschiedene Schalentechniken bekannt:
Schalen eines allogenen kortikalen Knochens, wobei der Knochen durch Fräsen an den Defekt angepasst wird. Diese Technik ist sehr alt und verwendet abermals allogenen Knochen.6
Schalen eines autologen kortikalen Knochens, welcher vom selben Patienten entnommen wurde und beispielsweise aus dem Bereich des Kieferwinkels im Unterkiefer oder der Maxilla entnommen wird.7,8
Schalen aus nicht resorbierbarem Material (z. B. Titannetz, metallverstärkte PTFE-Membranen), welche durch Biegen an den Defekt manuell angepasst werden. Klassische Beispiele sind die Cytoplast-Membran, GORE-TEX®-Membran, Neoss-Membran, Tiolox-Membran.9,10
Schalen aus Laktiden (Iglhaut-Technik/SonicWeld Rx-System), welche durch Erhitzen formbar gemacht und manuell an den Defekt angepasst werden.11,12
Neuere Techniken wenden auch 3-D-Methoden an, welche unten diskutiert werden. Die hier neu vorgestellte Technik gehört zu diesen 3-D-Techniken. Allerdings wird hier nicht die Schale patientenindividuell auf Basis von Bildgebungsdaten hergestellt, sondern stellt eine Form der gewünschten Augmentation dar. Das geplante Augmentationsergebnis wird zuvor in einem CAD-Verfahren festgelegt und das individuelle 3-D-Modell dann gedruckt. Es kann dann eine konfektionierte Biomaterialschale maßgefertigt angepasst werden. Methode, Software und Produkt sind geschützt und die Technik kann bezogen werden über Tissues & Tools GmbH.
Material und Methoden
Es soll hier eine Verständnisdarstellung für den Praktiker erfolgen. Detaillierte Informationen können aus der Originalpublikation, der Patentschrift und vom Autor entnommen werden. Der bevorzugte Ablauf des Verfahrens ist im Folgenden dargestellt:
Es erfolgt eine Schichtbildgebung zur Darstellung des knöchernen Defektes (vorzugsweise DVT oder CT). Die Daten der Schichtbildgebung werden in eine geeignete Software eingelesen und entweder direkt in diesem Programm zur virtuellen Augmentation in den Schichten verwendet (z. B. Slicer) oder als Daten der knöchernen Oberfläche (z. B. STL-Datensatz) exportiert und dann in ein Programm zur Bearbeitung dieser eingelesen (z. B. Meshmixer). Der knöcherne Defekt wird in dem Programm virtuell aufgefüllt oder rekonstruiert. Die Oberflächendaten des rekonstruierten Defektes werden als Oberflächendatensatz exportiert und entweder direkt oder nach Überführung in einen 3-D-Druckdatensatz (z. B. GCODE-Datei für Ultimaker-Drucker) als 3-D-Modell gedruckt.
Dieses 3-D-Modell dient als CAD/CAM-Biegemodell zur Anpassung eines konfektionierten Biomaterials, um eine dreidimensional passende Schale für die Implantation in den Patienten zu erhalten. Diese Anpassung kann beispielsweise in einem Hitzebad erfolgen, wenn das Biomaterial beispielsweise eine Polylactid-Membran (z. B. KLS Martin, Resorb x) ist. Die Biomaterialplatte ist vorzugsweise – zur Vereinfachung des Vorgangs – konfektioniert in der Größe und wasserdicht steril verpackt, sodass eine übersichtliche Auswahl standardisierter Größen an planen Biomaterialplatten oder auch idealerweise eine einzelne Größe für beliebige, unterschiedliche Defekte verwendet und mit dieser Methode individuell angepasst werden kann. Andere Schalenmaterialien sowie Biegetechniken physikalischer und chemischer Art sind möglich und umsetzbar.
Fallbeispiel 1
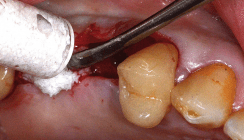
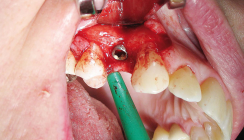
Der Patient ist männlich, 45 Jahre alt, hatte keine Kontraindikationen gemäß Konsensuskonferenz und wies einen Schaltlückendefekt Regio 16 auf. Eine digitale Volumentomografie wurde mit einem Sirona Galileos DVT-Gerät erstellt (Voxelgröße 0,3 mm; 85 kV und 35 mAs). Volumendichte- und Region-of-Interest-(ROI-)Definition, sowie die virtuelle Augmentation erfolgten direkt in den Bildschichten im Programm 3D-Slicer (Version 4.5.0-1 r24735). Hieraus wurde ein STL-Datensatz exportiert, welcher zur Herstellung eines 3-D-Biegemodells in einem Ultimaker 2+ Printer mit FDA-zugelassenem PLA-Filament verwendet wurde (Abb. 1). Die entsprechend angepasste KLS Martin 0,2 mm Resorb x Poly-D-L-Lactic-Acid-(PDLLA-)Membran (30 x 30 mm, perforiert) wurde im Oberkiefer Regio 16 zum vertikalen Knochenaufbau eingebracht und mit Eigenknochen und Geistlich Bio-Oss L augmentiert (Abb. 2). Postoperativ war der Heilungsverlauf komplikationsfrei. Die ISO-Vorschriften wurden entsprechend beachtet.
Fallbeispiel 2
Die Patientin ist weiblich, 55 Jahre alt, hatte keine Kontraindikationen gemäß Konsensuskonferenz und wies bei zahnlosem Oberkiefer einen großen, horizontalen Alveolarkammdefekt Regio 12 bis 14 auf. Es erfolgte eine Planung analog Fall 1 bis zur ROI-Definition (Abb. 3). Nach einem STL-Export wurden die Oberflächendaten in Autodesk Meshmixer (Version 11.0.544) eingelesen und dort die virtuelle Augmentation wesentlich einfacher und schneller durchgeführt. Die weitere Behandlung erfolgte ebenfalls analog Fall 1 mit derselben KLS Martin Resorb x-Membran (Abb. 4). Postoperativ war der Heilungsverlauf komplikationsfrei. Die ISO-Vorschriften wurden entsprechend beachtet.
Diskussion
Der 3-D-Druck ist eine neue und kostengünstige Erweiterung der vormals als CAD/CAM-Technologien bekannten Ansätze aus der Industrie. Im Artikel wurde dargestellt, wie diese Techniken zum neuen Ansatz des 3-D-Biegens von Biomaterialien genutzt werden können. Die hier dargestellte Ausführung verwendet die Kunststoffstrahldrucktechnologie (PJP), wobei der Kunststoff als Filamentfaden von einer Rolle zugeführt wird. In einem 3-D-Drucker dieser Art (z. B. Ultimaker 2+) wird die Form gedruckt, indem der Werkstoff über Zuführschläuche gezogen wird. Der Werkstoff wird daraufhin in einem dünnen Strahl durch die Druckstrahlen gespritzt. Die Bewegung des Druckstrahls wird von der Druckerplatte und dem Kreuzgestänge dreidimensional koordiniert. Die Platte senkt sich nach der Erzeugung jeder Schicht ab, sodass eine neue Schicht auf die letzte aufgetragen werden kann. So entsteht Schritt für Schritt das Objekt in Form eines Festkörpers. Diese Technik ist ein 3-D-Druck mittels geschmolzenen Materialien und wird auch als Fused Filament Fabrication (FFF) oder Schmelzschichtung (z. B. FDM – Fused Deposition Modeling) bezeichnet. Andere Techniken sind aber ebenso anwendbar.
Polylactid-Schale
Es wurde in dieser Anwendung als Biomaterialschale ein Polylactid (Poly-D-L-Lactic-Acid [PDLLA]) verwendet. Die Verwendung von anderem resorbierbarem oder nicht resorbierbarem Material ist möglich. Wobei hierbei alle als Biomaterial geeigneten Verbindungen und Stoffe in Betracht kommen. Insbesondere klassische Polymere wie PLLA, PGA, PCL, PEEK, aber auch neue Biopolymere wie Polyphosphate oder Silikate. Ebenso zählen hierzu geeignete Metalle und Legierungen sowie Keramiken. Es sind aber auch Zuckerverbindungen wie Chitosan oder auch Verbindungen wie Alginat oder Kombinationsmaterialien aus verschiedenen Materialklassen und Materialien möglich, auch natürliche Materialien wie allogener oder xenogener Knochen. Hierbei sind folgende Eigenschaften wichtig und ggf. durch Materialkombination optimierbar:
- Biokompatibilität
- Osteokonduktivität
- Osteoinduktivität
- ggf. Resorbierbarkeit
- ggf. Beladungsmöglichkeit mit Medikamenten und anderen aktiven Substanzen sowie deren Freisetzungskinetik
mechanische Eigenschaften wie E-Modul und Steifigkeit
Bearbeitbarkeit in den verschiedenen möglichen Herstellungsverfahren
Ein bekanntes Problem der einleitend dargestellten, manuell angepassten Schalen ist die mangelnde Passgenauigkeit und der nötige Zeitaufwand zur Bearbeitung im OP. Die europäische Patentanmeldung EP 2 536 446 der Firma ReOss schlägt eine entsprechend individuell angepasste Vorrichtung vor, wobei Oberflächendaten eines Knochendefektes aus einer Schichtbildgebung generiert und der Defekt in einem CAD-Programm virtuell gefüllt wird, um dann eine Schale herzustellen. Zwar ist das Patent in der angemeldeten Form nicht haltbar, das Produkt ist aber sehr gut und als Xyoss-Membran (Geistlich) auf dem Markt.13,14 Diese von der Firma ReOss tatsächlich umgesetzte Membran umfasst individuelle, maßgefertigte, mit CAD/CAM-Technik gefertigte Netzmembranen (Mesh-Gitter) aus Metallen (momentan Titan, aber wohl auch eine resorbierbare Magnesiumvariante in Entwicklung). Hierbei werden Oberflächendaten des Defektes aus einer Schichtbildgebung generiert und der Defekt in einem CAD-Programm virtuell gefüllt. Aus diesen Daten wird ein 3-D-Datensatz für eine Schale erstellt, welcher zum Drucken einer Titan-Mesh-Schale verwendet wird. Diese wird durch ein Laserverfahren aus Titanpartikeln in einem 3-D-Druck-CAM-System gesintert. Diese Vorrichtungen weisen aber eine Reihe von Nachteilen auf:
- Titanmaterial muss entfernt werden, da es nicht resorbierbar ist.
- Magnesium führt bei der Resorption zu Gasbildung, welches erheblich die Knochenheilung beeinträchtigt.
- Beide Materialien müssen aufwendig hergestellt werden und führen somit zu hohen Kosten.
- Beide Systeme arbeiten mit einem Netz, das Löcher aufweist (Mesh), was eine zusätzliche Deckung mit einer Kollagenmembran ggf. erfordert, um ungünstigen Einwuchs von Bindegewebe anstelle von Knochen zu vermeiden, wo eine Periostdeckung fehlt.
3-D-Biegetechnik
Erster Schritt des Ansatzes war es, statt eines aufwendigen Bioprintings, Metall-Lasersinterns o. Ä. eine einfache Kunststoffstrahldrucktechnologie (PJP)/Fused Filament Fabrication (FFF)/Schmelzschichtung (z. B. FDM – Fused Deposition Modeling)-Technik für entsprechend verwendbare Biomaterialien umzusetzen. Diese wurden als Auswahlpatente zum ReOss-Patent umgesetzt. Im Zuge dieser Entwicklung ergab sich aber die Idee einer noch einfacheren Lösung, welche die hier dargestellte 3-D-Biegetechnik (Tissues & Tools GmbH, Prof. Draenert, Tal 4, 80331 München) ist. Neben der Vereinfachung regulatorischer Limits, erlaubt dieser Ansatz eine erhebliche Kostenreduktion, da das eigentliche Implantat in konfektionierter Form hergestellt und gelagert werden kann. Außerdem löst dies ein technisches Problem des 3-D-Drucks von Schalen, welches in einer problematischen Produktion von Materialdicken unter 0,5 mm bei den meisten biokompatiblen Polymeren liegt. Bei den am Markt befindlichen Polylaktiden ist dies sehr wichtig, da die Schalen mit 0,1 oder 0,2 mm deutlich günstiger für die Vermeidung von säurebedingten Osteolysen sind als dickere.15 Aber auch bei anderen möglichen Biomaterialien ist eine geringere Dicke der Osteologie zuträglich.
Fazit
Die vorliegenden Ergebnisse zeigen ein Proof of Concept. Obwohl die Technik sich ansonsten mit den entsprechenden konventionellen Anpassungen von Iglhaut et al. in Bezug auf Materialien und OP-Techniken deckt11, sind klinische Studiendaten zur weiteren Evaluation sinnvoll. Regulatorisch bestehen die Vorgaben für individuelle Medizinprodukte (Section 520[b] of the Food, Drug and Cosmetic Act [FD&C Act]; European Medical Device Directive 93/42 EEC; MPG), einschließlich Risikomanagementakte und klinischer Bewertung.
Dieser Artikel ist eine deutsche, lokale, wissenschaftliche Aufbereitung für den Praktiker aus einer internationalen englischen Originalarbeit desselben Autors.
Die vollständige Literaturliste gibt es hier.
Der Artikel ist im Implantologie Journal 12/2016 erschienen.