Implantologie 11.08.2014
Analyse: Knochenersatzmaterialien ehemaliger Tumorpatienten
share
In der vorliegenden Studie wurde erstmals die Gewebsreaktion ehemaliger Tumorpatienten auf das synthetische Knochenersatzmaterial NanoBone® (NB) und das xenogene Knochenersatzmaterial Bio-Oss® (BO) untersucht. In einem Kollektiv von acht Patienten mit Plattenepithelkarzinomen im Mund- und Halsbereich, die im Vorfeld der Studie erfolgreich therapiert worden waren, wurden in einer Split-Mouth-Studie die beiden Knochenersatzmaterialien zur Sinusbodenaugmentation eingesetzt und nach sechsmonatiger Einheilphase histologisch und histomorphometrisch untersucht. Wie die Ergebnisse zeigen, sind sowohl das synthetische NanoBone® als auch das biologische Bio-Oss® in der Lage, ein suffizientes Implantationsbett zu schaffen.
Die Therapie von Patienten mit einem Tumor des Kopf- und Halsbereiches erfolgt durch die radikale Entfernung des Tumorgewebes und unterstützender Radio- und/oder Chemotherapie.1 Die Lebenserwartung dieser Patienten ist abhängig von der Lokalisation, der Ausdehnung und der Infiltration des Tumors im Vergleich zu einem allgemeinanamnestisch gesunden Patientenkollektiv deutlich verringert (Abb. 1).2 Zudem müssen sich die Patienten im Rahmen der Tumortherapie chirurgischen Eingriffen, oftmals verbunden mit starker Narbenbildung, unterziehen, wodurch ihre Lebensqualität deutlich eingeschränkt wird.3 Aus diesen Gründen ist es nötig, Tumorpatienten mit fehlendem oder reduziertem Zahnbestand einer raschen oralen Rehabilitation zu unterziehen, um Mastikation, Aussprache und ästhetisches Empfinden der Patienten zu verbessern.
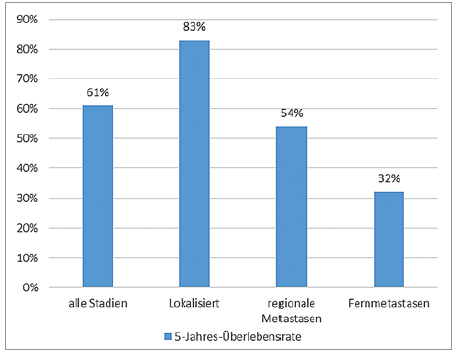
Abb. 1: 5-Jahres-Überlebensrate von Tumoren der Mundhöhle und des Pharynx in Abhängigkeit vom Tumorstaging.2
Die Sinusbodenaugmentation hat sich in den letzten Jahren im Rahmen der Versorgung mit dentalen Implantaten zu einer verlässlichen Methode entwickelt, das lokale Knochenangebot im Vorfeld einer Implantation zu verbessern.4 Für die Augmentation des subantralen Raumes stehen neben autologen Knochentransplantaten eine Vielzahl allogener, xenogener und synthetischer Knochenersatzmaterialien zur Verfügung. Autologer Knochen gilt aufgrund seiner osteoinduktiven, osteokonduktiven und osteogenen Fähigkeiten als Goldstandard für die präimplantologische Augmentation.5 Jedoch ist die Entnahme von autologem Knochen aus dem Hüft- oder Kieferbereich mit einem zusätzlichen chirurgischen Eingriff, einer möglichen Morbidität der Spenderregion und einer erhöhten Gefahr von Komplikationen verbunden.6 Gerade für Patienten mit einer Tumoranamnese gilt es jedoch, jegliche Art zusätzlicher chirurgischer Eingriffe, weitere Klinikaufenthalte und zusätzliche Belastungen zu vermeiden. Aus diesem Grund wurde in der vorliegenden Arbeit erstmals ein Kollektiv ehemaliger Tumorpatienten zur oralen Rehabilitation mit dentalen Implantaten und präimplantologischer Sinusaugmentation versorgt. Im Split-Mouth-Design wurden bei den Patienten das synthetische Hydroxylapatit-basierte (HA) Knochenersatzmaterial NanoBone® (Artoss, Rostock, Deutschland; NB) und das xenogene Knochenersatzmaterial Bio-Oss® (Geistlich, Wolhusen, Schweiz; BO) als Augmentationsmaterial verwendet.
In verschiedenen klinischen Studien konnte das nanokristalline Knochenersatzmaterial NB zeigen, dass es als Leitstruktur für den Einwuchs von Knochen aus dem umliegenden Gewebe dient.7–9 Dabei konnten eine Vielzahl mehrkerniger Riesenzellen sowie eine ausgeprägte Vaskularisation innerhalb des Implantations bettes nachgewiesen werden, die möglicherweise dazu beitragen, dass das Knochenersatzmaterial einem zellulären Abbau unterliegt. Das bovine Knochenersatzmaterial BO zeigte sich in verschiedenen klinischen Studien als biokompatibles, verlässliches Augmentationsmaterial für den Einsatz zur Reparatur parodontaler Defekte sowie zur Sinusboden- und Kieferkammaugmentation. Im Gegensatz zu NB scheint sich BO in das Augmentationsgebiet zu integrieren und keinem zellulären Abbau zu unterliegen.10–13 Simultan mit der nach sechs Monaten Einheilzeit erfolgten Implantatinsertion wurden Knochenbiopsien aus dem Augmentationsbereich entnommen und histologisch und histomorphometrisch untersucht. Der Schwerpunkt der histologischen Untersuchung der Biopsien lag dabei auf der Analyse der Biomaterialintegration, der zellulären Reaktion beteiligter Gewebe und die mögliche Induktion einer Entzündungsreaktion im Augmentationsgebiet. Um den Einfluss der Biomaterialintegration in den humanen Organismus auf das Überleben und den Erfolg der inserierten dentalen Implantate zu erheben, wurden die Patienten nach einer Follow-up-Dauer von zwei Jahren klinisch und radiologisch nachuntersucht.
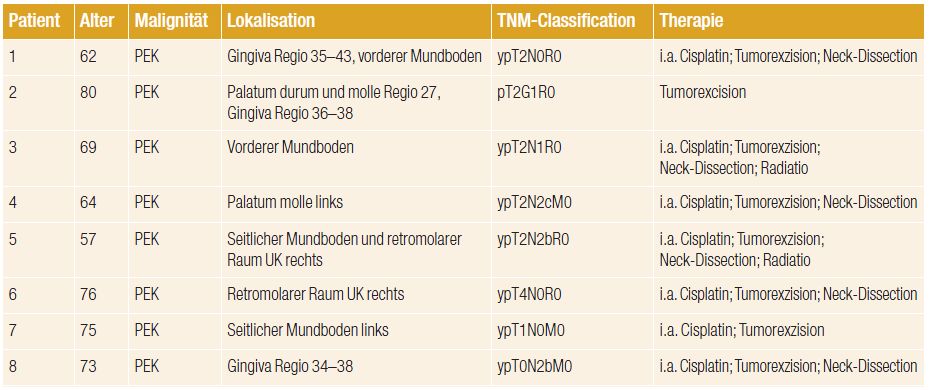
Tab. 1: Tumoranamnese der in der Studie eingeschlossenen Patienten (PEK: Plattenepithelkarzinom; i.a. Cisplatin: intraarterielle Chemotherapie mit Cisplatin präoperativ; UK: Unterkiefer).
Material und Methoden
Studiendesign
Im Rahmen der klinisch-histologischen Studie wurden acht Patienten der Klinik für Mund-, Kiefer- und Plastische Gesichtschirurgie der Universitätsklinik Frankfurt am Main untersucht, die im Zeitraum von Dezember 2004 bis Dezember 2007 mit Sinusbodenaugmentation und anschließender Implantation versorgt wurden.
Teilnehmer der Studie waren fünf Frauen und drei Männer im Alter von 57 bis 80 Jahren (Durchschnitt: 69,5 Jahre, siehe Tab. 1), zum Teil komplett zahnlos, zum Teil mit reduziertem Zahnbestand. Die Studie wurde nach den an der Universitätsklinik Frankfurt am Main geltenden Richtlinien des Protokolls der Ethikkommission durchgeführt. Die Richtlinien der Erklärung von Helsinki wurden während der gesamten Studie eingehalten.
Alle acht teilnehmenden Patienten hatten ein Plattenepithelkarzinom der Mundhöhle, deren TNM-Staging von T1N0M0 bis T2N2M0 reichte. Die Therapie des Primärtumors bestand aus chirurgischer Tumorentfernung, mit vorangegangener intraarterieller Chemotherapie (Cisplatin, sieben von acht Patienten, siehe Tab. 1). Aufgrund der Tumorgröße und des Befalls zervikaler Lymphknoten musste bei sechs Patienten eine funktionelle Neck-Dissection durchgeführt werden.
Um Artikulation und Mastikation wieder herzustellen und das ästhetische Erscheinungsbild der Patienten zu verbessern, sollten die Patienten mit einem suffizienten, implantatgetragenen Zahnersatz versorgt werden. Die Knochenhöhe im Oberkieferseitenzahnbereich war in allen Fällen kleiner 5 mm (3,06 ± 1,02 mm). Die Augmentation wurde nach dem Protokoll einer Split-Mouth-Studie bei allen Patienten unter Intubationsnarkose durchgeführt. Dabei wurde in beiden Sinus maxillares jeweils eines der beiden zu untersuchenden Knochenersatzmaterialien eingebracht, wobei den Patienten und den auswertenden Ärzten nicht bekannt war, welches Knochenersatzmaterial auf welcher Seite eingebracht wurde.
Durchschnittlich sechs Monate (fünf bis sieben Monate) nach der Augmentation wurden insgesamt 62 Implantate der Firma CAMLOG (CAMLOG® SCREW-LINE, CAMLOG Biotechnologies, Basel, Schweiz) inseriert, davon 42 im Oberkiefer und 20 im Unterkiefer (siehe Tab. 2). Ein Patient (Patient 7) wünschte nach erfolgter Augmentation keine Implantation im Oberkiefer. Simultan mit der Implantatinsertion wurden bei Implantationen im augmentierten Bereich mit einem Trepanbohrer (3 mm) Biopsien des Augmentats zur histologischen Untersuchung entnommen. Es konnten durch die Anzahl der im Oberkieferseitenzahnbereich gesetzten Implantate insgesamt 24 Biopsien aus dem augmentierten Bereich des Sinus maxillaris gewonnen werden.
Radiologische Diagnostik in Form von Computertomografieaufnahmen oder Orthopantogrammen wurden prä- und postoperativ (vor und nach Sinusaugmentation sowie nach erfolgter Implantation) angefertigt. Zusätzliche Aufnahmen wurden im Rahmen der Implantatkontrolle zwei Jahre nach deren Insertion angefertigt. Die rechtfertigende Indikation und der Zeitpunkt der Aufnahme wurden mit den regelmäßigen Nachuntersuchungen im Rahmen der Tumorbehandlung abgestimmt.
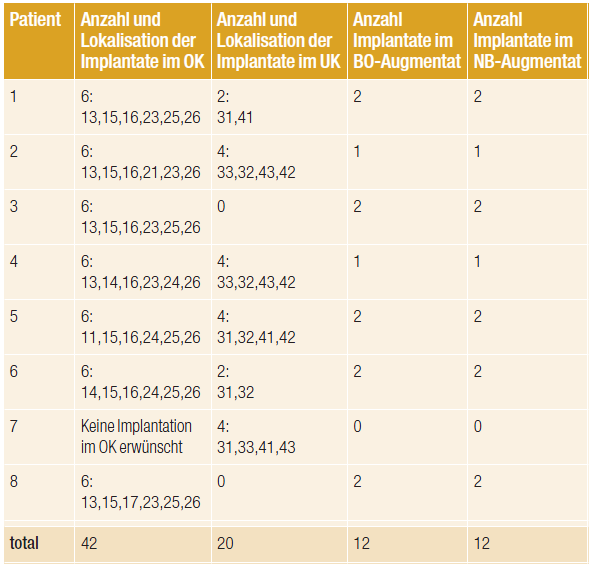
Tab. 2: Übersicht über durchgeführte Implantationen im Ober- und Unterkiefer.
Knochenersatzmaterial NanoBone®
NanoBone® ist ein vollkommen synthetisches Knochenersatzmaterial, das zusammengesetzt ist aus nanokristallinen Hydroxylapatitkristallen, mit einer durchschnittlichen Größe von 60 nm, die eingebettet sind in eine Matrix aus hochporösem Silicagel, mit einer Porengröße von 5 bis 50 nm. Beim Herstellungsprozess kann durch Anwendung eines Sol-Gel-Verfahrens mit Temperaturen bis 700 °C auf einen Sinterprozess verzichtet werden. Durch zahlreiche freie Bindungsstellen des Silicagels, die freie Bindungen mit den Hydroxylapatitkristallen eingehen, entsteht eine interne Oberfläche von bis zu 84m2/g. Die Porosität des Materials beträgt 60 bis 80 Prozent. Die makroskopische Struktur des nanokristallinen Knochenersatzmaterials kann mit der eines Tannenzapfens von durchschnittlich 2 mm Länge und 0,6mm Durchmesser beschrieben werden.14–16
Knochenersatzmaterial Bio-Oss®
Bio-Oss® ist ein xenogenes Knochenersatzmaterial, das aus deprotonierter Knochenmatrix mit bovinem Ursprung besteht. Um aufgrund seiner biologischen Herkunft das Risiko einer Übertragung von Zellen oder Krankheitserregern zu vermeiden, werden organische Komponenten während des Herstellungsverfahrens durch einen chemisch-thermischen Prozess entfernt. BO-Partikel werden bei ca. 1.100 °C gesintert und haben einen Durchmesser zwischen 0,25 und 1,0 mm. Der Sinterprozess führt zu einer Porosität des Materials von 70 bis 75 Prozent mit einer Porengröße von wenigen nm bis 1.500 nm, was dazu führt, dass das Material eine etwas kompaktere, weniger lockere Struktur erhält.17,10
Histologische und histomorphometrische Untersuchung
Anhand der entnommenen Biopsien im Bereich der Augmentation der Sinus maxillaris wurde eine histologische und histomorphometrische Untersuchung der beiden verwendeten Knochenersatzmaterialien NanoBone® und Bio-Oss® durchgeführt. Insgesamt konnten 24 Biopsien von sieben Patienten aus den augmentierten Bereichen im Oberkieferseitenzahnbereich untersucht werden. Die Proben wurden simultan mit der Implantation durchschnittlich sechs (fünf bis sieben) Monate nach der Augmentation des subantralen Raumes entnommen. Unmittelbar nach der Entnahme der Biopsien wurden diese in vier Prozent Formalin fixiert, in TRIS-gepufferter zehn Prozent EDTA-Lösung (Carl Roth, Karlsruhe, Deutschland) dekalzifiziert, mit Alkohol und Xylol bearbeitet und anschließend in Paraffin eingebettet und mithilfe eines Mikrotoms geschnitten.
Um den zentralen Bereich des Knochenkerns lichtmikroskopisch zu untersuchen, wurden sieben aufeinanderfolgende Schnitte jeder Biopsie einer histologischen/-chemischen Färbung unterzogen. Die Färbung dient der Identifikation von Zellen, chemischen Gruppen und Komponenten in präparierten Gewebsschnitten durch Farbreaktionen, die anschließend unter dem Mikroskop beobachtet und mittels histomorphometrischer Analyse quantitativ untersucht werden können.
Folgende histologische und immunhistochemische Untersuchungen wurden durchgeführt:
- Hematoxylin und Eosin (HE-Färbung): Standardfärbung in der Histologie zur Darstellung von unter anderem Zellkernen
- Masson/Goldner-Trichrom: Unterscheidung von mineralisiertem und nichtmineralisiertem Knochen, Erkenntnisse über das Knochen-Remodelling
- Tartratresistente, saure Phosphatase (TRAP): Identifizierung von osteoklastenähnlichen, multinukleären Riesenzellen
- Humane CD31-Antikörper: immunhistochemischer Nachweis von Blutgefäßen und des Enzyms TRAP 5
- Kontrolle.
Die Schnittbilder wurden mit einem Lichtmikroskop (Eclipse 80i, Nikon, Tokio, Japan) histologisch und mithilfe der Software NIS-Elements (Nikon, Tokio, Japan), einer DS-Fi1/Digital Camera (Nikon, Tokio, Japan) und einem automatischen „Scanning Table“ (Prior, Rockland, USA) histomorphometrisch untersucht. Dabei wurde die Neubildung von Knochen und Bindegewebe, der Biomaterialabbau, die Vaskularisation sowie die Migration mehrkerniger Riesenzellen verglichen und statistisch untersucht.18–20
Klinische Nachuntersuchung der inserierten Implantate nach zwei Jahren
Die klinische Nachuntersuchung der inserierten Implantate erfolgte in Anlehnung an die Stellungnahme der Deutschen Gesellschaft für Zahn-, Mund- und Kieferheilkunde zur „Lebenserwartung von Implantaten und Implantatlager“.21 Demnach kann von einem Implantaterfolg gesprochen werden, wenn es sich klinisch fest in situ befindet und der Patient frei von persistierenden, subjektiven Beschwerden wie Schmerz, Fremdkörpergefühl oder Dysästhesie ist. Eine periimplantäre Infektion mit putrider Sekretion oder periimplantärer Osteolyse stellt einen Misserfolg dar. Ein weiteres Misserfolgskriterium stellt eine Stilllegung eines Implantates dar, da dieses dadurch nicht prothetisch nutzbar ist und somit seine Funktion nicht erfüllt.
Statistik
Die Untersuchung wurde mithilfe der SPSS 16.0.1 Software (SPSS Inc., Chicago, USA) durchgeführt, um unterschiedliche Ergebnisse hinsichtlich ihrer Signifikanz zu erforschen. Unterschiede wurden für signifikant befunden, wenn der P-Wert geringer als 0,05 (*P <0,05) war und hoch signifikant bei P-Werten kleiner als 0,01 (**P <0,01) oder 0,001 (***P <0,001).
Ergebnisse
Histologische Ergebnisse
Schnittbilder, die aus Biopsien der mit NB augmentierten Kieferhöhlen angefertigt wurden, zeigen Knochenneubildung und eine gute Integration des Knochenersatzmaterials in das umliegende Gewebe. Abhängig von der Lokalisation der Schnittbilder variiert das Ausmaß der Knochenneubildung. Während der krestale Anteil der Biopsien vor allem aus ortsständigem Knochen besteht, so sind vor allem im zentralen und im apikalen Anteil der Biopsien neu gebildete Knochen und Knochenersatzmaterial zu finden. Die NB-Partikel sind umschlossen von Binde- und Knochengewebe (Abb. 2 A1–A3). Auf ihrer Oberfläche lassen sich mithilfe der TRAP-Färbung zahlreiche TRAP-positive, aber auch TRAP-negative mehrkernige Riesenzellen nachweisen. Es scheint, dass diese Zellen aus dem Bindegewebe im Implantationsbett stammen und sich zur Oberfläche der Knochenersatzmaterialpartikel orientieren. Auf der Oberfläche einiger NB-Partikel lassen sich bei manchen Schnittbildern durch oberflächenassoziierte, mehrkernige Riesenzellen hervorgerufene Resorptionslakunen feststellen (Abb. 3 A1 und A2).
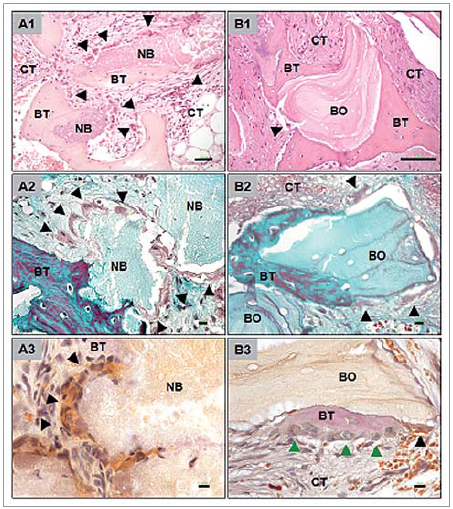
Abb. 2: Gewebsreaktion auf die beiden untersuchten Knochenersatzmaterialien NB und BO.
In der lichtmikroskopischen Untersuchung der Schnittbilder der BO-Augmentate zeigt sich die Einbauung der Knochenersatzmaterialpartikel in neu gebildeten Knochen. Auch hier variiert das Ausmaß der Knochenneubildung in Abhängigkeit von der Lokalisation innerhalb der Biopsien. Die Partikel sind hauptsächlich von Knochengewebe und weniger von Bindegewebe umgeben. Der neu gebildete Knochen weist Osteozyten und osteoblastenähnliche Zellen in Knochentrabekeln oder Havers’schen Kanälen auf. Diese sind ein Zeichen für die Organität und Vitalität des neu gebildeten Knochens. Die Histologie zeigt zudem, dass sich der neu gebildete Knochen direkt an das eingebrachte Knochenersatzmaterial anschließt, wodurch das Augmentat unmittelbar in den Knochen integriert wird (Abb. 2 B1–B3). In der TRAP-Färbung, die zur Identifikation von Makrophagen und mehrkernigen Riesenzellen dient, finden sich keine Anzeichen für eine Fremdkörperreaktion. Nur wenige mehrkernige Riesenzellen sind erkennbar, die nicht direkt mit der Oberfläche der BO-Partikel assoziiert sind (Abb. 3 B1 und B2).
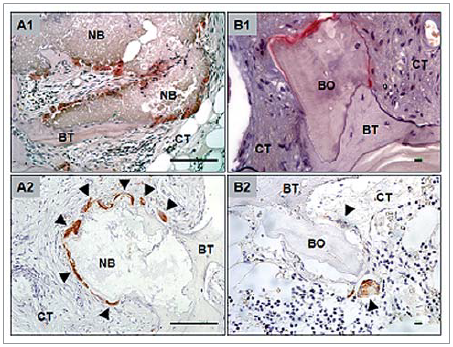
Abb. 3: Histochemischer und immunhistochemischer Nachweis von Tartrate-resistant acid phosphatase (TRAP), die hauptsächlich von oberflächenassoziierten, mehrkernigen Riesenzellen exprimiert wird (Pfeilspitze).
Histomorphometrische Ergebnisse
Mithilfe der histomorphometrischen Untersuchung konnte die Quantifizierung der am Knochenaufbau und -umbau beteiligten Gewebe und Zellen erfolgen. In der histomorphometrischen Auswertung wurde zum einen der Anteil von neu gebildetem Knochen, Bindegewebe und verbliebenem Knochenersatzmaterial in den analysierten Biopsien bestimmt. Zum anderen erfolgte eine Analyse der prozentualen Vaskularisation, der Gefäßdichte und der Anzahl mehrkerniger Riesenzellen.
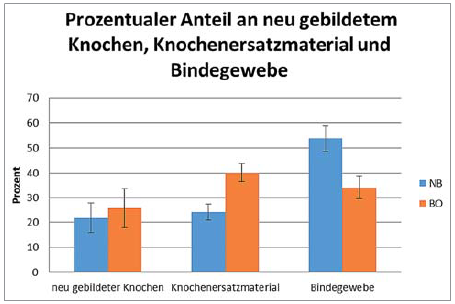
Abb. 4: Darstellung der Ergebnisse der histomorphometrischen Auswertung der Gewebeverteilung (neu gebildeter Knochen, Bindegewebe, verbliebenes Knochenersatzmaterial) innerhalb der NB- und BO-Biopsien.
Ein Vergleich der histomorphometrischen Ergebnisseder Knochenneubildung zeigt einen Anteil von 21,85 ± 5,96 Prozent neu gebildetem Knochen in NB-Biopsienund 25,73 ± 7,94 Prozent in BO-Biopsien. Die statistische Analyse zeigt für diese beiden Werte keinen signifikanten Unterschied. Hingegen ist der Anteil von Knochenersatzmaterial mit 40,13 ± 3,53 Prozent in BO-Biopsien signifikant höher als in NB-Biopsien mit 24,28 ± 3,26 Prozent (p <0,01). Korrelierend dazu zeigt sich in NB-Biopsien ein signifikant höherer Anteil an Bindegewebe, verglichen mit BO-Biopsien (NB: 53,87 ± 5,12 Prozent, BO: 34,14 ± 4,45 Prozent; p <0,001). Des Weiteren zeigt die Statistik einen signifikanten Unterschied zwischen dem Anteil an verbliebenem Knochenersatzmaterial (40,13 ± 3,53 Prozent) und dem Anteil an neu gebildetem Knochen (25,73 ± 7,94 Prozent) innerhalb der BO-Gruppe (p <0,05) (Abb. 4).
Betrachtet man die histomorphometrischen Ergebnisse für die Gesamtzahl der mehrkernigen Riesenzellen, der biomaterialassoziierten TRAP-positiven und TRAP-negativen mehrkernigen Riesenzellen, bestätigt sich der durch die deskriptive Histologie gewonnene Eindruck. Während in NB-Biopsien eine durchschnittliche Gesamtzahl von 50,4 ± 7,16 mehrkernigen Riesenzellen pro Quadratmillimeter gezählt werden konnten, wovon 30,23 ± 5,41 TRAP-positive und 15,97 ± 2,28 TRAP-negative biomaterialassoziierte, mehrkernige Riesenzellen waren, ergeben sich bei BO-Biopsien nur durchschnittlich 16,37 ± 1,72 mehrkernige Riesenzellen pro Quadratmillimeter, wovon 5,09 ± 1,45 alsTRAP-positive und 8,45 ± 3,04 als TRAP-negative biomaterialassoziierte, mehrkernige Riesenzellen identifiziert werden konnten. Ein Vergleich der Gesamtmenge mehrkerniger Riesenzellen ergab einen signifikanten Unterschied (p <0,001). Ebenfalls signifikant zeigte sich der Unterschied von biomaterialassoziierten TRAP-positiven, mehrkernigen Riesenzellen (p <0,001) wie auch biomaterialassoziierten TRAP-negativen, mehrkernigen Riesenzellen (p <0,05) (Abb. 5).
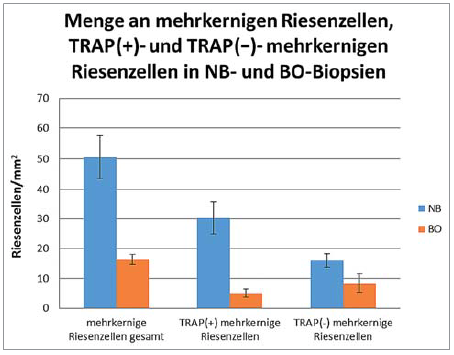
Abb. 5: Darstellung der Ergebnisse der histomorphometrischen Untersuchung der Gefäßmenge pro Quadratmillimeter und der prozentualen Vaskularisation innerhalb der NB- und BO-Biopsien.
Mit
einer durchschnittlichen prozentualen Vaskularisation von 2,66 ± 0,78
Prozent und einer Gefäßdichte von durchschnittlich 13,32 ± 2,64 Gefäßen
pro Quadratmillimeter zeigte das Knochenersatzmaterial NB signifikant
höhere Werte für die Vaskularisation und die Neoangiogenese (p
<0,001). Dem gegenüber stehen für das Knochenersatzmaterial BO-Werte
für die prozentuale Vaskularisation von 0,86 ± 0,07 Prozent und 6,17 ±
1,38 Gefäße
pro Quadratmillimeter für die Gefäßdichte (Abb. 6).
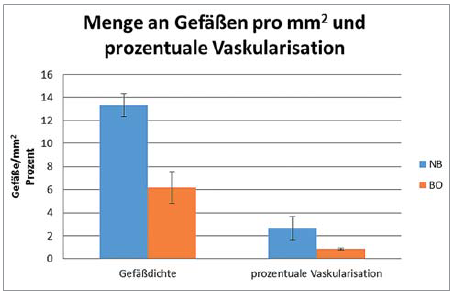
Abb. 6: Darstellung der Ergebnisse der histomorphometrischen Untersuchung der Menge an mehrkernigen Riesenzellen, TRAP(+)- und TRAP(–)-mehrkernigen Riesenzellen in NB- und BO-Biopsien.
Klinische Ergebnisse
Von den in die Studie eingeschlossenen acht Patienten waren fünf mit 18 Implantaten im augmentierten Bereich für die Zwei-Jahres-Nachuntersuchung zugänglich. Die Verteilung der Implantate zwischen Regionen augmentiert mit BO und NB war 1 : 1, mit jeweils neun Implantaten. Insgesamt überdauerten 17 Implantate den zweijährigen Untersuchungszeitraum, was eine Überlebensrate von 94,4 Prozent bedeutet. Ein Implantat, welches in einen mit NanoBone® augmentierten Bereich inseriert wurde, ging verloren. Dadurch ergab sich eine Überlebensrate für diese Implantatgruppe von 88,9 Prozent. Die Überlebensrate für Implantate inseriert in mit BO augmentierten Regionen lag bei 100 Prozent, da kein Implantat verloren ging (Tab. 3).
An keinem der zum Nachuntersuchungszeitpunkt sich in situ befindenden Implantate, weder in mit NB noch mit BO augmentierten Bereichen, beklagten die Patienten subjektive Störungen wie Fremdkörpergefühl, Dysästhesie oder Schmerz. Auch konnten bei der klinischen Untersuchung keine periimplantären Infektionen, putride Sekretion oder Lockerung der Implantate festgestellt werden. Die radiologische Auswertung von Orthopantogrammen oder Computertomografien zwei Jahre nach Implantatinsertion zeigte an keinem der sich in situ befindenden Implantate eine periimplantäre Osteolyse oder einen horizontalen Knochenabbau über die erste Implantatwindung hinaus (Tab. 3).
Bei den Nachsorgeuntersuchungen äußerten die Patienten eine erhebliche Zunahme ihrer Lebensqualität, da sich sowohl ihre Aussprache als auch ihr Kauvermögen stark verbesserte. Keine Anzeichen einer Fremdkörperreaktion oder Wechselwirkung mit Tumortherapie oder Dauermedikation konnten festgestellt werden.
Abbildung 7 und 8 zeigen exemplarisch den Behandlungsverlauf von Patientin 1. Dabei ist in Abbildung 7 die Manifestation des Plattenepithelkarzinoms im Bereich der marginalen Gingiva Regio 35–43 zum Zeitpunkt der Erstvorstellung zu sehen. Abbildung 8 zeigt die im augmentierten Oberkiefer inserierten Implantate zum Zeitpunkt der Implantatfreilegung. Im Rahmen der chirurgischen Tumorresektion war eine Unterkieferteilresektion unumgänglich, die nachfolgend mit einem vaskularisierten Fibulatransplantat rekonstruiert wurde.
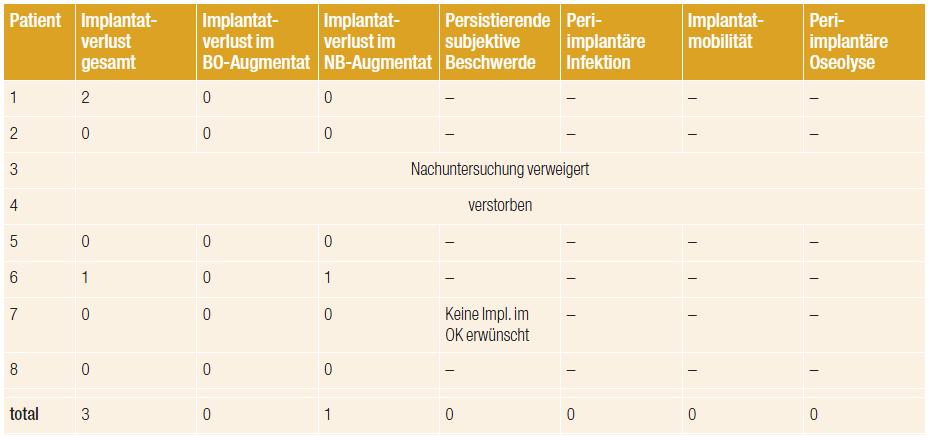
Tab. 3: Ergebnisse der klinischen und radiologischen Nachuntersuchung der Implantate nach zwei Jahren (+ = vorhanden; – = nicht vorhanden).
Diskussion
In der vorliegenden Studie wurde erstmals das Integrations- und Abbauverhalten sowie der Metabolismus des HA-basierenden Knochenersatzmaterials NB und des bovinen Knochenersatzmaterials BO bei Sinusbodenaugmentation bei früheren Tumorpatienten untersucht.
Die histologische Auswertung der NB Biopsien zeigte die störungsfreie Einheilung des Biomaterials. Die Partikel sind umgeben von Bindegewebe und neu gebildetem Knochen, welcher sich spaltfrei an das Knochenersatzmaterial anlagert und in allen Teilen der Biopsien nachgewiesen werden kann. Die im Bindegewebe und auf der Oberfläche der Biomaterial-Partikel zahlreich enthaltenen, mehrkernigen, sowohl TRAP-positiven als auch TRAP-negativen Riesenzellen stammten aus dem umliegenden Gewebe und können als Anzeichen für eine Fremdkörperreaktion innerhalb des Implantationsbettes interpretiert werden. Durch diese anhaltende Fremdkörperreaktion sind auch die hohe Zellaktivität und der hohe Bindegewebsanteil zu erklären.
Die histologische Analyse der BO-Biopsien zeigte die Eingliederung der Partikel in das umliegende Gewebe und die Apposition neu gebildeten Knochens auf deren Oberfläche. Die Knochenneubildung war in allen Teilen der Biopsien zu finden und scheint vom umliegenden nativen Knochen auszugehen. Die Partikel waren mosaikartig in vitalen Knochen eingebettet und nur wenige mehrkernige Riesenzellen waren auf der Oberfläche der Partikel auszumachen. Es waren keine Anzeichen für eine Fremdkörperreaktion zu erkennen.
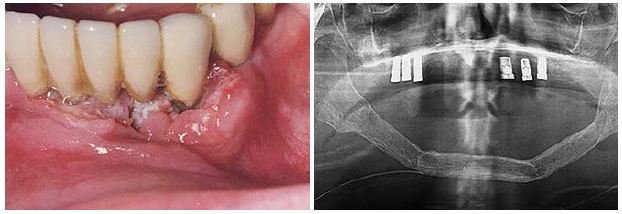
Abb. 7: Intraorale Fotoaufnahme der marginalen Gingiva zum Zeitpunkt der Erstvorstellung (Patient 1). – Abb. 8: Orthopantomogramm zum Zeitpunkt der Implantatfreilegung (Patient 1).
Die histomorphometrischen Ergebnisse unterstreichen die Eindrücke der deskriptiven Histologie, wonach BOGranulate in neu geformten Knochen ein geschlossen werden, wohingegen NB-Partikel vom Organismus abgebaut und durch Bindegewebe und neu gebildeten Knochen ersetzt werden. Die Knochenneubildung zeigte keine signifikanten Unterschiede zwischen beiden Gruppen (NB: 21,85 Prozent; BO: 25,73 Prozent), jedoch war die Menge an verbliebenem Knochenersatzmaterial innerhalb der BO-Gruppe (NB: 24,28 Prozent; BO: 40,13 Prozent; p <0,01) und die Menge an Bindegewebe in der NB-Gruppe (NB: 53,87 Prozent; BO: 34,14 Prozent; p <0,001) signifikant höher.
Durch das weitgehende Fehlen einer Fremdkörperreaktion bei BO-Granulaten sind sowohl die Gesamtzahl der mehrkernigen Riesenzellen (NB: 50,4 mehrkernige Riesenzellen pro mm2; BO: 16,37 mehrkernige Riesenzellen pro mm2; p < 0,001) als auch die Vaskularisation (NB: 2,66 Prozent; BO: 0,86 Prozent; p < 0,001) und die Gefäßdichte (NB: 13,32 Gefäße pro Quadratmillimeter; BO: 6,17 Gefäße pro Quadratmillimeter; p <0,001) in der BO-Gruppe signifikant geringer.
Die in der vorliegenden Studie präsentierten Ergebnisse einer ähnlichen Knochenneubildung beider untersuchter Knochenersatzmaterialien bestätigen die Vermutung, dass der mögliche zelluläre Abbau des Biomaterials durch die mehrkernigen „Osteoclast-like cells“ nicht zwingend nötig für die Knochenneubildung ist. Hingegen scheinen die vorliegenden Ergebnisse zu bestätigen, dass der Abbau eines synthetischen Biomaterials durch eine lokale Entzündungsreaktion hervorgerufen wird und mit einer Kombination aus Neoangiogenese, Bindegewebs- und Knochenneubildung einhergeht.
In einer Untersuchung im Vorlauf dieser Studie wurde die Gewebsreaktion auf das verwendete Knochenersatzmaterial NB in einer In-vivo-Studie in Wistar Ratten bestimmt.18 In einem Zeitraum von sechs Monaten wurde der Einfluss des Siliziumgel-Abbaus auf die Vaskularisation und das Abbauverhalten histologisch und histomorphometrisch untersucht. Es zeigte sich bereits zehn Tage nach der Implantation ein Höhepunkt der Vaskularisation innerhalb des Implantatbettes.
Ghanaati et al. (2012a) verglichen in einer weiteren klinischen Studie die Knochenneubildung nach Sinusbodenaugmentation mit NB sowie dessen Umbau nach einem Zeitraum von drei und sechs Monaten.8 Die histologischen und histomorphometrischen Ergebnisse ergaben eine Knochenneubildungsrate drei und sechs Monate nach der Implantation von 24,89 ± 10,22 Prozent nach drei Monaten und 31,29 ± 2,29 Prozent nach sechs Monaten. Der Unterschied dieser Werte zeigte sich als nicht signifikant. Hinsichtlich des Abbaus des Knochenersatzmaterials zeigte sich eine signifikante Verringerung des Anteils von 29,29 ± 12,25 Prozent nach drei Monaten zu 16,74 ± 1,72 Prozent nach sechs Monaten.
Das auf demineralisiertem Rinderknochen basierende Knochenersatzmaterial BO ist eines der am besten untersuchten und dokumentierten Biomaterialien in der Zahn-, Mund- und Kieferheilkunde. Wenngleich Uneinigkeit bezüglich des Abbauverhaltens von BO im humanen Organismus besteht, konnte in Tier- und klinischen Studien die Fähigkeit des Biomaterials gezeigt werden, als biokompatible Leitstruktur die Knochenneubildung zu fördern.10,22
In einer tierexperimentellen Untersuchung des Knochenersatzmaterials konnten auf der Oberfläche der BO-Partikel mehrkernige Riesenzellen festgestellt werden, allerdings ohne Resorptionslakunen oder eine quantitative Reduzierung des Knochenersatzmaterials zu bewirken. Das Biomaterial wurde von neu gebildetem Knochen eingeschlossen, ohne dass jedoch das Biomaterial ersetzt wurde. Der Autor vermutet, dass die beobachteten mehrkernigen Riesenzellen mehr die Funktion von Makrophagen, wie z.B. zur Reinigung und Vorbereitung der Oberfläche für die Apposition von Knochen haben, als das Biomaterial wirklich abzubauen.10
Yildirim et al. (2000) untersuchten in einer klinischen Studie Biopsien nach Sinusbodenaugmentation mit BO histologisch und histomorphometrisch.22 Es konnte ein durchschnittlicher Anteil an Knochenersatzmaterial von 29,7 Prozent sieben Monate nach dessen Implantation festgestellt werden. Es zeigten sich keine Anzeichen osteoklastischer Aktivität, was den Autor zu der Schlussfolgerung kommen ließ, dass eine sehr geringe und langsame Resorption von BO zu vermuten ist, diese aber nicht bewiesen werden konnte.
Neben der histologischen und histomorphometrischen Untersuchung der aus den Augmentationsstellen entnommenen Biopsien wurde in der vorliegenden Arbeit zusätzlich die klinische und radiologische Performance der im augmentierten Oberkieferseitenzahnbereich inserierten Implantate untersucht.
Nach einem durchschnittlichen Zeitraum von zwei Jahren wurden insgesamt 18 Implantate bei fünf ehemaligen Tumorpatienten nachuntersucht. Zum Zeitpunkt der Nachuntersuchung waren 17 der 18 inserierten Implantate in situ. Betrachtet man alle im augmentierten Oberkieferseitenzahnbereich inserierten Implantate, ergibt sich eine kumulative Implantatüberlebensrate von 94,4 Prozent.
Insgesamt wurden je neun Implantate in beide Augmentationsmaterialien inseriert. Im mit NB augmentierten Bereich ging eines der neun inserierten Implantate verloren, was zu einer Überlebensrate der Implantate von 88,9 Prozent führt. In Regionen, die mit BO augmentiert wurden, waren zum Zeitpunkt der Nachuntersuchung alle Implantate in situ. Somit ergibt sich eine Überlebensrate von 100 Prozent. Sowohl die kumulative Erfolgsrate der Implantate in beiden Gruppen (94,4 Prozent) als auch die separaten Erfolgsraten der NB- und BO-Gruppe (NB: 88,9 Prozent und BO: 100 Prozent) liegen im Bereich derer, die von verschiedenen Autoren für Implantate nach Sinusbodenaugmentation beschrieben worden sind.
In einem systematischen Review von 59 klinischen Studien bezifferten del Fabbro et al. (2008) die Überlebensrate von Implantaten nach Sinusbodenaugmentation mit durchschnittlich 93,62 Prozent.4 Eine Aufschlüsselung der Überlebensraten nach dem verwendeten Augmentationsmaterial ergab Überlebensraten zwischen 88,9 und 96,1 Prozent. Dabei ergab die Auswertung der Studien, in welchen 100 Prozent Knochenersatzmaterial als Augmentationsmaterial verwendet wurde, eine Überlebensrate von 96,1 Prozent. In Studien mit Augmentation mit einer Mischung aus Knochenersatzmaterial und autologem Knochen ergab sich eine Überlebensrate von 94,7 Prozent, wohingegen Studien mit ausschließlich autologem Augmentat eine etwas geringere Überlebensrate erzielen konnten.
Ohne diese Ergebnisse zu überinterpretieren, scheint es doch möglich, dentale Implantate in Verbindung mit Sinusbodenaugmentation zur oralen Rehabilitierung von Tumorpatienten, welche unter einem eingeschränkten Angebot an Weichgewebe und einer verminderten Regenerationsfähigkeit leiden, zu nutzen. Gerade für dieses Patientenkollektiv mit einer verkürzten Lebenserwartung2 und einer aufgrund resektiver chirurgischer Eingriffe verminderten Lebensqualität ist es von großer Bedeutung, eine suffiziente Mastikation und Artikulation wiederherzustellen. Die Ergebnisse haben gezeigt, dass sich für die präimplantologische Augmentation sowohl xenogene (BO) als auch synthetische (NB) Knochenersatzmaterialien eignen.
Das Ergebnis der vorliegenden Studie mit einem relativ kleinen Patientenkollektiv sollte nicht überinterpretiert werden. Für die Zukunft sind weitere Studien über den Einsatz von synthetischen und biologischen Knochenersatzmaterialien zur Augmentation bei Tumorpatienten nötig.
Selbstverständlich sollte die Indikation für den Einsatz von Knochenersatzmaterialien im Allgemeinen und bei dem vorliegenden Patientengut im Speziellen individuell genau geprüft werden. Auch sind Knochenersatzmaterialien, gleich welchen Ursprungs, keineswegs ein gleichwertiger Ersatz für autologe Knochentransplantate. Für die Regeneration von großen knöchernen Defekten, wie z.B. nach Kieferteilresektionen, bleibt die autologe Knochentransplantation nach wie vor das Mittel der Wahl zur Defektregeneration. Des Weiteren muss zwingend erwähnt werden, dass die Indikation für die Augmentation mit Knochenersatzmaterialien bei Tumorpatienten noch enger gestellt werden muss, als es bei gesunden Patienten ohnehin schon nötig ist.
Zusammenfassung
Die vorliegende Studie konnte zeigen, dass sowohl das synthetische Nano-Bone® als auch das biologische Bio-Oss® im speziellen Patientenkollektiv von ehemaligen Tumorpatienten in der Lage sind, ein suffizientes Implantationsbett zu schaffen. Dabei zeigte NB die Induktion einer Entzündungsreaktion mit einer erhöhten Vaskularisation und der Migration mehrkerniger Riesenzellen, die zum Abbau des Knochenersatzmaterials führten. Im Gegensatz dazu löste BO eine nur sehr geringe inflammatorische Antwort aus und die Partikel wurden nur wenig von mehrkernigen Riesenzellen besiedelt, sondern von neu gebildetem Knochen umschlossen. Beide Knochenersatzmaterialien erzeugten eine Knochenneubildung, die es ermöglichte, Implantate im Augmentationsgebiet zu inserieren. Zwei Jahre nach der Implantatinsertion waren 17 von 18 Implantate in situ und konnten für die prothetische Verankerung genutzt werden, um Mastikation und Artikulation der Patienten wiederherzustellen.
Anmerkung
Dieser Artikel und die darin enthaltenen Abbildungen wurden erstmals im Journal „Annals of Maxillofacial Surgery“ publiziert und freundlicherweise für die Wiederverwendung zur Verfügung gestellt.
Ghanaati S, Barbeck M, Lorenz J, Stuebinger S, Seitz O, Landes C et al. Synthetic bone substitute material comparable with xenogeneic material for bone tissue regeneration in oral cancer patients: First and preliminary histological, histomorphometrical and clinical results. Ann Maxillofac Surg 2013; 3(2):126–38.
Hier gibt's die vollständige Literaturliste.
Autoren: Jonas Lorenz, Mike Barbeck, Constantin Landes, Robert Sader, Sharam Ghanaati










