Oralchirurgie 21.12.2015
Therapie von oralen Leukoplakien und malignen Mundschleimhautläsionen
share
Trotz erheblicher Fortschritte in der Diagnostik von oralen Leukoplakien und anderen oralen Vorläuferläsionen sind diese Veränderungen nach wie vor mit einer hohen Morbidität behaftet, da es trotz intensiver Bemühungen in der Krebsvorsorge häufig zu malignen Transformationen in ein orales Plattenepithelkarzinom kommt. Der vorliegende Artikel soll die Möglichkeiten der Therapie von oralen Leukoplakien beleuchten.
In der WHO-Klassifikation von 2005 wurde der einheitliche Begriff der epithelialen Vorläuferläsion für Läsionen der Mundschleimhaut, die mit einem erhöhten Risiko der Entwicklung eines Plattenepithelkarzinoms der Mundhöhle behaftet sind, eingeführt. Dieser Begriff ersetzt die früheren Bezeichnungen wie Präkanzerosen, prämaligne Zustände und epitheliale Dysplasien.1
Die mit Abstand häufigste klinische Erscheinung der oralen epithelialen Vorläuferläsion ist die Leukoplakie.2 Die Definition dieses Begriffes geht auf den Dermatologen Ernst Schwimmer aus dem Jahre 1877 zurück, der die Leukoplakie als einen „weißen, nicht abwischbaren Fleck der Mundschleimhaut“ bezeichnete, „der weder klinisch noch histologisch einer anderen Erkrankung zugeordnet werden kann“. Weitere, weitverbreitete orale Vorläuferläsionen sind die Erythroplakie, erosive Formen des oralen Lichen planus (OLP) und in Südostasien zusätzlich die submuköse Fibrose.3 Weitere, jedoch seltener vorkommende Formen der oralen Vorläuferläsionen sind die aktinische Keratose im Bereich der Unterlippe, die proliferative verruköse Leukoplakie (PVL), der diskoide Lupus erythematodes, Immundefizienz-Syndrome und die seltenen vererbbaren Formen des Mundhöhlenkarzinoms wie der Glukose-6-Phosphat-Dehydrogenase-Mangel.4,5
Epidemiologie und Ätiologie
Die weltweite Prävalenz für epitheliale Vorläuferläsionen liegt zwischen ein und fünf Prozent, wobei sich enorme geographische und geschlechtsabhängige Unterschiede zeigen. Dabei fand sich eine erhöhte Prävalenz in Entwicklungsländern in Abhängigkeit von recht unterschiedlichen Expositionsmustern gegenüber Kanzerogenen.6,7 In Deutschland beträgt die Prävalenz für Männer 2,3 Prozent und für Frauen 0,9 Prozent.8
Zur Inzidenz von oralen Vorläuferläsionen gibt es nur wenige Studien. Die Inzidenz variiert zwischen 0,6 und 30,2/1.000 Menschen pro Jahr.9 In den Ländern der ersten Welt sind Leukoplakien eher Krankheiten des höheren Lebensalters mit einem Gipfel zwischen der fünften und sechsten Dekade,10,11 während das durchschnittliche Erstmanifestationsalter in Entwicklungsländern fünf bis zehn Jahre früher liegt.12 Männer sind häufiger betroffen als Frauen. Je nach Studie beträgt das Geschlechterverhältnis 1,37:1 bis 6:1.10,13 Leukoplakien können prinzipiell an allen Stellen der Mundhöhle auftreten. Prädilektionsstellen sind Wangenschleimhaut, die Zunge, der Mundboden und die Lippen.8,10,12,14
Der größte Anteil der Leukoplakien ist mit Tabakkonsum assoziiert.15 Das Risiko ist um das sechsfache erhöht.16–18 Die Anzahl der kanzerogenen und mutagenen Substanzen ist enorm, am wichtigsten sind Nitrosamine und aromatische Kohlenwasserstoffe wie das 3,4-Benzpyren.19 Alkohol gilt als eigenständiger Risikofaktor für die Entstehung von Leukoplakien, unabhängig von der Alkoholkonzentration der Getränke.20 Kombinierter Alkohol- und Nikotinkonsum führt zu einer 6- bis 15-fachen Risikosteigerung. Die Effekte sind nicht additiv, sondern multiplikativ, da Alkohol die Permeabilität der Mundschleimhaut für Kanzerogene des Tabaks erhöht.21 Als weitere Risikofaktoren gelten schlechte Mundhygiene, Eisenmangelanämie, mechanische Irritationen durch schlecht sitzenden Zahnersatz und eine Pilzinfektion mit Candida albicans.22 Seit einigen Jahren wird auch eine Infektion mit humanen Papillomaviren (HPV) als unabhängiger Risikofaktor diskutiert (Tab. 1).23–25
Klinisches Erscheinungsbild
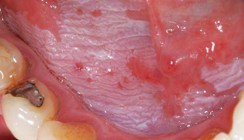
Leukoplakien zeigen ein äußerst variables klinisches Erscheinungsbild. Es wird die homogene und inhomogene Leukoplakie unterschieden. Beide Formen unterscheiden sich durch Begrenzung, Oberfläche, Profil, Dicke und Farbton.26,27 Eine homogene Leukoplakie hat eine flache, dünne, scharf begrenzte und gleichmäßig weiße Gestalt. Das Risiko einer malignen Entartung ist gering. Die inhomogene Leukoplakie weist eine verruköse oder erosive Oberfläche auf, die Farbe variiert zwischen Weiß und WeißRot (Erythroleukoplakie), wobei das Risiko einer malignen Transformation um ein Vielfaches erhöht ist.17,28 Eine Sonderform stellt die proliferative verruköse Leukoplakie dar, die durch multifokales Auftreten, Therapierefraktärität und mit einem hohen Risiko der malignen Transformation assoziiert ist.27 Abbildung 1 zeigt das klinische Bild einer homogenen Leukoplakie, Abbildung 2 das einer verrukösen Leukoplakie.
Früherkennung
Die frühe Diagnostik von oralen Plattenepithelkarzinomen beziehungsweise das Erkennen von epithelialen Vorläuferläsionen mit einem Entartungsrisiko ist für die Verbesserung der Prognose der Patienten von enormer Bedeutung, da die Wahrscheinlichkeit, an einem oralen Plattenepithelkarzinom zu versterben, mit zunehmendem Tumorstadium steigt.29,30 Lediglich zehn Prozent der Mundhöhlenkarzinome fallen durch gezielte Früherkennungsmaßnahmen oder als Zufallsbefunde auf, was im Umkehrschluss bedeutet, dass 90 Prozent der Patienten zum Zeitpunkt der Diagnosestellung Symptome wie Schwellung der Halslymphknoten, Schmerzen oder auch Störungen der Kaufunktion aufweisen, die auf ein fortgeschrittenes Tumorstadium hindeuten. Dazu addiert sich noch eine Diagnoseverzögerung von durchschnittlich zwei bis vier Monaten durch den behandelnden Arzt oder Zahnarzt, was die Prognose der Patienten weiter verschlechtert.31

Die Zahlen weisen auf die überragende Bedeutung der frühen Diagnose eines Mundhöhlenkarzinoms und der Vorläuferläsionen hin, die dann entsprechend behandelt werden können.32 Aufgrund der enormen Bedeutung der Früherkennung von Mundhöhlenkarzinomen und deren Vorläuferläsionen gibt es eine S2k-Leitlinie der Deutschen Gesellschaft für Zahn-, Mund- und Kieferheilkunde, die konkrete Empfehlungen zum Vorgehen bei Mundschleimhautveränderungen gibt und sich an Zahnärzte, Oralchirurgen, Mund-, Kiefer- und Gesichtschirurgen sowie Hals-Nasen-Ohren-Ärzte wendet (www.dgzmk.de). Eine große Herausforderung stellt dabei die Differenzierung von Vorläuferläsionen mit hohem Entartungsrisiko und solchen mit geringem Entartungsrisiko dar. Dazu wurden in den letzten Jahren und Jahrzehnten verschiedene Techniken entwickelt, die mehr oder weniger erfolgreich sind und im folgenden Abschnitt dargestellt werden.
Diagnostik und Differenzialdiagnostik
Jede Veränderung der Mundschleimhaut wird zunächst klinisch durch Inspektion und Palpation diagnostiziert. Die klinische Beschreibung einer Leukoplakie zur Risikoabschätzung beispielsweise ist jedoch nur bedingt hilfreich, da sich hinter dem klinischen Bild einer Leukoplakie eine Vielzahl unterschiedlicher, meist nicht neoplastischer Schleimhautveränderungen verstecken. Allerdings können sich auch hinter einer harmlos erscheinenden, homogenen Leukoplakie eine dysplastische Veränderung oder ein invasiv wachsendes Karzinom verbergen.6
Im Rahmen der Diagnostik haben sich neben der histopathologischen Diagnosesicherung verschiedene Verfahren in der klinischen Routinediagnostik etabliert. Der Goldstandard zur Abklärung bleibt die histologische Sicherung durch Inzisions- oder Exzisionsbiopsie. Bei persistierenden und unklaren Befunden kommt man an einer histologischen Diagnosesicherung nicht vorbei. Neben der klinischen Beurteilung der Mundschleimhaut haben sich in den letzten Jahren verschiedene nichtinvasive Verfahren etabliert, die den Behandler bei der Risikobeurteilung der Mundschleimhautveränderungen unterstützen.33–35
Histologische Diagnosesicherung
Eine definitive Diagnose ist jedoch nur durch eine histologische Untersuchung möglich.36,37 Die Leitlinie der DGZMK empfiehlt eine histologische Diagnostik, wenn sich nach zwei Wochen unter Ausschaltung der Noxen keine Rückbildungstendenz zeigt, beziehungsweise, wenn die Läsion nach spätestens vier Wochen nicht vollständig abgeheilt ist. Mikroskopisch lassen sich so das Vorhandensein beziehungsweise der Grad der epithelialen Dysplasie und invasives Wachstum beurteilen.7,38
Fünf Prozent der klinisch diagnostizierten Leukoplakien sind invasiv wachsende Plattenepithelkarzinome, in 25 Prozent findet eine histologisch nichtinvasiv wachsende, orale Vorläuferläsion statt.39 Der Grad der histologisch ermittelten Dysplasie stellt die Grundlage für die verschiedenen Klassifikationssysteme oraler Vorläuferläsionen dar. Aufgrund der mangelnden Kenntnis geeigneter Marker und der im Vergleich zum Serum geringen Konzentration geeigneter Marker im Speichel steht die Erforschung von Speichel als Medium zur Früherkennung von Krankheiten noch am Anfang.
Histomorphologische Klassifikationssysteme
In der aktuellen WHO-Klassifikation werden drei verschiedene histomorphologische Klassifikationssysteme für orale epitheliale Vorläuferläsionen als gleichberechtigt nebeneinander vorgestellt (Tab. 2).40 Die aktuelle Klassifikation der WHO von 2005 unterscheidet zwischen hyperplastischen und dysplastischen Leukoplakien und unterscheidet dabei fünf Schweregrade.39,40 Histomorphologische Kriterien der Dysplasie umfassen sowohl den Verlust der Epithelschichtung als auch zytologische Atypien wie Kernpolymorphien, Nukleolenvergrößerung, hyperchromatische Kerne und atypische Mitosen.11,26,41 Jedoch muss hierbei beachtet werden, dass es keine festen Kriterien gibt, um das Spektrum der Dysplasie exakt in leichte, mittlere und schwere Dysplasien einzuteilen. Studien haben ausgeprägte Unterschiede in der Beurteilung des Vorhandenseins und des Ausprägungsgrad der Dysplasien durch verschiedene Untersucher zeigen können.36,38 Um diesem Phänomen entgegenzuwirken, schlugen Kujat et al. ein binäres Gradingsystem vor, das die fünf Kategorien der WHO nur noch in „low-risk lesions“ und „high-risk lesions“ einteilt und so eine bessere Reproduzierbarkeit erzielt wird.41
2005 wurde neben der WHO-Klassifikation das Konzept der squamösen intraepithelialen Neoplasie eingeführt und mit „SIN“ abgekürzt.1,39 Die squamöse intraepitheliale Neoplasie beschreibt den auf histologischen und zytologischen Kriterien basierenden Grad der epithelialen Architekturstörung und vermeidet dabei den Begriff der Dysplasie. Der Begriff der squamösen intraepithelialen Neoplasie beschreibt die intraepitheliale Neubildung bei erhaltener Basalmembran exakt, wohingegen Dysplasie ein mehrdeutiger Begriff ist: Er beschreibt einerseits zelluläre Atypien in epithelialen Zellverbänden, sowohl in Vorläuferläsionen als auch in invasiven Karzinomen. Zudem wird der Begriff der Dysplasie bei ossären Systemerkrankungen wie der fibrösen Dysplasie und anlagebedingten Anomalien verwendet.1
Analog zur Dysplasie werden bei der squamösen intraepithelialen Neoplasie drei Stufen unterschieden: SIN I, SIN II und SIN III (Abb. 3). Abbildung 3a der SIN-Klassifikation zeigt eine Epithelhyperplasie. Der Pfeil weist auf die Basalmembran, wo sich keine dysplastischen Veränderungen zeigen. Abbildung 3b zeigt eine Neoplasie der Stufe SIN I. Der dicke Pfeil zeigt auf die dysplastischen Zellen im basalen Drittel; der dünne Pfeil zeigt auf die suprabasalen zwei Drittel des Epithels, wo keine dysplastischen Veränderungen zu finden sind. Abbildung 3c zeigt eine Neoplasie der Stufe SIN II. Der dicke Pfeil weist auf die dysplastischen zwei Drittel der Suprabasalschicht hin, der dünne Pfeil weist auf das obere Drittel, wo sich keine Dysplasien finden. In Abb. 3d ist eine SIN III-Klassifikation zu sehen. Der Pfeil zeigt die dysplastische Region an, die sich von der Basalmembran bis zur obersten Schicht des Epithels erstreckt. Alle Bilder sind in 200-facher Vergrößerung.
Das wichtigste Unterscheidungskriterium der SIN-Klassifikation zur WHO-Klassifikation ist die Zusammenfassung der schweren Dysplasie und des Carcinoma in situ zur hochgradigen SIN (SIN III), da bei beiden Stufen ein identisches Entartungsrisiko von 90 Prozent vorliegt.40 Damit verbunden sind entsprechende klinische Konsequenzen. Bei einer Epithelhyperplasie sind keine weiteren Kontrollen nötig. Regelmäßige Kontrollen in Abständen von drei bis sechs Monaten sind bei niedriggradigen und mäßiggradigen intraepithelialen Neoplasien (SIN I und SIN II) notwendig, während bei einer hochgradigen intraepithelialen Neoplasie (SIN III) eine vollständige Entfernung der Läsion aufgrund einer Entartungswahrscheinlichkeit von 90 Prozent nötig ist (Abb. 7).40
Die dritte, von der WHO momentan akzeptierte Klassifikation ist die Ljubljana-Klassifikation für squamöse intraepitheliale Läsionen (SIL), die im deutschsprachigen Raum wenig gebräuchlich ist.1,42 Sie wurde vor mehr als 40 Jahren für die Beschreibung laryngealer Präkanzerosen entwickelt.43 Obwohl die prognostische Qualität dieser Klassifikation in Studien nachgewiesen wurde,42,44 konnte ein Nutzen für orale Vorläuferläsionen nicht nachgewiesen werden.45
Zweck aller Klassifikationssysteme ist die Einteilung der verschiedenen Dysplasiegrade in Abhängigkeit vom Risiko der malignen Transformation. Die größte Studie an 210 Patienten mit oralen Vorläuferläsionen konnte einen statistisch signifikanten Unterschied zwischen der Entartungsrate von Patienten mit dysplastischen Leukoplakien und Patienten mit Leukoplakien ohne Dysplasie feststellen, jedoch zeigte sich kein signifikanter Zusammenhang zwischen dem Grad der Dysplasie und Entartungsrate.46 Der Grund für dies scheint jedoch zu sein, dass Leukoplakien mit hohem Dysplasiegrad nach einer Biopsie vollständig exzidiert wurden. Andere Studien kamen dabei zu ähnlichen Ergebnissen.7,47
Neben dem Dysplasiegrad gibt es jedoch noch andere Faktoren, die mit einem erhöhten Entartungsrisiko assoziiert sind.2,48 Um diesen Faktoren Rechnung zu tragen wurde von van der Waal et al. eine Stadiengruppierung für orale Vorläuferläsionen entworfen, die neben dem Vorhandensein einer Dysplasie auch die flächige Ausdehnung der Läsion, die Lokalisation in der Mundhöhle und das klinische Erscheinungsbild (homogen/inhomogen) berücksichtigt.49
Behandlung von oralen Vorläuferläsionen
Bis zum heutigen Tag gibt es kein einheitliches Behandlungskonzept, mit dem das Risiko einer malignen Transformation von oralen Leukoplakien ausgeschaltet werden kann.50 Es stehen verschiedene chirurgische und konservative Verfahren zur Auswahl. Die Ergebnisse dieser Studien sind recht unterschiedlich, was unter anderem an unterschiedlichen Einschlusskriterien und an unterschiedlich langen Nachbeobachtungszeiträumen liegt.
Invasive Therapieverfahren
Entsprechend der S2-Leitlinie zur Früherkennung von Mundhöhlenkarzinomen wird eine chirurgische Exzision von oralen Vorläuferläsionen bei Diagnose einer SIN II- oder SIN III-Läsion empfohlen (www.dgzmk.de). Bei SIN I-Läsionen wird zunächst ein abwartendes Vorgehen empfohlen. Eine engmaschige Nachkontrolle in Abständen von drei Monaten ist bei allen dysplastischen Läsionen erforderlich, bei nicht dysplastischen Leukoplakien reicht ein Kontrollintervall von sechs Monaten aus.
Chirurgisch können epitheliale Vorläuferläsionen mittels konventioneller Chirurgie, Elektrochirurgie, Kryochirurgie und Laserchirurgie angegangen werden.51 Bei der konventionellen Chirurgie wird ein primärer Wundverschluss angestrebt, je nach Größe der Läsion ist jedoch die Defektdeckung mit einem Transplantat, zum Beispiel einem Spalthauttransplantat, notwendig. Ein wesentlicher Vorteil der kompletten chirurgischen Exzision ist die hohe onkologische Sicherheit, da das komplette Resektat aufgearbeitet werden und somit ein frühes, invasives Karzinom erkannt werden kann, das bei einer Inzisionsbiopsie möglicherweise nicht erfasst worden wäre.
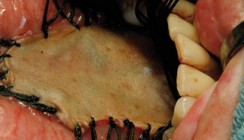
Dies zeigt sich im vorliegenden Fall (Abb. 4 und 5): Eine 44-jährige Patientin mit einer vom Hauszahnarzt biopsierten Läsion und histologisch gesichtertem SIN III-Status wurde zur kompletten Exzision an die Mund-, Kiefer- und Gesichtschirurgie der Universität Köln überwiesen. Nach Exzision des kompletten Befunds zeigte sich ein frühes, invasives Plattenepithelkarzinom der Kategorie pT1. Entsprechend der S3-Leitlinie für Mundhöhlenkarzinome erfolgte eine beidseitige supraomohyoidale Neck dissection der Level I–III, wobei sich rechts zwei Lymphknotenmetastasen und links eine Lymphknotenmetastase zeigte, was für den Lymphknotenbefall eine pN2c-Kategorie ergab und somit einen Tumor des UICC-Stadiums IV. Im Anschluss wurde eine postoperative Strahlentherapie mit 66 Gy durchgeführt. Ohne eine entsprechende vollständige Exzision wäre dieser Tumor sicher nicht erkannt und höchstwahrscheinlich erst in einem unheilbaren Stadium entdeckt worden.
Allerdings ist eine komplette chirurgische Entfernung bei ausgedehnten Läsionen problematisch, ebenso bei Vorläuferläsionen an bestimmten Stellen, da es durch eine Entfernung zu einem Funktionsverlust kommt.52,53 Amagasa et al. konnten zeigen, dass die Rate an malignen Transformationen nach kompletter chirurgischer Exzision geringer ist als ohne Therapie, was die Autoren darauf zurückführen ließ, dass maligne Tumore selten im Bereich von exzidierten Schleimhautveränderungen entstehen.46,50 Jedoch gibt es keine klinisch kontrollierten, randomisierten Studien, die verschiedene Therapieoptionen miteinander vergleichen.54 Andere Studien hingegen konnten keine Verringerung der malignen Transformationsrate bei epithelialen Vorläuferläsionen zeigen. Eine große Metaanalyse kam zu dem Schluss, dass eine chirurgische Entfernung von epithelialen Vorläuferläsionen das Risiko einer malignen Transformation senkt, aber nicht komplett eliminiert.55
Elektrochirurgie und Kryochirurgie
Der wesentliche Aspekt der Kryotherapie besteht darin, durch einen örtlich begrenzten Temperaturabfall eine Nekrose des behandelten Gewebes zu induzieren. Kryogene Substanz hierbei ist meist flüssiger Stickstoff. Das Verfahren zeichnet sich insbesondere durch eine einfache Anwendung aus und erbringt kosmetisch und funktionell zufriedenstellende Ergebnisse.56 Sowohl bei der Kryochirurgie als auch bei der Elektrochirurgie sind postoperative Schmerzen und Ödeme recht ausgeprägt.57 Der schwerwiegendste Nachteil der Kryo- und Elektrochirurgie besteht in der fehlenden Kontrolle der Tiefenwirkung, was dazu führen kann, dass invasive Plattenkarzinome eventuell übersehen werden beziehungsweise in der Folgezeit auftreten.58
Lasertherapie von Vorläuferläsionen
Auch Lasersysteme werden bei der Behandlung oraler Leukoplakie häufig eingesetzt. Hier kommt vor allem der CO2-Laser zum Einsatz. Ein großer Vorteil dieser Behandlungsmodalität sind die verhältnismäßig geringen Schmerzen; außerdem ist das Risiko von Nachblutungen, wie sie bei der chirurgischen Exzision vorkommen können, minimiert. Eine Defektdeckung ist hier nicht notwendig, sodass die laserchirurgische Abtragung oraler Leukoplakien vor allem bei flächigen Leukoplakien vorteilhaft ist. Ein weiterer, wesentlicher Vorteil gegenüber Kryo- und Elektrochirurgie ist die relativ geringe Wundkontraktion, was somit eine minimale orale Dysfunktion zur Folge hat.57 Auf den Abbildungen 6 bis 8 ist die laserchirurgische Behandlung einer epithelialen Vorläuferläsion am Weichgaumen in drei Schritten dargestellt. Grundsätzlich können die Läsionen mittels Laser exzidiert oder vaporisiert werden, wobei eine histopathologische Beurteilung des Präparates nach der Vaporisation allerdings nicht mehr möglich ist.51 Hier ist eine vorausgehende Probeentnahme erforderlich. Die Heilungsraten nach laserchirurgischer Abtragung schwanken stark zwischen 34 und 82 Prozent. Rezidive wurden zwischen 8 und 66 Prozent beobachtet.59
Photodynamische Therapie
Die Photodynamische Therapie (PDT) stellt eine Behandlungsmöglichkeit für epitheliale Vorläuferläsionen, aber zum Beispiel auch für einen Candida-Befall dar. Das Prinzip ist das topische oder systemische Einbringen eines Photosensitizers, der anschließend mittels Laserbestrahlung eine Aktivierung im Gewebe hervorruft.60,61 Durch die Aktivierung mit der korrespondierenden Wellenlänge wird intrazellulär die Bildung von freien Radikalen angeregt sowie die Produktion von singulärem Sauerstoff, was in der Folge zum Zelltod führt, zum einen durch Gefäßverschlüsse, zum anderen durch die oxidative Schädigung von Zellbestandteilen.62 Auf Abbildung 9 und 10 ist die Photodynamische Therapie einer Candida-Läsion dargestellt.
Nichtinvasive Therapieverfahren
So wichtig eine chirurgische Entfernung von Hochrisikoläsionen auch sein mag, an erster Stelle der Behandlung steht zunächst ein konservativer Therapieansatz. Erster Schritt in der Behandlung von epithelialen Vorläuferläsionen ist die Karenz entsprechender Noxen, in westlichen Industrienationen vor allem Tabak und Alkohol, die oft maßgeblich an der Entstehung der Vorläuferläsion beteiligt waren. Darüber hinaus werden neben der chirurgischen Entfernung der Schleimhautveränderungen immer wieder konservative Therapieansätze mehr oder weniger erfolgreich eingesetzt.54,63
Chemoprävention durch Vitamine
Ein zentrale Rolle spielt hierbei die lokale und systemische Applikation von Vitamin A.63,64 Dieser Therapieansatz basiert auf der Erkenntnis, dass bei Patienten mit niedrigem Serumretinolspiegel orale Plattenepithelkarzinome häufiger angetroffen werden.65 Ursächlich hierfür wird ein Mangel an antioxidativ wirksamen Vitaminen C, E, A und Beta-Karotin angesehen. Diese schützen die Zelle vor freien Radikalen, indem wichtige Zellbestandteile nicht geschädigt werden.66 Durch die systemische Gabe von Vita-min A und Beta-Karotin wird zwar eine Rückbildung der Leukoplakien positiv beeinflusst, jedoch ohne dass dies einen positiven Einfluss auf das Risiko einer malignen Transformation hat.67,68
Zwei bis drei Monate nach Therapieende zeigen sich häufig Rezidive.69 Ebenfalls untersucht wurde der Einsatz von a-Tocopherol (Vitamin E), was ebenfalls einen antioxidativen Effekt haben sollte. Eine positive Wirkung ließ sich kaum feststellen, jedoch ist erwähnenswert, dass antioxidativ wirkende Substanzen wie Vitamin E in hohen Dosen prooxidativ wirken. Diese können im kardiovaskulären System zu erheblichen Schäden führen.70 Vor diesem Hintergrund ist eine systemische Applikation mit den genannten Antioxidantien zur Behandlung von Leukoplakien nicht zu empfehlen. Diese sollte nur im Rahmen klinischer Kontrollstudien erfolgen. Nichtsdestotrotz ist eine ausgewogene, ballaststoffreiche Ernährung mit einem hohen Anteil an Vitaminen und Spurenelementen für Patienten mit Leukoplakien wichtig, da sie die Gesundheit positiv beeinflusst.71
Chemoprävention durch natürlich vorkommende Substanzen
In den letzten Jahren wurden einige natürlich vorkommende Substanzen zur Chemoprävention bei epithelialen Vorläuferläsionen untersucht, teilweise mit beeindruckendem Erfolg. Natürlich vorkommende Substanzen haben dabei verschiedene Vorteile: Größtenteils werden sie als wenig toxisch wahrgenommen, wobei dieser Eindruck bei genauerer Betrachtung manchmal täuscht.72 Nichtsdestotrotz werden sie aber unter anderem auch deshalb von den Patienten und der Allgemeinheit positiv aufgenommen, da Begriffe wie „natürlich“ und „biologisch“ allgemein als positiv besetzt gelten.73
Trotzdem gibt es bei der Herstellung von natürlichen, vor allem pflanzlichen Pharmaka einige Schwierigkeiten bei der Transformation der im Labor auf Zellkulturebene oft vielversprechenden Ergebnisse in die Realität der Therapie: Schwierigkeiten in der Herstellung bereiten oft die Sicherstellung standardisierter Herstellungsprozesse und der Lagerung, damit die Medikamente eine konstante Wirkstoffkonzentration enthalten. Eine weitere Schwierigkeit liegt in der variablen, oralen Bioverfügbarkeit der Substanzen, da die Metabolisierung, die durch verschiedene Gene und deren Genprodukte beeinflusst wird, oft nicht genau untersucht wurde. Das größte Problem ist jedoch, dass der molekulare Wirkmechanismus dieser Substanzen, der oft um Einiges komplizierter ist als der von herkömmlichen Medikamenten, nicht genau bekannt ist.73
Bowman-Birk-Inhibitor (BBI)
Ein vielversprechender, natürlicher Wirkstoff zur Chemoprävention bei epithelialen Vorläuferläsionen, der in den letzten Jahren ausführlich untersucht wurde, ist BBIC (Bowman-Birk Inhibitor Concentrate), welches in Sojabohnen vorkommt. Sojabohnen enthalten große Mengen an Protease-Inhibitoren, wobei BBI als die potenteste antikanzerogen wirkende Substanz in Sojabohnen gilt.74
Studien haben gezeigt, dass sich in der Mukosa von Rauchern eine stärkere Proteaseaktivität zeigt als bei Nichtrauchern.75 Im Tiermodell zeigte sich, dass Bowman-Birk Inhibitor sowohl die Proteaseaktivität und die Inzidenz von Mundhöhlenkarzinomen senken konnte.76 In einer Phase I-Studie an Patienten mit oralen Leukoplakien zeigte sich, dass eine einzelne Gabe von BBIC bis zu 800 Chymotrypsin Inhibitor Units (CIU) erzeugte, die schnell aufgenommen und ohne nennenswerte Toxizität metabolisiert wurden.77 Eine nachfolgende Phase II-Studie an 34 Patienten zeigte bei 10 Probanden ein klinisches Ansprechen, wobei das Ansprechen mit steigender Dosis besser wurde.78
Grüntee-Extrakt (Polyphenole)
Grüntee-Extrakt enthält große Mengen an Polyphenolen, die einen starken antioxidativen Effekt aufweisen und in der Lage sind, Zellen vor DNA-Schäden, die durch Sauerstoffradikale verursacht werden, zu schützen.79 Zusätzlich scheinen die Polyphenole in der Lage zu sein, die Zellproliferation zu hemmen und durch Beeinflussung der Expression von Genen, die für die Regulation des Zellzyklus verantwortlich sind, Apoptose zu induzieren.80,81 In einer randomisierten klinischen Studie zeigte sich zwar sowohl histologisch als auch klinisch ein Ansprechen bei einigen Patienten auf die Behandlung mit Grüntee-Extrakt, jedoch auf den wirklich relevanten Endpunkt, nämlich eine Reduktion der Rate an malignen Transformationen, hatte die Behandlung mit Grüntee-Extrakt keinen signifikant positiven Einfluss.82 Weitere in der Literatur untersuchte Substanzen sind a-Tocopherol und Bleomycin. Für keine der untersuchten Substanzen ließ sich jedoch ein therapeutischer Effekt in Bezug auf das Risiko einer malignen Transformation nachweisen.63 Aktuelle Empfehlungen zur Diagnostik und Therapie von oralen Vorläuferläsionen sind in der S2-Leitlinie der Deutschen Gesellschaft für Zahn-, Mund- und Kieferheilkunde zu finden.
Maligne Transformation oraler epithelialer Vorläuferläsionen
Die Häufigkeit der malignen Transformation von epithelialen Vorläuferläsionen zu Plattenepithelkarzinomen der Mundhöhle liegt je nach Studie zwischen 0,1 und 18 Prozent.7,12,25 Genauso wie für die Prävalenz von epithelialen Vorläuferläsionen finden sich bezüglich der Entartungsrate geografische Unterschiede, wobei die Transformationsrate in Entwicklungsländern höher ist. In westlichen Staaten liegt die Entartungsrate bei circa einem Prozent.50 Wie viele Karzinome tatsächlich aus oralen Vorläuferläsionen oder de novo aus der oralen Mukosa entstehen, ist unklar, die Angaben schwanken zwischen 16 und 62 Prozent.83,84
Aufgrund der schlechten Prognose von oralen Plattenepithelkarzinomen ist die Identifikation von zuverlässigen Markern und Indikatoren, die ein hohes Entartungsrisiko anzeigen, von besonderer Bedeutung.29,85 Bei der Beurteilung des Entartungsrisikos müssen jedoch drei Punkte berücksichtigt werden, welche die Rate an malignen Transformationen beeinflussen:9,86 die Beobachtungsdauer der entsprechenden Studie, die selektive Behandlung von Patienten in Abhängigkeit verschiedener klinischer Kriterien und die Studienart (klinikbasierte Studien versus Feldstudien, die die Gesamtbevölkerung einbeziehen). Die Tabelle 1 liefert eine Übersicht über Risikofaktoren der malignen Transformation.
Obwohl Tabakkonsum als der wichtigste Risikofaktor für die Entstehung von Leukoplakien, den häufigsten epithelialen Vorläuferläsionen gilt, ist der Einfluss auf die Entartung von Leukoplakien umstritten.6 Während eine prospektive Studie aus Taiwan einen Einfluss des Tabakkonsums auf die Entartung von Leukoplakien nachweisen konnte, wurde diese Assoziation nicht in allen Studien festgestellt.14,87 Das Geschlecht als Risikofaktor für eine maligne Transformation von oralen Vorläuferläsionen wird kontrovers diskutiert. Während in Indien Studien ein höheres Entartungsrisiko bei Männern identifizieren konnten, was hauptsächlich mit Tabakkonsum assoziiert war,9,86 konnten Studien aus Europa eine größere Rate von malignen Transformationen bei Frauen feststellen.7,14 Die höhere Entartungsrate wird auf die höhere Prävalenz von Dysplasien bei Frauen mit oralen Leukoplakien zurückgeführt.88
Die Lokalisation von oralen Leukoplakien hat einen wichtigen Einfluss auf die Entartungsgefahr.89 Während die Entartungsgefahr für Leukoplakien im Bereich der Wange nur 2,9 Prozent beträgt, wurden für Leukoplakien im Bereich der Zunge und des Mundbodens Entartungsraten von 27 beziehungsweise 13 Prozent beschrieben.90 Nachdem Pindborg 1963 erstmalig den Einfluss des klinischen Erscheinungsbildes auf die Entartungsgefahr oraler Leukoplakien beschrieb, wurde in vielen Studien eine höhere Entartungsgefahr für inhomogene Leukoplakien im Vergleich zu homogenen Leukoplakien festgestellt.17,46,50,91 Der Dysplasiegrad wird gemeinhin als wichtiger Risikofaktor für die maligne Transformation epithelialer Vorläuferläsionen angesehen, da er, wie oben beschrieben, als Grundlage für die Klassifikation von oralen Vorläuferläsionen fungiert.11,89,92 Der Dysplasiegrad gilt zwar als guter Anhaltspunkt für die Behandlung von oralen Vorläuferläsionen, dabei muss jedoch immer beachtet werden, dass sich auch aus Leukoplakien ohne dysplastische Veränderungen invasive Plattenepithelkarzinome entwickeln können.36,46
Klinische Parameter, die mit einem erhöhten Entartungsrisiko einhergehen, spielen eine wichtige Rolle, obwohl sie nur wenig spezifisch sind. Nur wenige Studien konnten effiziente Strategien zur Prävention einer malignen Transformation von epithelialen Vorläuferläsionen zeigen. Das liegt hauptsächlich daran, dass es schwierig ist, Patienten mit einem erhöhten Entartungsrisiko sicher zu identifizieren.93 Der Einfluss nichtchirurgischer Behandlungskonzepte auf die maligne Transformation in Leukoplakien gilt als gering. Für den Einsatz topischer Bleomycinapplikationen und die Gabe von Vitamin A konnte nur ein geringer therapeutischer Effekt nachgewiesen werden.54,94 Studien konnten zeigen, dass die vollständige Exzision der Leukoplakien mit einem adäquaten Sicherheitsabstand in Verbindung mit einer engmaschigen Nachsorge die maligne Transformationsrate signifikant reduziert.46,95
Einige Studien zeigen, dass molekulare Eigenschaften von oralen Leukoplakien entscheidend sind, um die Aggressivität von Vorläuferläsionen zu bestimmen, was im Folgenden an einigen ausgewählten Beispielen erörtert wird.89,95,96 Aktuelle Studien konnten prospektiv einen signifikanten Einfluss der Podoplanin-Expression auf die Entartungsgefahr von oralen Leukoplakien nachweisen (Abb. 9).37,97 Podoplanin ist ein Glykoprotein des Muzintyps, dass außer in lymphatischen Endothelzellen auch in oralen Plattenepithelkarzinomen und Leukoplakien exprimiert wird.98 Die biologische Funktion von Podoplanin scheint in der Erhöhung der Motilität von Zellen in Leukoplakien und Plattenepithelkarzinomen im Bereich der Invasionsfront zu liegen. Die Motilität und die Fähigkeit zum invasiven Wachstum dieser Zellen wird durch ein Re-Modelling des Aktinzyto-Skeletts vermittelt, welches von Podoplanin indirekt über eine Interaktion mit den ERM-Proteinen Ezrin, Moesin und Radixin gesteuert wird.99,100
Studien unserer Arbeitsgruppe konnten demonstrieren, dass eine hohe Expression von Podoplanin in oralen Plattenepithelkarzinomen mit einer erhöhten Rate an zervikalen Lymphknotenmetastasen, einem schlechten Ansprechen auf eine neoadjuvante Radiochemotherapie und einer schlechten Prognose assoziiert ist.101,102 In den letzten Jahren konnte durch den Nachweis der HPV-Subtypen 16, 18 und 31 in bis zu 50 Prozent der Plattenepithelkarzinome des oberen Aerodigestivtraktes und deren Vorläuferläsionen ein Einfluss von onkogenen Viren auf die orale Karzinogenese nachgewiesen werden,103,104 wobei das Protein p16ink4a die Cyclin-abhängigen Kinasen 4 und 6 hemmt.
Diese Kinasen führen ungehemmt zu einer Phosphorylierung des Retinoblastom-Proteins (pRb). Dieses Protein pRB bindet unter physiologischen Bedingungen den Transkripitionsfaktor E2F, woraus resultiert, dass die Gene, die die Progression des Zellzyklus bewirken, nicht mehr transkribiert werden. Der Zellzyklus beziehungsweise die Zellproliferation wird dadurch gebremst. Durch die Phosphorylierung von pRB bleibt die Bindung von E2F aus, was eine Progression des Zellzyklus von der G1- in die S-Phase bewirkt.105 Hierdurch kommt es folglich auch zu einer gesteigerten Bildung des Proteins p16INK4A, was wiederum dazu führt, dass pRB nicht mehr phosphoryliert wird und so E2F wieder binden kann. Über diesen Rückkopplungsmechanismus wird der Zellzyklus normalerweise reguliert.
Das Risiko einer malignen Transformation wird durch den Nachweis von HPV-DNA in oralen Vorläuferläsionen um das Drei- bis Fünffache erhöht.106 Inwieweit der Nachweis von HPV-Einfluss auf die Prognose von Mundhöhlenkarzinomen hat, wird derzeit noch untersucht. Bislang ergaben sich jedoch Hinweise auf ein verbessertes Ansprechen HPV-positiver Tumoren auf eine Radiochemotherapie.103
Co-Autorin: Dr. Dr. Andrea Grandoch1,2
1 Klinik und Poliklinik für Mund-, Kiefer- und Plastische Gesichtschirurgie
und interdisziplinäre Poliklinik für Orale Chirurgie und Implantologie der Universität Köln
2 Centrum für Integrierte Onkologie (CIO) Köln
Hier finden Sie eine vollständige Literaturliste.
Bilder/Grafiken/Tabellen © Autoren