Prophylaxe 28.02.2011
Der dentale Biofilm
share
Voraussetzung dentaler und parodontaler Erkrankung
Die dentale Plaque und der Biofilm als bedeutsame Organisationsstruktur stellen bis heute das zentrale Problem beim Management von dentalen und parodontalen Erkrankungen dar. Die Untersuchungen zu Biofilmen konnten bis heute vor allem Aufschlüsse über die Struktur und die darin lebenden Bakterien geben. Unklar bleibt, inwieweit das komplizierte Gefüge des Biofilms Einfluss auf die Therapiemöglichkeiten nehmen kann.
Was ist ein Biofilm?
Die parodontopathogenen Bakterien werden neben den genetischen Dispositionen als grundlegender Faktor für die Entstehung von Parodontitiden angesehen. Dabei scheint die Organisation der Bakterien in Biofilmen entscheidend für die hohe Resistenz gegen lokale Therapiemaßnahmen zu sein. Unter Biofilmen versteht man die Zusammensetzungen von Bakterien, die durch Co-Aggregationsmechanismen als sogenannte Bakterienfamilien agieren und sich gegenseitig langfristig stabilisieren (Simonsson 1989; Marsh und Bradshaw 1995; Ligtenberg et al. 2007). Biofilme spielen in unserem praktischen und alltäglichen Leben eine entscheidende Rolle und bilden ein ständiges Problem im täglichen Leben. Es ist bekannt, dass Biofilme eine Vielzahl von vor allem feuchten Oberflächen besiedeln (Passerini et al. 1992; Giaouris et al. 2005). Abwasserrohre, Sanitärbereiche oder auch Bereiche wie Schiffsrümpfe bilden optimale Flächen zur Besiedlung. Diese sind nur schlecht mit chemischen Mitteln zu entfernen und können vor allem in Krankenhäusern, beispielsweise auf medizinischen Geräten wie Kathetern, zu einem entscheidenden Problem werden (Passerini et al. 1992).
Die Bildung von gemeinsamen, schützenden Lebensräumen kann in der Natur vielfach beobachtet werden (Amann und Kuhl 1998; Kuramitsu 2001). Ähnlich wie in der Geschichte der Zivilisation, in der sich die Menschen zunehmend in Städten zusammengerottet haben, um gegen Unwetter oder Angreifer zu bestehen, bilden Mikroorganismen einen gemeinsamen Schutzwall gegen giftige Substanzen, die zu ihrem Untergang führen könnten. Diese Lebensgemeinschaften dienen dem Nährstoffaustausch und der Weitergabe von Genen; die spezifischen Eigenschaften der Bakterien werden auf diese Weise verbessert und gestärkt. Die Fähigkeit zur Regulierung des pH-Wertes und damit der Bildung einer eigenen Umwelt erhöht die Anpassungsfähigkeit an Veränderungen des umgebenden Milieus.
Die Entstehung des Biofilms
Die Pionierkeime, meist Actinomyceten, heften sich mithilfe von Pili und Fimbrien an der Oberfläche der Zähne an (Adhärenz). Das initiale Lateralwachstum wird nach Teilungs- und Reifevorgängen durch das Vertikalwachstum abgelöst und endet in der Bildung von Kolonien (Abb. 1). Zur Sicherstellung der Nährstoffzufuhr von außen werden spezielle Wasserkanäle gebildet, die gleichzeitig dazu dienen, von Bakterien sezernierte Giftstoffe abzutransportieren (Marsh und Bradshaw 1995). Ein zusätzlicher und entscheidender Faktor des stabilen Plaquewachstums ist die Bildung von mehreren Biofilmen, die unabhängig voneinander agieren können. Bei genauer Betrachtung wird deutlich, dass Biofilme kein ausschließliches Aggregat aus Bakterien darstellen. Die Biofilme bestehen im hohen Maße – durchschnittlich 90% des Trockengewichts – aus Extrazellulärsubstanz in Form von Exopolysacchariden. Die Bakterien sind in einem Netz eingemauert, in dem sich Mikrokolonien bilden, die teilweise einzelne Bakterienspezies beherbergen können. Die äußeren Formen der Kolonien sind abhängig von mechanischen Gegebenheiten wie dem Flüssigkeitsstrom und können zwischen geraden, haarartigen Formen und Pilzformen variieren.
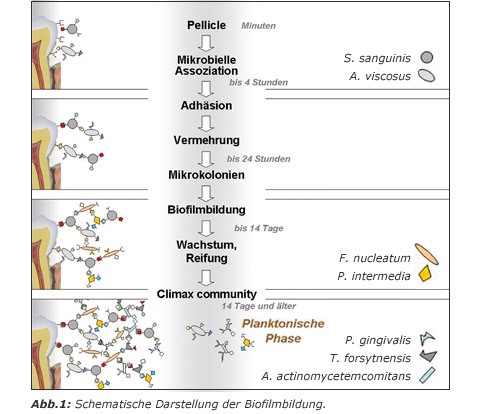
Die Matrix oder Interzellulärsubstanz bildet das Klebemittel der Bakterien. Sie besteht zum größten Teil aus Wasser, welches von Exopolysacchariden gebunden ist. Exopolysaccharide, die von den Bakterien sezerniert werden, besitzen eine Vielzahl von wichtigen Funktionen (Cescutti et al. 1999; Filloux und Vallet 2003). Neben der mechanischen Funktion können sie Kationen binden und so einen bestimmten pH-Wert in der Plaque sicherstellen. Eine weitere Aufgabe der Exopolysaccharide besteht im Binden und Speichern von Nährstoffen. Man geht davon aus, dass zur Kontrolle der einzelnen Abläufe innerhalb des Biofilms eine Kommunikation zwischen den Bakterien stattfindet, die als „quorum sensing“ bezeichnet wird (Suntharalingam und Cvitkovitch 2005). Die Weitergabe von Informationen funktioniert über traditionelle molekularmedizinische Wege wie der Konjugation, dem Austausch von Erbinformationen über Plasmidtransfer bzw. Transposonübertragung (Wang und Kuramitsu 2005). Die Kommunikation hängt im Wesentlichen von der Bakteriendichte ab, doch der genaue Mechanismus ist bisher unklar. Dabei handelt es sich um sezernierte Wachstumsfaktoren und Zellbestandteilen (Toxine, Enzyme, Surfactants), die im Sinne der Autoinduktion die Zellteilung und Aktivität der Bakterien regulieren sollen. Jedes Bakterium sezerniert eine Vielzahl von Faktoren, wodurch beispielsweise Antibiotikaresistenzgene an andere Bakterien weitergegeben werden können und sich so die Virulenz erhöht.
Antibiotikaresistenzgene
Die Bedeutung des Biofilms wird vor allem beim Einsatz von lokalen Antibiotika deutlich (Norrington et al. 2008; Persson und Imfeld 2008). Die Biofilmstrukturen zeigen eine um den Faktor 1.000–1.500-fach höhere Resistenz gegenüber Antibiotika. Die Gründe für diesen deutlichen Unterschied konnten bis heute nicht zweifelsfrei geklärt werden. Eines der Denkmodelle basiert auf der Theorie, dass es den Bakterien in der Biofilmstruktur – beachtet man die ideale Temperatur, den pH-Wert und die Nährstoffzufuhr – so gut geht, dass die Wachstumsraten innerhalb des ausgebildeten Biofilms sehr gering sind. Antibiotika können ihre volle Wirksamkeit nur bei schnell wachsenden Zellen entfalten und müssen zum anderen den mechanischen Schutz durch die Exopolysaccharide überwinden. Ein weiteres Problem für die Entfaltung der vollen Schlagkraft bereitet der chemische Gradient, der die positiv oder negativ geladenen Antibiotika vor dem Eindringen in den Biofilm schützt.
Neben den chemischen Ursachen sind Bakterien in der Lage, Resistenzgene gegen Antibiotika zu bilden (Hogan und Kolter 2002). Die Resistenzgene, die innerhalb des Biofilms gebildet werden und dort ihre Schutzwirkung entfalten, können auf einzelne Bakterien vererbt werden und so einen Schutz auch außerhalb des Biofilms ermöglichen. Dieses Phänomen macht es zusätzlich schwierig, die nach der Zerstörung des Biofilms freigesetzten Bakterienspezies zu eliminieren. Keime wie beispielsweise Pseudomonas aerogenosa zeigen als Teil des Biofilmes eine hohe Resistenz gegen Antibiotika, sind aber auch außerhalb des Biofilms im planktonischen Zustand in der Lage, die Wirkung von Antibiotika durch vererbte Resistenzgene entscheidend zu beeinflussen (Mispagel und Gray 2005). Die Bakterien scheinen viele Informationen über direkten Gentransfer übertragen zu können und sich auf wechselnde äußere Bedingungen anzupassen.
Zusammensetzung der oralen Plaque
Die supragingivale Plaque unterscheidet sch deutlich von der subgingivalen Plaque. Der supragingivale Biofilm hat eine typische flache oder säulenförmige Form, in der die Bakterien organisiert leben und die den Biofilm in die Mundhöhle verlassen können. Diese Form der Biofilmstruktur haftet der Zahnoberfläche direkt an und verliert durch prophylaktische Mundhygienemaßnahmen ihre Wirksamkeit. Die Kariesaktivität steigt vor allem bei Besiedlung mit grampositiven fakultativ anaeroben Streptokokken der Viridans-Gruppe (S. mutans, S. sangius und S. mitis) (Kielbassa 2006). In enger Korrelation zur Aufnahme von niedermolekularen Kohlenhydraten steht zudem die Zahl der Actinomyceten, von denen vor allem der A. viscosus und der A. naeslundii für die für Läsionen im Wurzelbereich verantwortlich gemacht werden (Shu 1998). Der subgingivale Biofilm kann hingegen nicht durch einfache Mundhygiene unschädlich gemacht werden und kennzeichnet sich durch zwei verschiedene Formen des Biofilms aus. Der adhärente Teil ähnelt in der Initialphase in Zusammensetzung und Pathogenität der supragingivalen Plaque, wohingegen die schwimmende Plaque deutliche Resistenzen auf therapeutische Maßnahmen aufweist. Tiefe parodontale Taschen ermöglichen es vor allem hochpathogenen gramnegativen anaeroben Keimen, in strukturierten Biofilmen ihre gesamte Zerstörungskraft der Hart- und Weichgewebe zu entfalten. Nach der Konsensuskonferenz von 1996 geht die höchste Pathogenität vor allem von Aggregatibacter actinomycetemcomitans (A.a.c), Porphyromonas gingivalis (P.g). und Bacteroides forsythus (B.f.) aus, wobei der A.a.c. als gramnegatives Stäbchen der derzeit am besten untersuchte Keim ist, der in der Regel in Form von sternförmigen Kolonien zu finden ist.
Das Problem Mundhöhle
Die Bildung von Biofilmen ist ein besonderes Problem im Bereich der Mundhöhle (Wood et al. 2000). Biofilme treten zwar am gesamten menschlichen Körper auf, werden jedoch durch die Integrität der Bindegewebsstrukturen im Regelfall nicht zu einem pathologischen Problem. Die Ursache für die hohe Problematik im Bereich der oralen Weichgewebe ist in den Zähnen zu suchen, die in diesem Zusammenhang gewissermaßen als anatomischer Fehler gesehen werden können. Sie sind der einzige Bereich des Körpers, in dem ein fester Bestandteil durch die Integrität der Oberfläche durchdringt und indirekt Knochen und Bindegewebe mit der äußeren Umwelt verbindet. Zudem zeigen Zähne keinerlei Abschilferung, der jedoch im epithelialen Bereich zum Schutz vor einer pathologischen Keimbesiedelung unabdingbar ist. Die Abschilferungen der epithelialen Bereiche kann demnach als ein selbstreinigender Effekt gesehen werden. Die Form der Regeneration ist im Bereich der Mundhöhle und der Zähne nicht zu finden. Die Mundhöhle besteht aus über 500 Bakterienarten, die sich dauerhaft an Hart- und Weichgewebsstrukturen anheften können.
Nach der unspezifischen Plaquehypothese ging man lange Zeit davon aus, dass allein die Menge der Bakterien und der Plaque für die Kariesaktivität und Parodontitis entscheidend zu sein scheint (Loesche 1973). Diese Hypothese trifft jedoch auf die Entwicklung von parodontalen Erkrankungen nicht ohne Weiteres zu. Löe konnte zeigen, dass Teearbeiter auf Sri Lanka, die keinen Zugang zur Mundhygiene oder zahnärztlichen Maßnahmen hatten, trotz massiver Plaqueanlagerung weder Gingivitis oder Parodontitis noch eine Progredienz von Parodontitis zeigten (Loe et al. 1986). Es müssen wohl spezielle parodontopathogene Bakterien für die Entstehung von Parodontitiden, die parodontopathogene Keime genannt werden, als Ursache für das Voranschreiten subgingivaler Entzündungen gesehen werden. Slots konnte 1979 zeigen, dass es bei prädisponierten Patienten zu einer Bakterienshift von gesund nach krank kommen muss und sich dadurch die Anzahl der gramnegativen anaeroben Bakterien deutlich erhöht (Slots 1979). Bei dieser als spezifische Plaquehypothese bezeichneten Theorie wird insbesondere dem A.a.c. eine hohe Pathogenität als Leitkeim der lokalisierten juvenilen Parodontitis zugeschrieben (Slots und Listgarten 1988). Die Problematik der spezifischen Plaquehypothese bestand jedoch darin, dass Patienten beobachtet wurden, bei denen relevante pathogene Keime diagnostiziert werden konnten und die dennoch nicht erkrankten (Slots, Emrich et al. 1985). Heute wissen wir, dass parodontopathogene Keime per se nicht ausreichen, um eine Parodontitis auszulösen. Es müssen noch zusätzliche lokale und genetische Faktoren in Erwägung gezogen werden, sodass die Parodontitis nach aktuellem Wissensstand als opportunistische Infektion gesehen wird (opportunistische Plaquehypothese).
Wo stehen wir heute?
Die Untersuchungen zu Biofilmen konnten bis heute vor allem Aufschlüsse über die Struktur und die darin lebenden Bakterienfamilien geben. Unklar bleibt, inwiefern diese organisierten Familienstrukturen miteinander in Verbindung treten und wie stark sie sich durch Bildung von Resistenzgenen gegen Veränderungen des äußeren Milieus behaupten können. Die spezifische Anordnung der Bakterien in bestimmten Komplexen ist ein Indiz für die hohe Organisationsfähigkeit der Mikroorganismen. Socransky konnte 1998 in einer Analyse von über 13.000 Plaquesamples als Erster zeigen, dass pathogene Komplexe existieren, in denen Bakterien mit anderen Spezies bevorzugt Biofilme bilden und so ihre Partner selektiv auswählen (Socransky et al. 1998). Diese Partnerschaften sind erst durch die Selektivität in der Lage, hochgradig pathogene Biofilme auszubilden.
Die heutige Reduktion der Biofilme erfolgt vor allem mechanisch und die Elimination des gesamten aktiven Biofilms, vor allem in tiefen subgingivalen Taschen, scheint nicht möglich zu sein. Die Aussicht der Insertion von hochspezifischen Bakteriophagen würde zweifelsfrei zu einem Paradigmenwechsel in der Therapie von Parodontitiden führen. Bis dahin bleibt der Biofilm ein zentrales Problem in der adäquaten Behandlung von dentalen und parodontalen Erkrankungen. Auf den folgenden Seiten finden Sie eine Marktübersicht zu Kariesrisiko- und Parodontitistests, die unter anderem eine Bestimmung der relevanten Keime zulassen. Bei richtiger Anwendung und Interpretation lassen diese Tests eine Aussage zum aktuellen Erkrankungsrisiko des Patienten zu und stellen damit eine wertvolle Ergänzung bei der Therapie dar.
Die vollständige Literaturliste finden Sie hier.











