Implantologie 02.08.2017
Update: Allogene Knochenersatzmaterialien
share
Update zum wissenschaftlichen Stand.
Autologe Knochentransplantate gelten als Goldstandard zum Zweck der Knochengeweberegeneration aufgrund ihrer osteogenen, osteoinduktiven und osteokonduktiven Potenz.1,2 Die Gewinnung von Eigenknochen ist jedoch mit Schwierigkeiten verbunden, da häufig ein weiterer operativer Eingriff an einer anderen Lokalisation als dem späteren Implantationsort nötig ist.3 Die Entnahme ist daher oftmals mit Nebenwirkungen und möglichen Infektionen verbunden.3,4 Zudem ist die Menge an zu gewinnendem autologen Knochengewebe vielmals zu gering, um die Defekt- bzw. Implantationsstelle füllen zu können. Als Alternative zum Eigenknochentransplantat oder auch zur Volumenerhöhung stehen dem Kliniker mittlerweile diverse Knochenersatzmaterialien zur Verfügung, welche auf allogenem oder xenogenem Gewebe basieren oder synthetischen Ursprungs sind.1,5
Zwar unterstützen alle Materialklassen die Knochengewebeheilung bzw. den Knochengewebeaufbau vornehmlich über den Prozess der Osteokonduktion, aber insbesondere allogenen Materialien wird die höchste regenerative Kapazität zugeschrieben. Dies liegt daran, dass humanes Spendergewebe als Basis zu deren Herstellung dient, und dieses die höchste Ähnlichkeit mit dem Zielgewebe des Empfängerorganismus aufweist.2,6
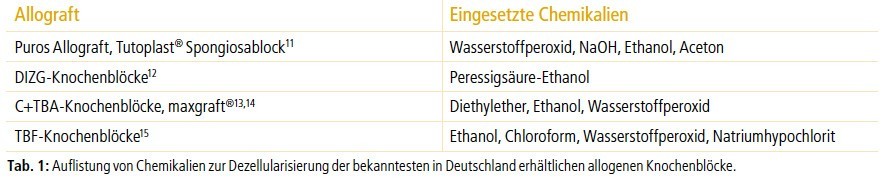
Um die Eigenschaften und die damit verbundene Sicherheit dieser Materialien richtig zu bewerten, ist es essenziell allogene Knochenersatzmaterialien nach deren Prozessierung zu beurteilen. So können Allografts grob in physisch und physikochemisch prozessierte Materialien unterteilt werden.7 Zu den physisch prozessierten Allografts gehören global weit verbreitete Materialien wie der fresh-frozen bone und cryopreserved bone, bei denen die zelluläre Substanz vollständig enthalten bleibt.8,9 Die entnommenen Transplantate werden hier lediglich tiefgefroren (circa –20 °C) und evtl. bestrahlt (fresh frozen) bzw. mit Kryoprotektiva wie etwa DMSO oder Glycerol versetzt und bei circa –196 °C gelagert (cryopreserved). Bei beiden Verfahren konnten lebensfähige Zellen nachgewiesen werden, was im Falle des Kryokonservierungsverfahrens sogar ausdrückliches Ziel ist.8,10 In Deutschland hingegen durchlaufen alle zugelassenen Alloimplantate eine chemische Dezellularisierung, wobei verschiedene Prozesse bzw. Chemikalien eingesetzt werden (Tab. 1).
Die Trocknung, welche eine stabile Lagerung des Gewebes bei Raumtemperatur ermöglicht, erfolgt dabei entweder mittels Evaporation von Aceton (Puros Allograft, Tutoplast® Spongiosa Block), vergleichbar in der Literatur mit solvent-dehydrated bone allografts (SDBA), oder durch Gefriertrocknung (alle anderen Anbieter), häufig bezeichnet als freeze-dried bone allografts (FDBA).16,17 Als Sammelbegriff wird zumeist mineralized bone allograft (MBA) verwendet.18
Schlussendlich ist es das Ziel dieser Aufreinigungsprozesse, ein Knochenersatzmaterial zu generieren, welches vor allem als osteokonduktiv wirkende Gerüststruktur und mit optimalen physikochemischen Eigenschaften eine optimale Knochengewebeheilung ermöglicht, ohne immunogen wirksame Bestandteile zu enthalten.
Sicherheitsaspekte von allogenen KEM
In der Vergangenheit sorgten Berichte von Infektionsübertragungen und immunologischen Reaktionen als Folge der Applikation von Knochentransplantaten für Aufsehen und stellten damit deren Sicherheit infrage.19 Während diese Bedenken für unprozessierte oder lediglich physisch behandelte Knochenmaterialien ihre Berechtigung finden, kann bei den physikochemisch prozessierten Allografts nach aktuellen Erkenntnissen lediglich ein hypothetisches Restrisiko bestehen.20,21 So wurde die Übertragung von Infektionskrankheiten bisher nur bei der Verwendung von Allografts aufgezeigt, welche nicht oder nicht korrekt physikochemisch behandelt wurden.22,23 Jedoch wurde seit der Einführung des sogenannten Nucleic Acid Tests (NAT), einem höchst sensitiven und spezifischen Test zum Nachweis selbst kleinster Mengen an Erbinformationen von Pathogenen, im Jahre 2004 von keiner Infektionsübertragung durch die Transplantation von humanem Knochen berichtet.20
Vereinzelte Fallberichte, in welchen eine Allosensibilisierung von Empfängern humaner Knochentransplantate publiziert wurde, beziehen sich praktisch ausschließlich auf Eingriffe, welche mit frischem oder frischem, gefrorenem Knochen durchgeführt wurden.24–26 Einzig und allein Friedlaender und Kollegen haben eine Allosensibilisierung durch die Transplantation von gefriergetrockneten muskuloskelettalen Allografts in der orthopädischen Anwendung gezeigt, welche jedoch keine klinischen Auswirkungen zur Folge hatte.27 Hierbei sollte außerdem berücksichtigt werden, dass der Aufbereitungsprozess sowie die Qualitätsstandards des in dieser Studie einbezogenen Materials nicht den Prozessen anderer Allografts entsprachen. Zudem wurden in dem berichteten Fall erheblich größere Gewebevolumina im Vergleich zu Knochenblöcken zum Zwecke der dentalen Applikation verwendet. Es ist ferner ersichtlich, dass kleinere Knochenfragmente deutlich besser von den in der Aufbereitung verwendeten Lösungen durchdrungen werden können und somit eine größere Effizienz der Dezellularisierungsprozesse gewährleistet ist, sodass das Risiko einer immunologischen Reaktion nahezu ausgeschlossen werden kann.28,29 Insgesamt konnten damit im Rahmen der dentalen Anwendung von prozessierten allogenen Knochenblöcken nach bisherigen Erkenntnissen keine spenderspezifischen Antikörper in Empfängern nachgewiesen werden. Zusätzlich wurde gezeigt, dass selbst ein sogenanntes HLA-Mismatch keinen Einfluss auf die Einheilung von Knochentransplantaten hat.29,30
Aufbereitung von Knochenblöcken
Die Prozesskette von der Gewinnung des Ursprungsgewebes bis hin zur Aufbereitung soll im Folgenden am Beispiel eines Allografts (maxgraft®, botiss biomaterials GmbH, Straumann GmbH), welches durch den Allotec®- Prozess behandelt wird unter besonderer Berücksichtigung der Sicherheitsaspekte verdeutlicht werden. Vor der nasschemischen Behandlung findet bereits ein mehrstufiger Selektionsprozess statt, welcher ideale Materialqualität und höchste Sicherheitsstandards gewährleistet. Dieser Prozess beginnt mit der Bewertung der Femurköpfe durch den behandelnden orthopädischen Chirurgen, welcher mithilfe von CT-Aufnahmen noch vor der Extraktion eine erste klinische Bewertung vornimmt. Dabei wird die Knochenqualität beurteilt, um eventuelle kompromittierende Eigenschaften wie Knochenläsionen zu erkennen und somit frühzeitig eine Knochenspende auszuschließen.31 Gleichermaßen wird vor der Entnahme mithilfe einer minutiösen Anamnese sowie serologischen Testungen des Spenderblutes, welche dem Ausschluss bestehender HIV 1/2-, HBV-, HCV- und Syphilisinfektionen dient, das Risiko für die Übertragung von Infektionen deutlich gesenkt.20 Nur bei Erfüllung all dieser Sicherheitsparameter wird das Gewebe für die Entnahme und folgende Prozessierung freigegeben.
In den GMP-konformen Reinräumen der C+TBA werden die Femurköpfe anschließend physikochemisch prozessiert, um das sterile Endprodukt, humanes mineralisiertes Kollagen, zu erhalten. Hierfür werden zunächst Geweberückstände manuell entfernt und das Knochengewebe in Partikel, Blöcke und Ringe aufgeteilt. Danach wird das Knochenmaterial zur Entfernung von Gewebe- bzw. Zellkomponenten mittels eines Ultraschallbads behandelt, um das Spendergewebe besser auf die im Anschluss folgende Anwendung der zur weiteren Dezellularisierung dienenden Chemikalien (Tab. 1) vorzubereiten. Zu diesem Prozessschritt gehören alternierende Spülvorgänge mit Ethanol und Diethylether sowie die oxidative Behandlung mit Wasserstoffperoxid. Während Ethanol und Diethylether die Denaturierung von nicht kollagenen Proteinen sowie die Eliminierung von verbleibenden Bakterien und eine Virusinaktivierung bewirken, werden durch die Anwendung von Wasserstoffperoxid zusätzlich verbleibende DNS-Fragmente zerstört.32–34 Insgesamt wird auf diesem Wege nicht nur das Risiko einer Infektionsübertragung, sondern auch einer immunologischen Reaktion vollständig eliminiert. Um schließlich die durch den Aufreinigungsprozess entstandenen Flüssigkeitsreste aus dem behandelten Knochengewebe zu entfernen, unterläuft dieses im Folgenden einer Gefriertrocknung. Die Gefriertrocknung ist ein besonders schonendes Verfahren, durch welches die native Struktur des Knochenblocks erhalten wird (Abb. 1–3). Zuletzt erfolgt die Endsterilisation des Knochenmaterials mittels niedrig dosierter Gammabestrahlung, um eine eventuelle Kontamination durch Mikroorganismen ausschließen zu können.31,35
Zusammenfassend kann auf Grundlage dieser Prozessierung geschlussfolgert werden, dass gleichermaßen die Wahrscheinlichkeit einer Infektionsübertragung wie die einer Allosensibilisierung durch diese chemisch prozessierten und gefriergetrockneten Allografts nicht gegeben sein kann. Obwohl vereinzelt Zellbestandteile innerhalb der Knochenmatrix nachgewiesen werden konnten, gibt es keinerlei Hinweise auf klinische Auswirkungen dieser Ergebnisse.20,29,36,37 So wurde in den letzten zwanzig Jahren bei millionenfacher Anwendung dieses Knochenersatzmaterials weder die Übertragung einer einzigen Infektion noch ein einziger Fall publiziert, der eine Problematik bei der Spende oder dem Empfangen weiterer Organe und Gewebe eines Empfängers von dezellularisierten Allografts dokumentiert.
Knochengeweberegeneration mithilfe von allogenen KEM
Allogene Knochenersatzmaterialien eignen sich insbesondere auf Grundlage der physikochemischen Ähnlichkeit der Knochenmatrix zu dem zu ersetzenden Knochengewebe für den Einsatz im Rahmen der Knochengeweberegeneration. So haben In-vitro-Versuche die hervorragende Eignung der Knochenblöcke als Substrat für das osteoblastäre Wachstum nachgewiesen (Abb. 4 und 5). Dadurch konnten die optimalen osteokonduktiven Eigenschaften des hier beschriebenen Allografts im Zellversuch nachgewiesen werden.
Auch durch klinische Studien inklusive histologischer Nachuntersuchungen konnte das problemlose und optimale Einheilverhalten dieser Knochenblöcke nachgewiesen werden (Abb. 6–8). So konnte gezeigt werden, dass sich das allogene Knochenersatzmaterial ohne inflammatorische Auffälligkeiten innerhalb der Implantationsareale detektieren ließ, wobei das Material neu eingewachsenem Knochengewebe auch innerhalb des Organismus als hervorragende Wachstumsgrundlage dient (Abb. 6 und 7). Des Weiteren konnte der Remodelling-Prozess und der Materialabbau ohne inflammatorische Auffälligkeiten nachgewiesen werden (Abb. 8).
Weitere Autoren: Phil Donkiewicz M.Sc., Dr. Dr. Oliver Blume, Dr. Ronald E. Unger, Prof. Dr. Sabine Wenisch, Prof. Dr. Dr. Reinhard Schnettler
Die vollständige Literaturliste gibt es hier.
Der Fachbeitrag ist erstmalig im Implantologie Journal 7+8/2017 erschienen.