Implantologie 24.08.2020
Zirkonoxidimplantate im klinischen Einsatz
share
Ergebnisse komparativer Studien
Die Zahl inserierter Zirkonoxidimplantate nimmt seit der Markteinführung Ende der 1990er-Jahre beständig zu, erreicht heute aber erst einen geschätzten Anteil von circa drei bis fünf Prozent an der Gesamtzahl aller inserierten Implantate weltweit. Marktanalysen prognostizieren einen deutlichen Anstieg in den nächsten Jahren (Dental Implants Market Research Report 2017). Diese Tendenz ist dem zunehmenden Vertrauen in den Werkstoff, der Weiterentwicklung von Einteiligkeit zur Zweiteiligkeit der Implantatsysteme und der optimierten Verbindung der Aufbaustrukturen auf den keramischen Implantaten geschuldet.
Einteilige Zirkonoxidimplantate zeigen in klinischen Untersuchungsreihen hinsichtlich ihrer Osseointegrationsfähigkeit im Vergleich zu Titanimplantaten ebenso gute Erfolge und haben diesen gegenüber offensichtlich Vorteile in Bezug auf die Weichgewebeakzeptanz. Titan und Zirkon gehören im Periodensystem der Elemente beide der Gruppe der Übergangsmetalle an, allerdings unterscheiden sich die physikochemischen Eigenschaften sowohl der Metalle als auch die ihrer Oxide wesentlich. Während Titan im biologischen System der Tribocorrosion unterliegt und in der Folge immunologische Reaktionen auslöst, zeichnet sich das vollkommen oxidierte und gesinterte Implantatmaterial Zirkondioxid durch hervorragende Korrossionsresistenz aus und besitzt aufgrund dessen eine hohe biologische Verträglichkeit.11,19 Die in einer Metaanalyse gewichteten Mittelwerte betragen für die periimplantäre Mukositis 43 Prozent und für die Periimplantitis 22 Prozent für Titanimplantate.9 Es besteht eine Korrelation von Periimplantitisprävalenz und verkürzter Implantatfunktionszeit. Die Erfolgsrate für die Zirkonoxidimplantate der jüngeren Generation ist vergleichbar mit der bei Titanimplantaten.2,15,24,26 Für einteilige ATZ-Implantate liegt die Drei-Jahres-Erfolgsrate bei 98,5 Prozent und für fünf Jahre bei 94,3 Prozent.
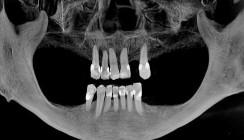
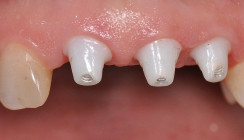
Die Sieben-Jahres-Erfolgsrate für einteilige Y-TZP-Implantate beläuft sich auf 88,6 Prozent. Ein Bruchereignis ist im Allgemeinen selten, wird aber bei dem letztgenannten Material bei Implantaten der ersten Generation aufgrund von Verwendung durchmesserreduzierter Implantate, aggressiver Oberflächenbehandlung (Alu-Pulverstrahlen) in der Herstellung, Fehlbelastung bei ungünstiger Implantat-Kronen-Achse, bei okklusaler Überbelastung und bei Bruxismus beobachtet.29 Die Verfügbarkeit zweiteiliger Implantate aus der stabileren ATZ-Keramik seit nunmehr zehn Jahren erweitert den Indikationsbereich und erleichtert die Anwendung. Diese Faktoren tragen wesentlich zur weiteren Verbreitung von Keramikimplantaten bei und lassen eine zukünftige stärkere Verwendung erwarten. In der Literatur werden neben den Vorteilen vor allem in der ästhetischen Zone aufgrund der weißen Farbe die geringere Biofilmadhäsion in In-vitro- und In-vivo-Studien und die höhere Korrosionsfestigkeit gegenüber dem Implantatwerkstoff Titan hervorgehoben.1,5,25,26,19 Augenscheinlich sind die ästhetischen Vorteile des Zirkonoxidimplantatwerkstoffs im Vergleich zum Titan insbesondere in der anterioren ästhetischen Zone bei Patienten mit dünner Gingiva unter 2 mm (Abb. 1 und 2).32
Mögliche Auswirkungen von Titanimplantaten
Komparative Studien, die neben immunologisch-entzündlichen Parametern die toxikologischen Auswirkungen von Nano-/Mikropartikellast im Gewebe untersuchen, finden verstärkte Bildung von freien Radikalen (ROS) bei Titanpartikeln im Vergleich zu Zirkonoxidpartikeln.19 Lipopolysaccharide (LPS) in Bakterienmembranen der parodontopathogenen Keime und Titanpartikel stimulieren Inflammasome in den Makrophagen, sodass eine Ausschüttung des proinflammatorischen Zytokins Interleukin-1 resultiert. Der Effekt der Stimulation durch Titanpartikel war bei LPS-exponierten (Aa, Pg, E. coli) Makrophagen verstärkt. Titanionen allein führen nicht zur Transkription der Inflammasome. Die in periimplantären Geweben gefundenen Ti-Mengen waren ausreichend, um die IL-1b-Ausschüttung in vitro zu stimulieren.22,23
Die mikrobielle Belastung im Mundraum fördert die Korrosionstendenz an der Titanimplantatoberfläche zusätzlich. Dieser milieuverändernde mikrobielle Einfluss durch parodontale Frühkolonisierer zeigt sich in einer Entwicklung zur Mukositis und Periimplantitis und hat zudem zur Folge, dass die Oberflächenkorrosion am Titanimplantat getriggert wird und vermehrt Metallabsiedlungen entstehen (Abb. 3).30
Es resultiert eine Verschiebung des Mikrobioms von der „gesunden“ diversifizierten zur pathologischen weniger diversifizierten Keimbeladung. Eine Korrelation der Menge an Titankorrosionsprodukten im periimplantären Gewebe und dem Vorliegen einer Periimplantitis konnte nachgewiesen werden. Im entzündeten periimplantären Gewebe wurden achtfach höhere Partikelmengen gefunden als um „gesunde“ Implantate, die keine oder eine geringe Partikellast aufwiesen. Die Autoren schlussfolgern, dass diese Befunde eine Assoziation von Korrosionsprodukten und Periimplantitis bestätigen und die Rolle von Korrosionsprodukten auf die Modifizierung der periimplantären Mikrobiomstruktur und -diversifität bekräftigen.7,28 Eine Evaluation von diversen Inflammationsmarkern im Gewebe um Implantateinheilkappen aus Titan im Vergleich zu Zirkonoxid ergaben einen signifikant höheren Nachweis von Entzündungsparametern bei Verwendung von Titan in Bezug auf alle untersuchten Marker.8 Deutlich erhöhte systemische Marker für Silent-Inflammation-Prozesse fanden sich auch bei Patienten mit Titanimplantaten Grad 5 (Titanlegierung TiAl6V4), die mehr als zehn Jahre in situ waren in Kombination mit Amalgamfüllungen im Vergleich zur Kontrollgruppe ohne Implantat und Füllungen und auch zur Patientengruppe mit Amalgamfüllungen, aber ohne Implantate.18
Histopathologische Untersuchungen an mit Titanimplantaten assoziierten seltenen oralen Weich- und Hartgewebeveränderungen zeigen eine erhöhte Partikelbeladung.21 In den unterschiedlichen extra- und intraossären Gewebeveränderungen – mit Ausnahme der traumatischen Knochenzyste und der intraossären Metastase eines Nierenkarzinoms – fand sich in 52,9 Prozent der 68 Fälle eine mit Entzündungsprozessen einhergehende erhöhte Titanpartikelbelastung. Es stellt sich die Frage, ob diese Titanpartikel als fördernder äthiologischer Faktor an der Entwicklung dieser Läsionen beteiligt sein könnten.
Klinisch stabile periimplantäre Gewebeverhältnisse um Zirkonoxid
Präklinische und klinische Untersuchungen zu parodontologischen Parametern um „gesunde“ Titan- und Zirkonimplantate zeigen in Bezug auf die Sulkustiefen statistisch signifikante Unterschiede.16 Die Werte erweisen sich sowohl im Tiermodell als auch beim Patienten höher bei den Titanimplantaten im Vergleich zu den Zirkonoxidimplantaten. Erfahrungsgemäß ist eine Sulkussondierung am Zirkonimplantat aufgrund der dichten fibrösen Gewebestruktur erschwert (Abb. 4).
Die über zehnjährige klinische Erfahrung bestätigt die stabilen periimplantären Weichgewebeverhältnisse und die geringere Inzidenz einer Periimplantitis, die sich bei Verbleib von Kleberresten nach Einbringen von Abutment und Krone oder auch bei der zurückgebliebenen Titanpartikelbelastung im Gewebe nach Verlust eines Titanimplantats und Reimplantation eines Zirkonoxidimplantats an gleicher Stelle oder in unmittelbarer Umgebung entwickeln kann (Abb. 5–7).
Komparative Analysen zur Struktur und Reinheit von Keramikimplantatoberflächen wurden an verschiedenen Y-TZP- bzw. ATZ-Implantaten durchgeführt. Alle Systeme unterschieden sich in der Oberflächenmorphologie und wiesen keinerlei Verunreinigungen auf, welche Anlass zu unerwünschten immunologischen Reaktionen geben könnten.4 In dynamischen Belastungsversuchen und Tests zur hydrothermalen Alterung von ATZ-Implantaten konnte eine hohe Frakturresistenz (> 1.100 N), eine geringe Ausdehnung der monoclinen Phaseschicht an der Oberfläche und keinerlei Veränderung der Oberflächenrauigkeit festgestellt werden.31
Histologische und fotometrische Gewebeanalysen
In einer Pilotstudie an zunächst 43 Gewebeproben um zweiteilige ATZ-Zirkonoxidimplantate wurden Analysen im Hinblick auf Partikelbeladung des Gewebes und auf inflammatorische Reaktionen durchgeführt. Die Schleimhautproben wurden bei der Freilegung zweiteiliger ZrO2-Implantate (Zeramex® T Implantate, Dentalpoint; Alumina-toughened Zirconia = ZrO2 76 Prozent, Al2O3 20 Prozent, Y2O3 vier Prozent) drei bis vier Monate post implantationem gewonnen. Inzwischen konnten in einer weiteren Studie über 200 Proben histologisch und fotometrisch untersucht werden (Abb. 8).14 Die Biopsien wurden in 20-prozentiger Formalinlösung fixiert und in Paraffin eingebettet. Die Auswertung der histologischen Präparate wurde in der Abteilung für Oralpathologie der Universität Buenos Aires (Prof. Daniel Gustavo Olmedo) durchgeführt.
Alle Proben wiesen ein feinpartikuläres Material auf, zeigten eine epitheliale Hyperplasie und dichte Zellinfiltrate ohne Nachweis von Fremdkörperriesen-zellen (Abb. 9). Die histologischen Befunde unterscheiden sich von denen um Titanimplantate, die eine lockere Gewebestruktur, fokale Anhäufungen von Titanpartikeln unterschiedlicher Form und Größe mit Makrophagen- und Lymphozyteninfiltrationen als auch eine höhere Anzahl an Blutgefäßen aufweisen (Abb. 10). Neben diversen in der EDS-Analyse nachgewiesenen Metallen fällt die Häufung von Aluminium auf, welches neben einer ubiquitären Verbreitung in unserer Umwelt auch bis zu 20 Prozent in der ATZ-Zirkonoxidkeramik vorhanden ist. Aluminium konnte allerdings in geringer Menge durch Multielementanalyse auch im Gewebe gesunder Probanden ohne ATZ-Implantate nachgewiesen werden (Tab. 1). Die übrigen nachgewiesenen Metalle sind zum großen Teil nicht auf die Verwendung des Implantatmaterials Zirkonoxid zurückzuführen, sondern sind Relikte aus früheren dentalen Restaurationen (Abb. 11). Dies konnte stellvertretend an einzelnen Patientenfällen demonstriert werden.
Untersuchungen zur Korrosionsstabilität von Zirkonoxid
Zur Analyse der Korrosionsstabilität bzw. möglichen Gewebebelastung durch Freisetzung von Partikeln von der Zirkonoxidimplantatoberfläche wurden zehn ATZ-Testkörper in Versuchstiere implantiert und die periimplantären Gewebe als auch Kontrollgewebeproben nach einer Liegezeit von sechs Monaten untersucht. Die Testkörper wurden durch Schnitt aus dem originalen ATZ-Implantatkörper gewonnen und plasmagereinigt. Die gewonnenen Gewebeproben wurden geteilt und einerseits einer histologischen Untersuchung und der Evaluation von Partikeln (EDS) und andererseits der Multielementanalyse (ICP-MS) zur Darstellung von Aluminium- und Zirkoniumkonzentrationen unterzogen. Neben dem Nachweis von Aluminium- und Zirkoniumpartikeln zwischen Zellen, aber auch intrazellulär im Makrophagen konnte eine signifikant höhere Zahl von Mastzellen im Vergleich zu Kontrollgeweben dargestellt werden.14 Vermutlich ist die Partikeldissemination der nicht durch Endbearbeitung finalisierten Testkörperoberfläche geschuldet. Zur Klärung dieses Sachverhalts läuft eine gleichartige Untersuchungsreihe mit ATZ-Testkörpern, die herstellerseits mit der zertifizierten Implantatoberfläche ausgestattet sind. Weitere histochemische Untersuchungen (CD 34, CD 45, VEGF, CD 68) zur Evaluation immunologischer Reaktionen und Untersuchungen zur Partikelmigration aus dem periimplantären Gewebe um Zirkonoxidimplantate in den Körper und eines potenziellen Risikos für Zielorgane sind in Analogie zu den bereits vorliegenden Studien an Titanimplantaten geplant.
Ergebnisse einer aktuellen Studie bestätigen das unterschiedliche Korrosionsverhalten von Titan- und Zirkoniumoxidoberflächen im Tiermodell. Zwölf Wochen post implantationem in die Maxillae von Minischweinen wurden im periimplantären Gewebe die Titan- und Zirkonablagerungen detektiert. Die Gewebebelastung mit den entsprechenden Implantatmaterialien war doppelt so hoch um die Titanimplantate als um die Zirkonoxidimplantate. Die ebenfalls gemessenen cytotoxischen Auswirkungen und die Schädigung der DNA durch Materialnanopartikel waren signifikant höher bei Titan als bei Zirkonoxid.33
Fazit
In präklinischen und klinischen Studien zeichnen sich Zirkonoxidimplantate durch gute Osseointegration, gute Materialstabilität, gute immunologische/toxikologische Verträglichkeit, gute Hart- und Weichgewebestabilität und optimale Ästhetik aus (Abb. 12–19). Reversibel verschraubbare zweiteilige Implantatsysteme erlauben eine Erweiterung der prothetischen Indikationsbereiche über den Einzelzahn- und Brückenersatz hinaus. In einzelnen Fällen wurden in den vergangenen zwei bis drei Jahren hybridprothetische Konstruktionen mit Teleskopen und Locatoren als Verbindungselemente durchgeführt. Hierzu fehlt allerdings zurzeit noch die klinische Evidenz.
Für die Beurteilung eines Langzeiterfolgs und assoziierter biologischer Komplikationen über zehn Jahre hinaus stehen entsprechende wissenschaftliche Studien für Zirkonoxidimplantate erwartungsgemäß noch aus.
Der Beitrag ist im Implantologie Journal erschienen.
Die Literaturliste steht hier zum Download bereit.