Oralchirurgie 09.08.2021
Die chirurgische Behandlung der Periimplantitis
share
Die Rehabilitation der oralen Funktionalität und Ästhetik ist heutzutage mit dentalen Implantaten zuverlässig zu erreichen. Dabei erzielen implantatgetragener Zahnersatz und dentale Implantate Langzeitüberlebensraten von über 90 Prozent.1–4 Trotz einer erfolgreichen Osseointegration und regelrechter Funktion der Implantate sind periimplantäre Gewebe aufgrund ihrer begrenzten immunologischen Reaktionsmöglichkeiten anfällig für inflammatorische Erkrankungen. Diese periimplantären Infektionen stellen im Behandlungsalltag eine große Herausforderung dar und können den langfristigen Therapieerfolg gefährden.5 Dieser Beitrag soll eine Übersicht über die aktuellen Kenntnisstände der Ätiologie, Diagnostik sowie periimplantärer Behandlungsmöglichkeiten veranschaulichen.
Aufgrund der komplexen, nicht vollständig geklärten Ätiologie der Erkrankung gibt es in der Literatur keine einheitlichen Therapieprotokolle für die Behandlung der Periimplantitis. Eine chirurgische Intervention sollte erfolgen, wenn trotz bereits durchgeführter geschlossener Periimplantitistherapie klinische Entzündungszeichen wie Blutung auf Sondierung und/oder Suppuration erneut auftreten.
Periimplantäre Infektionen werden durch Entzündungen des suprakrestalen Bindegewebes definiert. Bei der Mukositis ist der entzündliche Prozess auf das periimplantäre Weichgewebe begrenzt, bei der Periimplantitis bis hin zum marginalen Knochen ausgedehnt.6 Die Prävalenz der Periimplantitis liegt bei 22 Prozent, die der periimplantären Mukositis bei 43 Prozent.14, 25 In der aktuellen Literatur werden keine einheitlichen Therapieprotokolle für die Behandlung der Periimplantitis beschrieben. Die Effektivität chirurgischer und nichtchirurgischer Therapieansätze wurde in der aktuellen S3-Leitlinie: „Die Behandlung periimplantärer Infektionen an Zahnimplantaten“ eingeordnet. Dazu gehören das mechanische Debridement, die Nutzung von Antiseptika, die Nutzung lokaler oder systemischer Antibiotika sowie chirurgische Interventionen.7–9 Der epitheliale periimplantäre Mukosakomplex ähnelt weitestgehend dem epithelialen Zahn-Mukosa-Komplex. Das den Implantat-Faser-Komplex umgebene Bindegewebe ist im Vergleich zum Zahnhalteapparat gefäßärmer und sorgt für eine verminderte Immunabwehr gegenüber der bakteriellen Flora der Mundhöhle.10–12 Die Periimplantitis kann sich im Vergleich zur Entzündung am Zahnhalteapparat direkt bis zum periimplantären Knochen ausdehnen, sich somit fulminanter entwickeln und für einen schnellen Knochenabbau sorgen.13
Diagnostik
Periimplantäre Entzündungen können durch die visuelle Inspektion, die Palpation, die periimplantäre Taschentiefenmessung (Blutung auf Sondierung [BOP] und/oder Sekretion) und den radiologischen marginalen Knochenverlust als diagnostische Parameter erkannt werden.14,15 Als Vergleichsdaten sollten eine röntgenologische Diagnostik und eine Taschensondierungstiefenmessung, spätestens nach prothetischer Eingliederung, erhoben werden. Es eignen sich Zahnfilme und Orthopantomogramme für die röntgenologische Diagnostik. Während Orthopantomogramme eine Gesamtübersicht der implantantologischen Versorgung bieten, stellen Zahnfilme die bessere Alternative für die Beurteilung von periimplantären Knochenverlusten dar. Im direkten Vergleich zu den Ausgangswerten und zu radiologischen Voraufnahmen können pathologische Veränderungen von physiologischen Umbauprozessen abgegrenzt werden. Ein Knochenverlust um Implantate geht nicht immer mit einer Periimplantitis einher. Periimplantäre Knochenresorptionen, insbesondere nach umfangreichen Knochenaugmentationen, können auch auf ein verstärktes physiologisches „Remodeling“ hinweisen. Dies ist im Vergleich zur Periimplantitis weder entzündlich noch progredient.
Falls diese Ausgangsdaten nicht vorhanden sind, können klinische Entzündungszeichen wie hyperplastische oder erythematöse periimplantäre Weichgewebsveränderungen, eine erhöhte Blutung auf Sondierung und/oder Suppuration oder Taschensondierungstiefen von mindestens 6 mm auf eine Mukositis bzw. Periimplantitis hinweisen.8,19,20 Obwohl eine Blutung auf Sondierung bereits mindestens für eine Mukositis spricht, sollte eine Suppuration als Zeichen einer manifesten Periimplantitis betrachtet werden.21
Das Fehlen einer oder mehrerer Parameter schließt allerdings das Vorhandensein einer Periimplantitis nicht aus. Rezessionen sollten bei der Erhebung der Parodontalparameter ebenfalls erfasst werden. Initial kommt es sowohl bei der Mukositis als auch bei der Periimplantitis zu einer erhöhten Mukosadicke, weshalb Rezessionen erst bei einem verstärkten krestalen Knochenrückgang klinisch auffallen.55, 62 Die mikrobiologische Flora der periimplantären Mukositis und der Periimplantitis ist unspezifisch, sodass kein bakterieller Leiterreger für die Diagnostik herangezogen werden kann.16–18
Äthiologie
Bei der Periimplantitis und der Mukositis handelt es sich um eine plaqueassoziierte Erkrankung mit multifaktorieller Ätiologie. Der Biofilm wird durch eine anaerobe Mikroflora charakterisiert, bei welcher gramnegative Bakterien dominieren. Die Progression der Erkrankung führt zu einem nicht linear verlaufenden Knochenverlust, welcher in den meisten Fällen mit klinischen Entzündungszeichen einhergeht.34, 53 Der inflammatorische Prozess wird bei der periimplantären Läsion von Makrophagen und neutrophilen Granulozyten dominiert.22, 54 Neben bakteriellen Komplexen konnte auch eine mit der Erkrankungsschwere zunehmende Dysbiose des submukosalen Biofilms zugunsten von potenziell pathogenen Keimen nachgewiesen werden.56 Lokale und systemische Faktoren können die Erkrankung und deren Progredienz begünstigen.
Risikofaktoren sind eine gesicherte parodontale Vorerkrankung, eine schlechte Mundhygiene, schlecht eingestellter Diabetes mellitus und Nikotinabusus.23,24,31–33,52 Bei Patienten mit parodontaler Vorerkrankung kann es eingeschränkte Implantaterfolge geben. Sie machen allerdings einen Großteil des implantologisch zu versorgenden Patientenkollektivs aus und bedürfen entsprechender engmaschiger Nachsorge.25–29 Die Progression des periimplantären Prozesses ist im nativen und augmentierten Knochen vergleichbar. Eine umfassende Diagnostik sowie eine parodontale Vorbehandlung sind vor implantologischer Rehabilitation daher obligat, um stabile Langzeitergebnisse erzielen zu können.30
Therapie der Periimplantitis
Die Behandlung der Periimplantitis erfolgt immer noch hauptsächlich symptomatisch, weil eine kausale therapierbare Ursache für ihre Entstehung bisher nicht gefunden ist. Sie orientiert sich an den bestehenden Behandlungskonzepten der Parodontitis.19–21 Zunächst liegt der Fokus auf regelmäßigen und professionell durchgeführten Plaqueentfernungen sowie der Verbesserung der häuslichen Mundhygiene. Zusätzlich sollten die Hygienefähigkeit der Suprakonstruktion optimiert und mögliche potenzielle Ursachen, wie zum Beispiel überstehende Kronenränder oder nicht gut erreichbare Reinigungskanäle, angepasst werden. Die Okklusion und der korrekte Sitz der Implantatsuprakonstruktion sollten überprüft und gegebenenfalls korrigiert werden. Patienten sollten regelmäßig über den Einfluss des Rauchens auf die Begünstigung von entzündlichen Ereignissen auf das periimplantäre Gewebe aufgeklärt und zur Rauchabstinenz motiviert werden.
Die Therapie der Periimplantitis lässt sich in nichtchirurgische und chirurgische Therapieinterventionen aufteilen. Faktoren wie die Oberflächenrauigkeit der Abutments, die Reinigungsfähigkeit der prothetischen Suprakonstruktion und die Implantatinsertionstiefe können den Therapieerfolg beeinflussen.60,61 Im Rahmen der nichtchirurgischen und chirurgischen Therapie der Periimplantitis werden neben der mechanischen Reinigung häufig zusätzlich photodynamische Dekontaminationen, antiseptische Spülungen und lokale sowie systemische Antibiotika eingesetzt. Der Einsatz von Hand- oder Schallinstrumenten für die Reinigung der kontaminierten Implantatoberfläche ist der aktuelle Standard in der nichtchirurgischen konservativen Therapie der Periimplantitis. Ein zusätzlicher Einsatz von Adjuvantien führt nicht signifikant zu einer Verbesserung des Therapieergebnisses.37 Falls nach erfolgter Reevaluation der geschlossenen Periimplantitistherapie klinische Entzündungszeichen, wie Blutung auf Sondierung oder Suppuration, erneut auftreten, sollte eine chirurgische Therapie durchgeführt werden.35
Chirurgische Behandlung
Bei periimplantären Läsionen mit rascher Progressionstendenz sollten frühzeitig chirurgische Interventionen Anwendung finden. In der aktuellen Literatur gibt es kein Therapieprotokoll, welches im Bereich der Oberflächendekontamination oder des chirurgisch interventionellen Ansatzes einen signifikanten Vorteil gegenüber einem anderen zeigt.36 Die spezifische Defektmorphologie und deren Analyse zur Auswahl des richtigen regenerativen oder resektiven Verfahrens wiederum sind für den Behandlungserfolg von Relevanz.55 Analog zur Parodontitistherapie sollten zunächst die bakterielle Plaque, Zement, der mechanische Biofilm sowie Granulationsgewebe vollständig entfernt werden. Dazu eignen sich Küretten, Schallinstrumente, Hartmetallfräsen oder Pulver-Wasser-Strahlgeräte (z. B. Air-Flow). Zusätzliche dekontaminierende Spüllösungen wie H202 (3 %), Zitronensäure (3 %), CHX (0,2 %) oder Kochsalzlösungen sowie eine photodynamische Dekontamination mittels Soft-Laserverfahren können unterstützend verwendet werden.19,20,35 Bei der Periimplantitis kann die nichtchirurgische Therapiephase dazu genutzt werden, bei der chirurgischen Intervention ein weitestgehend entzündungsfreies Interventionsgebiet zu erlangen.
Die Reduktion der Taschensondierungstiefen, eine Elimination klinischer Anzeichen der Infektion (Blutung und/oder Sekretion auf Sondierung) sowie eine Stabilisierung des periimplantären Knochenniveaus sind primäre Endziele der chirurgischen Periimplantitistherapie.38
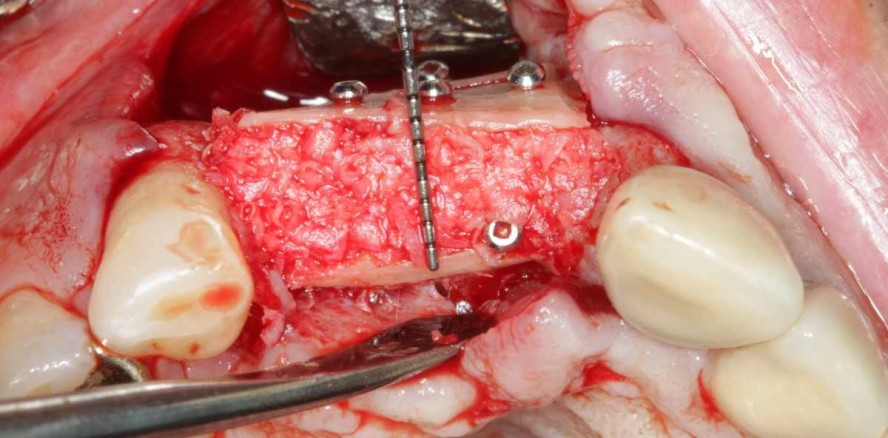
Um eine genaue Diagnostik und einen besseren Zugang für die chirurgische Intervention zu ermöglichen, empfiehlt es sich, die Suprakonstruktion zu entfernen.35 Nach genauer Inspektion des klinischen Defekts können resektive und/oder regenerative chirurgische Eingriffe für eine Reduktion der intraossären Defektmorphologie sorgen, welche eine Verbesserung der klinischen Surrogatparameter zur Folge haben. Sobald es im Rahmen des chronischen periimplantären Entzündungsprozesses durch den pathologischen Knochenabbau zu einer Exposition der rauen Implantatoberfläche kommt, eignen sich resektive Verfahren bei mehrwandigen Verlusten des periimplantären Knochens, um die Anlagerung von Plaque und somit die Entstehung eines bakteriellen Biofilms zu erschweren. Da eine Wiederherstellung der knöchernen Strukturen durch augmentative Maßnahmen wegen der sehr schwachen Regenerationseigenschaften des Implantatlagers nicht vorhersagbar durchzuführen ist, begnügt man sich in der Regel mit dem palliativen Erhalt des kompromittierten Implantats durch die Politur der rauen und biofilmfreundlichen Oberfläche. Bei vertikalen intraossären Knocheneinbrüchen können augmentative Therapieverfahren angewendet werden. Die Defektmorphologie ist entscheidend für den Augmentationserfolg: Je mehr knöcherne Begrenzungen um den Defekt vorhanden sind, desto besser die Regenerationseigenschaften des Implantatlagers. Voraussetzung dafür ist aber eine ausreichende Dekontamination der Implantatoberfläche. Eine Explantation als Ultima Ratio wird erst ab einem periimplantären Knochenabbau von mehr als 50 Prozent (Taschensondierungstiefen über 8 mm) durchgeführt.39 Die aktuelle Leitlinie empfiehlt die operative Entfernung eines nicht therapierbaren Implantats bei irreversiblen technischen Komplikationen, Implantatlockerungen oder Ausbreitung der Entzündung auf gesunde Nachbarstrukturen.14 Die daraus resultierenden Knochendefekte können komplexe und techniksensitive Behandlungen erfordern (Abb. 1a–d).
Resektive Verfahren in der Periimplantitistherapie
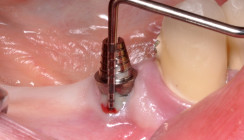
Bei der Implantoplastik stehen die Entfernung des Granulationsgewebes und die mechanische Reinigung der Implantatoberfläche im Vordergrund. Es wird sowohl die Mikro- als auch Makrostruktur der freiliegenden Implantatwindungen geglättet, welche sich außerhalb der physiologischen Barriere für aktuelle Augmentationsverfahren befinden.14,35
Im Vergleich zur alleinigen mechanischen Reinigung können in Kombination mit einer apikalen Verschiebung des periimplantären Weichgewebes die Taschensondierungstiefen und Blutungspunkte nach Sondierung signifikant reduziert werden. Bei der Implantoplastik wird die freiliegende Implantatoberfläche zunächst mit Hand- und Schallinstrumenten gereinigt. Anschließend wird die Oberflächenstruktur mit diamantierten Schleifkörpern poliert, sodass eine reduzierte Oberfläche für die Anheftung der bakteriellen Plaque erreicht wird. Rauigkeitswerte (Ra-Werte) nach initialer Politur liegen zwischen 0,39 und 4,75 μm. Um den gewünschten Ra-Wert von unter 0,2 μm zu erzielen, bei dem keine Beeinflussung der Quantität und Zusammensetzung des Biofilms nachweisbar ist, ist eine Oberflächenbehandlung mit unterschiedlichen Polierern notwendig.40,41 Ein Beispiel für diamantierte Schleifkörper und Polierer ist in Abbildung 2 dargestellt. Eine entstehende Überhitzung durch einen zu hohen Anpressdruck des Schleifkörpers auf die Implantatoberfläche sollte unbedingt vermieden werden, da sie sich direkt auf den periimplantären Knochen auswirkt und zu einer Nekrose führen kann.42 Eine abschließende H2O2- und NaCl-Spülung ist notwendig, um alle verbleibenden Metallpartikel zu entfernen. Adjuvant empfiehlt sich eine photodynamische Dekontamination und die Applikation eines lokalen Antibiotikums (z. B. Ligosan).
Im Anschluss an die Implantoplastik kann die Suprakonstruktion im Gegensatz zu den augmentativen Verfahren erneut inseriert werden. Für eine effiziente Erhaltungsphase kann es sinnvoll sein, die Suprakonstruktion so umzuarbeiten, dass der Patient eine bestmögliche Mundhygiene erzielen kann. Da es durch die chirurgische Reduktion der tiefen pathogenen Taschen zu weiteren Rezessionen am periimplantären Weichgewebe kommen kann, sollte die Implantoplastik nur im Seitenzahnbereich, also im nichtästhetischen Bereich, durchgeführt werden (Abb. 3a–f).
Augmentationsverfahren in der Periimplantitistherapie
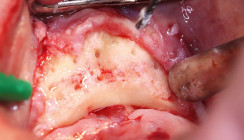
Eine genaue präoperative Analyse der Defektmorphologie ist die Grundvoraussetzung für den vorhersagbaren Erfolg bei Knochenaugmentationen periimplantärer Hartgewebsdefizite. Dazu eignen sich Röntgenbilder und natürlich die klinische Sondierung und Inspektion des Defekts. Eine Augmentation erfolgt in der Regel im Bereich spezifischer intraossärer Defekte. Der Defekt wird durch einen vollschichtigen Mukoperiostlappen und eine gründliche Degranulierung dargestellt und mittels mechanischer Reinigung der Implantatoberfläche vorbehandelt. Je nach Defektkonstellation kann eine regenerative Therapie an Implantaten mittels autologem Knochen und/oder Knochenersatzmaterialien angestrebt werden. Für augmentative Verfahren in der Implantologie ist der autologe Knochen immer noch der Goldstandard. Für den ungestörten physiologischen Regenerationsprozess ist ein geschlossenes Einheilen sinnvoll.35, 43
In der täglichen Praxis empfiehlt sich zunächst eine Abnahme der Suprakonstruktion und eine offene Kürettage zur Entfernung des Biofilms und des Granulationsgewebes. Im Anschluss erfolgt eine desinfizierende Spülung mit 3%igem H2O2 sowie eine photodynamische Dekontamination (HELBO®). Die Implantate sollten dabei nicht mit Gingivaformern, sondern mit Abdeckschrauben verschlossen werden, um eine bessere periimplantäre Weichgewebsheilung zu erzielen.8 Nach circa vier Wochen erfolgt die Weiterbehandlung durch die Augmentation der Knochendefekte unter antibiotischer Abschirmung. Dabei soll mit der präoperativen Antibiose 24 Stunden vor dem Eingriff mit der Kombination Amoxicillin und Metronidazol begonnen und für eine Woche mit der täglichen Dosierung von 2 g Amoxicillin und 750 mg Metronidazol fortgesetzt werden.8 Nach Bildung eines Mukoperiostlappens und Reinigung sowie Dekontamination der Implantatoberfläche mit H2O2-Spüllösungen und dem HELBO-Laser erfolgt die Augmentation des Knochendefekts. Die Autoren verwenden zur Rekonstruktion der ossären Defekte autologen Knochen, welcher als Knochenblock (Knochenschale) und/oder Knochenspäne aus der unmittelbaren Nachbarschaft entnommen werden kann. Die Knochenblöcke werden dann, analog zur herkömmlichen Schalentechnik, mithilfe von Mikroosteosyntheseschrauben um den Defekt herum stabilisiert. Die restlichen Hohlräume werden mit Knochenspänen gefüllt (Abb. 4a–d). Bei Kombinationsdefekten können resektive mit augmentativen Verfahren kombiniert werden und führen ebenfalls zu stabilen Langzeitergebnissen. Eine frühere Studie hat gezeigt, dass bei Augmentationen mit Knochenblöcken nach dem „Split Bone Block-Verfahren“ (Schalentechnik) die Verwendung von zusätzlichen Membranen nicht notwendig ist.8 Nicht resorbierbare Membranen werden benutzt, wenn nur partikuliertes Knochenmaterial verwendet wird. Anhand der Defektmorphologie wird entschieden, welche Methode Anwendung findet. Nicht resorbierbare Membranen sind aufgrund der geringeren Adhäsion an das umliegende Gewebe empfänglicher für frühzeitige Expositionen und für Kontaminationen und sollten daher nur in speziellen Anwendungsbereichen berücksichtigt werden.8 Resorbierbare Membranen sollten aufgrund ihrer Instabilität in dem bereits kompromittierten Operationsgebiet nach Erfahrung der Autoren keine Anwendung finden. Der Wundverschluss sollte idealerweise zweischichtig erfolgen. Im Oberkiefer geschieht dies durch die zusätzliche Verwendung eines palatinal gestielten Bindegewebslappens. In der Unterkieferfront kann ein vestibulär gestielter Bindegewebslappen, im posterioren Seitenzahngebiet ein gestielter Periost-Masseterlappen genutzt werden. Nach dreimonatiger Einheilung erfolgen die Implantatfreilegung und die Eingliederung der Suprakonstruktion. Da es sich bei resektiven und regenerativen Therapieansätzen um eine symptomatische und nicht kausale Therapie handelt, muss der Patient über ein Restrisiko aufgeklärt werden, obwohl Augmentationen mit autologem Knochen stabile Langzeitergebnisse zeigen.31, 43–48, 51
Weichgewebsmanagement in der chirurgischen Periimplantitistherapie
Neben dem knöchernen Implantatlager kommt dem periimplantären Weichgewebe funktionell und ästhetisch eine besondere Bedeutung zu. Ein ausreichend breites Angebot an fixierter und/oder keratinisierter Gingiva ermöglicht eine adäquate Hygienefähigkeit und kann somit die Entstehung einer periimplantären Infektion verhindern. Für eine langfristige entzündungsfreie periimplantäre Weichgewebssituation ist eine Breite von mindestens 2 mm keratinisierter oder fixierter nicht beweglicher Gingiva um das Implantat notwendig.35 Durch eine Verbreiterung der keratinisierten Mukosa durch entsprechende Weichgewebsaugmentationen können klinisch relevante Verbesserungen der Entzündungsparameter und eine Stabilisierung des periimplantären Knochenniveaus erreicht werden.57,59 In der aktuellen Literatur werden unterschiedliche Materialien zur Verdickung und Verbreiterung des periimplantären Gewebes vorgestellt, allerdings hat sich das autologe Weichgewebstransplantat in Form eines freien Schleimhauttransplantats als besonders erfolgreich erwiesen. Freie Schleimhauttransplantate werden verwendet, um stabile keratinisierte Gingiva ohne inserierende Muskelzüge im Rahmen einer Vestibulumplastik zu erzielen (Abb. 5a–i).
Der so gewonnene befestigte Schleimhautsaum ermöglicht zum einen eine gute Hygienefähigkeit sowie eine gute Ästhetik und zum anderen bei Interventionsnotwendigkeit eine adäquate Wundheilung mit geringerer postoperativer Rezessionsbildung.35, 57, 58
Periimplantäres Gewebe kann durch Weichgewebsaugmentationen in Kombination mit resektiven und/oder regenerativen Therapieverfahren langfristig stabilisiert werden.49 Eine apikale Verschiebung in Kombination mit resektiven Weichgewebsausdünnungen eignet sich in ästhetisch nicht relevanten Seitenzahnbereichen zur Taschenreduktion und zur Verbesserung der Mundhygiene.35, 50 Zur Verbreiterung der keratinisierten Gingiva erzielen freie Schleimhauttransplantate in Kombination mit einem apikalen Verschiebelappen in der Literatur die besten Ergebnisse (Abb. 5a–i). Sie zeichnen sich durch weniger Blutung auf Sondierung, bessere Plaqueindizes, weniger Rezessionen und ein langzeitstabiles periimplantäres Knochen- und Weichgewebsniveau aus.
Schlussfolgerung
Aufgrund der komplexen, nicht vollständig geklärten Ätiologie der Erkrankung gibt es in der aktuellen Literatur keine einheitlichen Therapieprotokolle für die Behandlung der Periimplantitis. Die Blutung auf Sondierung, Suppuration, die Taschensondierungstiefen und der radiologische Knochenabbau sind ausschlaggebend für die periimplantäre Diagnostik. Um einer Periimplantitis vorzubeugen, sollte initial auf suffiziente periimplantäre Knochenverhältnisse und fixierte Gingiva sowie gute Mundhygiene und Compliance des Patienten geachtet werden.52 Die Periimplantitis kann je nach Defektmorphologie mit resektiven und/oder augmentativen Maßnahmen effizient behandelt werden. Autologe Knochen- und Weichgewebstransplantate zeigen unter Berücksichtigung einer präzisen Indikationsstellung deutliche Vorteile verglichen mit Ersatzmaterialien unterschiedlichen Ursprungs. Trotz eines gewissen Restrisikos kann man Knochendefekte im Rahmen einer Periimplantitisbehandlung mit dem vorgestellten Therapiekonzept zuverlässig wiederherstellen. In einigen Fällen begnügt man sich im Rahmen einer resektiven Implantoplastik mit dem palliativen Erhalt des kompromittierten Implantats. Regelmäßige Nachuntersuchungen in Kombination mit intensiver Patientenmotivation, Erhebung der Parodontalparameter und einmal jährlicher radiologischer Kontrolle im Rahmen der Erhaltungsphase sind für den Langzeiterfolg von entscheidender Bedeutung.
Dieser Beitrag ist im Oralchirurgie Journal erschienen.