Implantologie 26.05.2015
Anwendungsbeobachtung einer β-TCP-basierten Knochenersatzmaterialpaste
share
Ziel der folgenden Untersuchung war es, ein neuartiges pastöses β-Tricalciumphosphat-(β-TCP)-basiertes Knochenersatzmaterial zur Socket Preservation und Sinusbodenaugmentation zu untersuchen. Zudem wurde in einer präklinischen In-vivo-Untersuchung die Gewebereaktion auf das gleiche Knochenersatzmaterial im Kleintiermodell ausgewertet. Dabei wurde nach einem standardisierten Studienprotokoll in Extraktionsalveolen im Frontzahn- und Prämolarengebiet eine β-TCP-basierte Knochenersatzmaterialpaste (CERASORB® Paste, curasan) appliziert und diese mit einer xenogenen Kollagenmembran abgedeckt. Zudem wurde dieses Knochenersatzmaterial zur Sinusbodenaugmentation bei reduziertem Knochenangebot im Oberkieferseitenzahnbereich verwendet.
Implantate haben sich als verlässliche, gut erprobte und dokumentierte Methode zum Ersatz durch Parodontitis, Karies oder Traumata verloren gegangener Zähne sowie zur Lagestabilisierung von Prothesen erwiesen. Dabei sind die Anforderungen an ein Implantatsystem neben Langlebigkeit, Sicherheit für Behandler und Patienten die einfache Handhabung bei einer möglichst breiten Einsetzbarkeit. Bei aller Vielfalt der verschiedenen Implantatsysteme ist ein qualitativ und quantitativ suffizientes Knochenlager die Grundvoraussetzung für eine langzeitstabile Osseointegration der Implantate.1 In Folge von Parodontitis, Traumata oder fortgeschrittener Atrophie des Alveolarknochens ist jedoch nur in wenigen Fällen eine Implantatinsertion ohne zusätzliche augmentative Eingriffe zum Aufbau und Konditionierung des Knochenlagers möglich. In einer Vielzahl von Fällen, wie beispielsweise im Oberkieferseitenzahngebiet, ist durch ein begrenztes Angebot an ortsständigem Alveolarknochen ein zusätzlicher augmentativer Eingriff nötig.2
In den letzten Jahren konnte gezeigt werden, dass sich eine Stabilisierung der knöchernen Alveole unmittelbar nach Zahnextraktion im Sinne einer Socket oder Ridge Preservation vorteilhaft auf den Erhalt knöcherner Strukturen und speziell der grazilen und für den ästhetischen Erfolg von Frontzahnimplantaten wichtigen bukkalen Lamelle auswirkt.3–5 Sowohl für die Sinusbodenaugmentation als auch für sie Socket/Ridge Preservation haben sich zahlreiche Materialien als geeignet erwiesen. Dabei haben sich neben autologen Knochentransplantationen xenogene und alloplastische Knochenersatzmaterialien als verlässliche Leitstrukturen für die knöcherne Regeneration erwiesen.6–8 Mit ihrer Herkunft von Tieren (xenogen) oder synthetischen Materialien (alloplastisch) dienen beide Materialklassen als osteokonduktive Leitstruktur für die Migration von knochenbildenden Vorläuferzellen. Durch die nötige Prozessierung des Ursprungsmaterials besitzen die xenogenen wie auch die synthetischen Knochenersatzmaterialien keine osteoinduktiven oder osteogenen Fähigkeiten, welche ausschließlich bei autologen Knochenspenden oder Stammzellen zu finden sind.9 Trotz des Fehlens dieser Eigenschaften haben jedoch beide Materialklassen in verschiedenen Untersuchungen ihre Eignung und Leistungsfähigkeit bewiesen und können deshalb als vielfältig einsetzbare Alternativen zur autologen Knochentransplantation angesehen werden. Mit ihrer Hilfe ist es möglich, dem Patienten einen weiteren Eingriff, verbunden mit der Belastung eines zweiten Operationsgebietes und dem Risiko einer Morbidität an der Entnahmestelle, zu ersparen.10,11
Wichtige Faktoren für die Entwicklung und Herstellung von Knochenersatzmaterialien, die bei der Knochenregeneration eine entscheidende Bedeutung spielen, sind neben der Herkunft und Prozessierung des Ursprungsmaterials die Porosität und Porengröße desselbigen. So ist die Porosität des Materials eine entscheidende Voraussetzung dafür, dass im Augmentationsgebiet eine durchgängige Vaskularisierung des Knochenersatzmaterials erreicht wird, um die Besiedelung durch knochenbildende Zellen zu ermöglichen.12 In der Literatur wird eine Porosität des Knochenersatzmaterials von 75–80 Prozent gefordert. Eine weitere wichtige Materialkonstante ist die Porengröße, die für das Einwachsen neugebildeten Knochengewebes in das Material benötigt wird. In der Literatur werden dafür Werte zwischen 100 und 1.000 µm angegeben.12–14 Ein Unterschreiten dieser Werte für die Porengröße birgt das Risiko einer verminderten Vaskularisation des augmentierten Gebietes und bindegewebiger Einkapslung der Knochenersatzmaterialpartikel.15 Damit kann die osteogene Potenz des Materials verringert werden.
Ziel der vorliegenden Untersuchung war es, ein pastöses β-Tricalciumphosphat-(β-TCP-)basiertes Knochenersatzmaterial zur Socket Preservation und Sinusbodenaugmentation zu untersuchen. Dabei wurde ein spezielles Augenmerk auf die klinische Handhabung des Materials für den praktizierenden Zahnarzt/Oral-/Kieferchirurgen/Implantologen und mögliche Komplikationen während der Behandlung gelegt. Im Vorfeld der Untersuchung wurde zudem die Gewebereaktion auf das Material in einer In-vivo-Untersuchung analysiert.
Material und Methoden
Knochenersatzmaterial
Untersucht wurde ein Dreikomponenten-Knochenersatzmaterial (CERASORB® Paste, curasan) in pastöser Darreichungsform, bestehend aus zerkleinertem β-TCP-Granulat, Hyaluronsäure und Methylzellulose. Durch Sinterung und Zerkleinerung werden während des Herstellungsprozesses Keramikpartikel mit einer Größe von durchschnittlich 63 µm erzeugt, welche mit einer wässrigen Polymerlösung im Verhältnis 70 Gewichtsprozent Keramik und 30 Gewichtsprozent Polymerlösung gemischt werden.16
In-vivo-Untersuchung der Gewebereaktion
Im Vorfeld der klinischen Untersuchung wurde das Knochenersatzmaterial subkutan in Wistar-Ratten implantiert, um die Gewebereaktion zu untersuchen (Gruppe 1). Als Kontrollgruppe dienten eine Gruppe von Ratten mit Implantation von puren β-TCP-Granulaten (Gruppe 2) und eine Gruppe von Ratten mit leeren Implantationstaschen (sham operated, Gruppe 3). Nach 3, 10, 15, 30 und 60 Tagen wurden die Ratten euthanasiert, das implantierte Knochenersatzmaterial entnommen, fixiert, in Paraffin eingebettet und in Schichten für die histologische und histomorphometrische Untersuchung geschnitten. Mithilfe eines Mikroskops (Nikon, Tokyo, Japan) und der NIS-Elements Analyse Software (Nikon, Tokyo, Japan) wurde die Gewebereaktion auf das Biomaterial sowie die Vaskularisierung im periimplantären Gewebe untersucht.17–19
Nach einem standardisierten Studienprotokoll wurden Extraktionsalveolen im Frontzahn- und Prämolarenbereich mit einer β-TCP-basierten Knochenersatzmaterialpaste (CERASORB® Paste, curasan) in der Klinik für Mund-, Kiefer- und Plastische Gesichtschirurgie (Frankfurt am Main), der Praxis für Implantologie und Parodontologie 32 schöne Zähne (Forchheim) und der HL-Dentclinic (Baden Baden) gefüllt und mit einer Kollagenmembran abgedeckt (Abb. 1a–d). Zudem wurde bei reduziertem vertikalen Knochenangebot (< 5 mm) im Oberkieferseitenzahnbereich eine Sinusbodenaugmentation mit dem gleichen Material durchgeführt. Die Patienten wurden vor dem Eingriff über den chirurgischen Eingriff und das verwendete Knochenersatzmaterial aufgeklärt und gaben ihr schriftliches Einverständnis. Nach einer Integrationsphase von drei Monaten folgte die Implantation im Bereich der Alveole und des augmentierten Sinus. In der initialen Heilungsphase nach der Augmentation sowie nach drei Monaten Integrationsphase wurden die Patienten klinisch nachuntersucht, um Anzeichen für Komplikationen oder Abstoßungsreaktionen frühzeitig zu erkennen, zu dokumentieren und therapieren zu können.
Ergebnisse
In-vivo-Untersuchung der Gewebereaktion
Das pastöse Knochenersatzmaterial zeigte bei der Implantation in das subkutane Gewebe von Ratten eine kompakte zweiphasige Anordnung in einen inneren (IR: Inner Region) und einen äußeren Bereich (OR: Outer Region). Eine große Anzahl an Makrophagen, Lymphozyten und einige Plasmazellen waren an der Oberfläche der Knochenersatzmaterialpaste festzustellen (Abb. 2a). Auch an Tag 10 nach Implantation war eine Separation des Materials in die oben genannten Phasen erkennbar. Zudem zeigte sich ein beginnender Einwuchs von Granulationsgewebe in den äußeren Bereich. An Tag 15 war eine zunehmende Degradation des äußeren Bereiches mit Formation eines gefäß- und zellreichen Granulationsgewebes festzustellen mit deutlich weniger mononukleären und mehrkernigen Riesenzellen im inneren als im äußeren Bereich (Abb. 2b). An Tag 30 nach Implantation war eine vollständige Invasion eines faser- und gefäßreichen Gewebes in den inneren Bereich festzustellen. Der äußere Bereich war ab Tag 30 durch ein faserreiches Granulationsgewebe ersetzt (Abb. 2c). An Tag 60 waren nur mehr wenige Überreste des Materials eingebettet in ein faserreiches Granulationsgewebe zu erkennen.
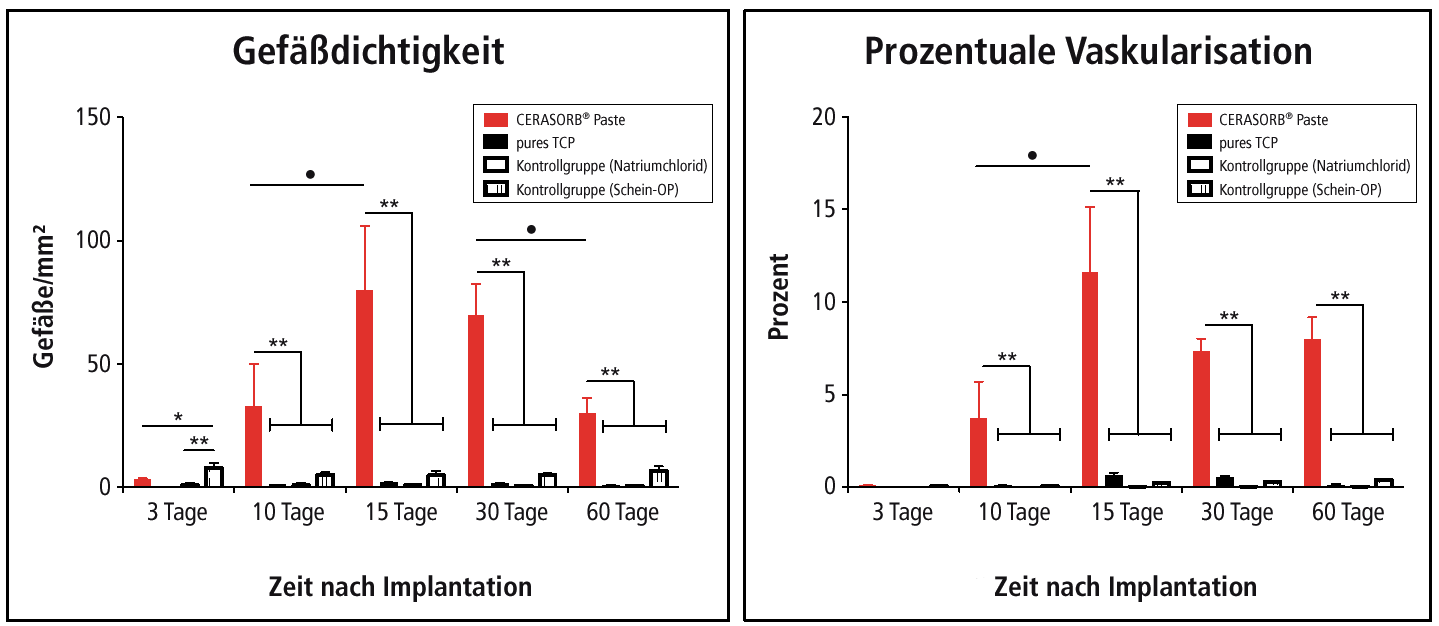
Abb.
3: Grafische Darstellung der a) Gefäßdichte und b) prozentualen
Vaskularisation der b-TCP basierten Knochenersatzmaterialpaste (roter
Balken) nach subkutaner Implantation in Ratten im Vergleich zu
b-TCP-Granulaten (schwarzer Balken) und zu den Kontrollgruppen (weiße
Balken).
(*/** = interindividuelle statistische Signifikanz, •/•• = intraindividuelle statistische Signifikanz; (*/•p < 0,05; (**/••p < 0,01) (Ghanaati et al. 2011).
Neben der histologischen Untersuchung der implantierten Knochenersatzmaterialpaste wurde eine histomorphometrische Untersuchung der Vaskularisierung im Implantationsbett durchgeführt. Es zeigte sich, dass ab Tag 15 eine signifikant höhere prozentuale Vaskularisierung und Gefäßdichte im Implantationsbett der b-TCP-basierten Paste im Vergleich zu den beiden Kontrollgruppen zu verzeichnen war (**p < 0,01) (Abb. 3a und b).20
Klinische Anwendung zur Socket Preservation und Sinusbodenaugmentation
In der Anwendung überzeugte die Knochenersatzmaterialpaste durch sehr gute Handhabung und vereinfachte Applikation. Mithilfe einer Kanüle war eine punktgenaue und exakt dosierte Applikation möglich. Somit war auch die Menge des applizierten Augmentationsmaterials exakt steuerbar und ein Über-/Unterfüllen konnte vermieden werden. Auch ein Anmischen mit Blut oder einer Kochsalzlösung, wie es für Knochenersatzmaterialgranulate empfohlen wird, entfiel durch die pastöse Darreichungsform. Zudem war durch die Adhäsion und Fließfähigkeit der Paste eine vollständige Füllung der Alveole/des subantralen Raums möglich. Auch unter sich gehende und mit konventionellen Instrumenten nur schwer zugängliche Bereiche konnten problemlos aufgefüllt werden. Das applizierte Material verblieb nach Applikation formstabil und es kam zu keiner Auflösung oder Dissolution im Augmentationsbett, wodurch ein ungewolltes Verteilen oder „Verschmieren“ der Paste verhindert werden konnte. Durch die pastöse Darreichungsform wies das Knochenersatzmaterial keine scharfen Kanten auf. Damit stellte dieses Material im Fall der Sinusbodenaugmentation bei fragiler Schneider’schen Membran kein Risiko für Perforationen dar. Somit war nicht nur die Handhabung und Applikation, sondern auch die Sicherheit bei der Applikation für Patienten und Behandler im Vergleich zu Knochenersatzmaterialgranulaten erhöht. Es traten im Rahmen der postoperativen Heilungsphase keinerlei Abstoßungsreaktionen oder Komplikationen auf.
Diskussion
Die untersuchte β-TCP-basierte Knochenersatzmaterialpaste zeigte bei der klinischen Anwendung eine hervorragende Eignung zur Socket Preservation und Sinusbodenaugmentation. Durch die Darreichungs- und Applikationsform aus einer Injektionskanüle ist es möglich, das Knochenersatzmaterial in die vorgesehene Augmentationshöhle einfach, zeitsparend und dadurch ökonomisch einzubringen. Gerade bei der Sinusaugmentation ist es zudem möglich, Komplikationen in Form von Perforationen der Schneider’schen Membran zu vermeiden. Zusammengefasst lässt sich der Knochenersatzmaterialpaste die Fähigkeit zur Regeneration verloren gegangenen ortsständigen körpereigenen Knochens attestieren. Die Analyse der Gewebereaktion in vivo ergab eine gute Gewebeintegration, ausgiebige Gefäßneubildung und keine Anzeichen einer Fremdkörperreaktion. Es zeigte sich die Anordnung des Knochenersatzmaterials in einen inneren Kern und einen äußeren Ring. Aufgrund dieser Materialbeschaffenheit war die Degradation von der Peripherie in Richtung Zentrum ohne verfrühten Einwuchs von Granulationsgewebe möglich. Die beobachtete kontinuierliche Zunahme der Vaskularisation des Implantationsbettes könnte mit diesem speziellen Abbaumuster in Zusammenhang stehen.
Physikochemische Materialeigenschaften sowie Materialverarbeitung spielen eine wesentliche Rolle für die regenerative Potenz von synthetischen Knochenersatzmaterialien. Hydroxylapatit (HA) ist bekanntlich langsamer resorbierbarer als β-TCP.21–23 Eine zügige Degradation von Knochenersatzmaterialien birgt das Risiko eines verfrühten Einwachsens von Granulationsgewebe in das Augmentationsbett, wodurch es zu einer Beeinträchtigung der Knochenneubildung kommen kann.
Die hier untersuchte Knochenersatzmaterialpaste ist eine Kombination von β-TCP, Hyaluronsäure und Methylzellulose. Die Kombination dieser drei Bestandteile ermöglicht eine stabile Polymerlösung, in welche die Knochenersatzmaterial-Granula eingebettet sind. Dies führt dazu, dass sich das Material nach der Augmentation in einen inneren und einen äußeren Bereich anordnet. Diese strukturelle Anordnung verhindert das verfrühte Bindegewebseinwachsen in den inneren Bereich. Damit wird eine verfrühte Desintegration des Knochenersatzmaterials vermieden. In klinischen Studien konnte bereits die Eignung injizierbarer Knochenersatzmaterialpasten zur Socket Preservation gezeigt werden.24 Dabei konnte die Knochenersatzmaterialpaste hinsichtlich der Sicherheit bei der klinischen Anwendung überzeugen. Zudem konnte mithilfe der verwendeten Knochenersatzmaterialpaste die Resorption des Alveolarknochens nach Zahnextraktion verringert werden.24 Die in der Paste enthaltenen Knochenersatzmaterial-Granula zeigten sich bei der histologischen Untersuchung in direktem Kontakt mit mineralisiertem Knochengewebe, wodurch die osteokonduktive Fähigkeit der Knochenersatzmaterialpaste untermauert werden konnte.24
Diese Daten bekräftigen die Erkenntnisse der vorliegenden Untersuchung und legen nahe, dass die Anwendung pastöser Knochenersatzmaterialien in Zukunft vermehrte Anwendung finden könnte. Weitere klinische Studien mit diesem pastösen Material sind notwendig, um dessen Etablierung in der Klinik voranzutreiben.
Zusammenfassung
In der vorliegenden klinischen Anwendungsbeobachtung wurde ein b-TCP-basiertes pastöses Knochenersatzmaterial bestehend aus b-TCP-Granulaten, Methylcellulose und Hyaluronsäure zur Socket Preservation und Sinusbodenaugmentation untersucht. Bei der Implantation drei Monate nach Augmentation zeigte sich ein knöchern regeneriertes Implantationsbett, welches die stabile Insertion dentaler Implantate ermöglichte. Dabei überzeugte die Knochenersatzmaterialpaste durch sehr gute Handhabung, vereinfachte Applikation ohne Auftreten von Komplikationen. Die präklinische In-vivo-Untersuchung der Knochenersatzmaterialpaste in Ratten zeigte über einen Zeitraum von 60 Tagen eine gute Gewebeintegration, Vaskularisierung und das Fehlen einer Abstoßungsreaktion. Neben einsprießenden Gefäßen zeigten sich lediglich wenige verbliebene β-TCP-Granulate und keine Anzeichen einer Entzündungs- oder Fremdkörperreaktion auf das Biomaterial im Augmentationsbett nach 60 Tagen. Histologische Untersuchungen humaner Knochenbiopsien sowie Langzeituntersuchungen von im Augmentationsbett inserierten Implantaten sind erforderlich, um die klinische Tauglichkeit dieses Materials weiter zu untermauern.
Eine ausführliche Literaturliste finden Sie hier.
Anmerkung
Teile dieses Artikels und die darin enthaltenen Abbildungen wurden erstmals im Journal „Acta Biomaterialia“ publiziert und freundlicherweise für die Wiederverwendung zur Verfügung gestellt. Ghanaati, S.; Barbeck, M.; Hilbig, U.; Hoffmann, C.; Unger, R. E.; Sader, R. A. et al. (2011): An injectable bone substitute composed of beta-tricalcium phosphate granules, methylcellulose and hyaluronic acid inhibits connective tissue influx into its implantation bed in vivo. In: Acta Biomater 7 (11), S. 4018–4028.
Autoren: Dr. Jonas Lorenz, Mike Barbeck, MSc, Dr. Markus Schlee, Dr. Henriette Lerner, Anna Teiler, Prof. Dr. Dr. Robert A. Sader, Priv.-Doz. Dr. Dr. Shahram Ghanaati






















