Laserzahnmedizin 04.06.2014
Dekontamination biofilmbesiedelter Implantatoberflächen
share
Periimplantäre Infektionen stellen einen zunehmenden Fokus im zahnärztlichen Praxisalltag dar. So finden sich periimplantäre Mukositiden in bis zu 80 % der Patienten sowie an bis zu 50 % der untersuchten Implantate.1 Manifeste Periimplantitiden sind in einem Nachuntersuchungszeitraum von fünf Jahren nach Insertion in bis zu 56 % der Patienten und immerhin noch an bis zu 43 % der untersuchten Implantate feststellbar.2 Der primäre Faktor für die Entstehung periimplantärer Entzündungen ist die Anlagerung von Biofilm an Implantatstrukturen.3 Die Therapie periimplantärer Infektionen ist dementsprechend zielgerichtet auf die Dekontamination der biofilmbesiedelten Implantatoberflächen.4 Verschiedene Methoden werden zur Oberflächendekontamination von zahnärztlichen Implantaten eingesetzt. Dabei setzen die meisten Methoden auf eine mechanische Entfernung der pathogenen Bakterien, wobei die Mikroorganismen vor allem in verbleibenden residualen Biofilmen primär nicht abgetötet werden. Gerade auf rauen Implantatoberflächen ist der alleinige Einsatz von konventionellen, mechanischen Dekontaminationsmethoden wie Küretten uneffektiv.5 Es gibt einige Therapieansätze, die direkt eine bakterizide Wirkung haben. Hierzu zählen beispielsweise Laserbehandlungen. Eine vielversprechende Variante ist der Einsatz der photodynamischen Therapie.6 Hierbei werden Farbstoffe, sogenannte Photosensitizer, eingesetzt, die aufgrund ihrer elektrischen Ladung schnell und gut an Bakterienzellwände binden oder in Bakterien penetrieren können, währenddessen sie eine geringe Toxizität gegenüber oralen Hart- und Weichgeweben aufweisen7, 8 und unter Lichtaktivierung bakterizide Wirkung entfalten, meist in Form von Freisetzung von Sauerstoffradikalen und Singulett-Sauerstoff.9 Ziel der aktuellen Studie war die Evaluation der Effektivität der Oberflächendekontamination biofilmbesiedelter Implantatoberflächen mittels einer neuen photodynamischen Therapie mit einer LED-Lampe.
Material und Methoden
Studienteilnehmer
Die Studie wurde von der Ethikkommission der Heinrich-Heine-Universität Düsseldorf geprüft (Studie: 3.268) und nach Erhalt des positiven Ethikvotums mit der Probandenrekrutierung begonnen. Fünf freiwillige Probanden erhielten eine umfassende Aufklärung über den Studienablauf und mussten vor Beginn der Studie eine Einverständniserklärung unterschreiben. Als Einschlusskriterien wurden festgelegt:
1. Die Probanden sollten eine gute Mundhygiene mit einem geringen Plaqueindex, PI<1, aufweisen.
2. Die umgebenden Weichgewebe der Probanden sollten entzündungsfrei sein, PSI≤2.
3. Die Probanden sollten innerhalb der letzten sechs Monate keine systemische Antibiotikatherapie erhalten haben. Falls innerhalb des Studienablaufes eine anitibiotische Therapie notwendig sein sollte, führte dies automatisch zum sofortigen Studienausschluss.
4. Sämtliche Probanden sollten Nichtraucher sein.
Schienendesign und Probekörper
Für die Biofilmsammlung wurden spezielle Kunststoffschienen angefertigt, in denen jeweils vier Probekörper, welche auf einer Seite mit einer handelsüblichen gestrahlten und säuregeätzten Oberfläche (SLA, Institut Straumann AG, Basel, Schweiz, mit Ra 3,22 ± 0,88 μm) integriert wurden. Die Probekörper hatten einen Durchmesser von 15 mm bei einer Dicke von einem Millimeter. Zusätzlich wurden die Plättchen an der Unterseite mit Cyanoacrylatkleber (Loctide 496, Henkel, Düsseldorf, Deutschland) gesichert. Das Design der Schiene wurde so ausgerichtet, dass die Plättchen einen Abstand von circa einem Millimeter zur Gaumenschleimhaut hatten. So war eine feuchte und nährstoffreiche Umgebung für die Probekörper sichergestellt. Die Biofilmsammlung wurde über eine Zeitdauer von 48 Stunden festgelegt. In dieser Zeit sollten die Probanden ihre alltäglichen Ernährungsgewohnheiten beibehalten und wurden darauf hingewiesen, die Zahnreinigung ausschließlich mechanisch, ohne Hilfsmittel wie Mundspüllösungen oder Zahnpasten, durchzuführen. Zur Kontrolle der Biofilmbesiedelung wurde pro Schiene jeweils ein Probekörper entfernt und mit Erythrosin (Erythrosin B, Certistain, Merck KGaA, Darmstadt, Deutschland) angefärbt. Danach wurden die Probekörper unter Benutzung eines Stereomikroskops (SZ61, Olympus Europa Holding GmbH, Hamburg, Deutschland) und einer digitalen Kamera (Color View III, Olympus Europa Holding GmbH, Hamburg, Deutschland) in einer achtfachen Vergrößerung fotografiert. Lediglich Plättchen von Schienen, auf denen die Kontrollplättchen eine vollständige und homogene Biofilmbesiedelung aufwiesen, wurden in die Studie eingeschlossen.
Durchführung der Oberflächenbehandlung
Nach Ende der Tragezeit wurden die Schienen direkt beim Untersucher zur weiteren Behandlung abgegeben. Die Plättchen wurden von den Schienen entfernt, vorsichtig mit steriler Kochsalzlösung (NaCl) gespült und anschließend in Kochsalz kurz zwischengelagert. In die Untersuchungen ging eine Gesamtanzahl von 48 Probekörpern ein. Diese wurden unter Verwendung einer speziellen Randomisierungssoftware (Randlist, Datinf GmbH, Tübingen, Deutschland) folgenden vier Gruppen randomisiert zugeteilt.
1. Diodenlaserapplikation über 60 Sek. (Diode 60)
2. Photo Activated Disinfection über 60 Sek. (PAD 60)
3. Photo Activated Disinfection über 30 Sek. (PAD 30)
4. Kontrollgruppe ohne Behandlung
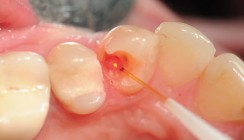
Während der Durchführung der Oberflächenbearbeitung wurde die Probekörperoberfläche in NaCl gelagert, um eine Austrocknung der Oberfläche und somit Artefakte zu verhindern. Um eine gleichmäßige und vollständige Oberflächenbehandlung sicherzustellen, wurde der Diodenlaser (GENTLEray 980 Diodenlaser, KaVo Dental GmbH, Biberach an der Riß, Deutschland) beziehungsweise das PADPLUS-Gerät (PADPLUS, orangedental GmbH & Co. KG, Biberach an der Riß, Deutschland) 60 Sekunden, im Falle der PAD 30-Gruppe 30 Sekunden, kreisförmig vom Zentrum beginnend gleichmäßig nach außen geführt. Der Diodenlaser wurde mit einer gepulsten Einstellung mit einer Endleistung von 0,8 Watt angewendet. Vor Anwendung der PADPLUS (Abb. 1 und 2) musste der Farbstoff auf Toloniumchloridbasis (P.A.D viscous solution, Denfotex Research Ltd, Inverkeithing, Schottland) appliziert werden, der eine Minute Einwirkzeit hatte und danach mit NaCl abgespült wurde. Anschließend wurde das PADPLUS-Gerät für 30 beziehungsweise 60 Sekunden aktiviert. Die Kontrollgruppe wurde bis zur Bestimmung der Biofilmaktivität in NaCl gelagert und erfuhr keine weitere Oberflächenbehandlung.
Messung der Biofilmviabilität
Die Biofilmviabilität wurde mittels eines Lumineszenzassays (CellTiter-Glo®, Promega, Mannheim, Deutschland) bestimmt, der die Menge an vorhandenem ATP misst. Diese Menge an ATP ist direkt proportional zur Bakterienanzahl. Das Signal wird in einem Luminometer (Victor 2030, PerkinElmer, Rodgau, Deutschland) in Impulsen pro Sekunde (CPS, Counts Per Second) gemessen.
Live/Dead-Färbung
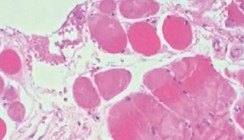
Zur Veranschaulichung der Wirkung der einzelnen Oberflächenbehandlungen wurden drei Plättchen pro Gruppe zusätzlich zu den oben genannten Plättchen getragen und für die Durchführung einer Lebend-/TotFärbung genutzt (FilmTracer™ LIVE/DEAD® Biofilm Viability Kit, Invitrogen Ltd., Paisley, England). Unmittelbar nach der Färbeprozedur wurden die Probekörper mittels eines Mikroskops (Eclipse TS 100-F, Nikon Instruments Europe PV, Amsterdam, Niederlande) und einer Digitalkamera (DP 25, Olympus Europa Holding GmbH, Hamburg, Deutschland) fotografiert und die Aufnahmen deskriptiv ausgewertet.
Statistik
Die statistische Analyse der Daten wurde mit einem Statistikprogramm durchgeführt (SPSS 21, IBM Deutschland GmbH, Ehningen, Deutschland). Es wurden die Mittelwerte mit den dazugehörigen Standardabweichungen und die Mediane für die einzelnen Gruppen berechnet. Innerhalb der Gruppen wurde mittels Shapiro-Wilk-Test und Kolmogorow-Smirnow-Test auf Normalverteilung getestet. Die Varianzgleichheit wurde mittels Levene-Test geprüft. Ein Vergleich der Mittelwerte erfolgte mittels Durchführung einer Varianzanalyse, wobei mittels Post-hoc-Testung mit Tamhane T2-Testung auf signifikante Unterschiede geprüft wurde, p<0,05.
Ergebnisse
Biofilmviabilität
Die höchste mittlere Viabilität konnte in der Kontrollgruppe ohne Behandlung festgestellt werden:
(407,3 ± 99,1 CPS; Median: 400 CPS), gefolgt von Diode 60 (226,5 ± 60,7 CPS; Median: 218 CPS), PAD 30 (222,2 ± 21,0 CPS; Median: 220 CPS) und PAD 60 (178,2 ± 60,1 CPS; Median: 162 CPS) (Abb. 3). Die mittlere Viabilität der Kontrollgruppe war signifikant höher als die sämtlicher Testgruppen, P<0,05. Zwischen den einzelnen Testgruppen konnten keine signifikanten Unterschiede festgestellt werden, P<0,05.
Live/Dead-Färbung
Auf sämtlichen Probekörpern konnte Biofilm angefärbt und nachgewiesen werden. Auch in den Testgruppen war eine nahezu vollständige Bedeckung der Plättchenoberflächen mit Biofilm auffällig. Es konnten keine offensichtlichen Unterschiede bezüglich der Biofilmquantität festgestellt werden. Die Beschaffenheit des Biofilms war ebenfalls in allen Gruppen vergleichbar, es waren sowohl gröbere als auch feine Debris feststellbar. Bezüglich der Biofilmqualität konnten deutliche Unterschiede festgestellt werden. In der Kontrollgruppe stellte sich der Biofilm fast ausschließlich grün dar, lediglich mit vereinzelt eingesprengten rötlichen Arealen. Die Plättchen, die mit dem Diodenlaser behandelt wurden, wiesen bereits mehr rötlich angefärbte Areale als die Kontrollgruppe auf, wobei diese Flächen deutlich geringer waren als in beiden Anwendungen, die mit PADPLUS durchgeführt wurden, wobei hierbei in der 60-Sekunden-Gruppe ein auffällig hoher Anteil rot gefärbter Areale nachgewiesen werden konnte (Abb. 4).
Diskussion
Das Design der aktuellen Studie wurde ausgewählt, um den Effekt der PAD an natürlichem Biofilm zu testen. Daher wurden im Gegensatz zu anderen Studien nicht nur Biofilme, die aus vereinzelten Bakterienstämmen gezüchtet wurden, eingesetzt.10 –12 Um die natürliche Situation bestmöglich zu imitieren, wurde das Design an vorige Studien unserer Arbeitsgruppe angelehnt.13,14 Nach 48 Stunden Tragezeit konnten auf den Titanprobekörpern homogene, reife initiale Biofilme nachgewiesen werden, was im Einklang zu vorangegangenen Studien steht, in denen eine fast vollständige Biofilmbesiedelung nach 24 Stunden Tragezeit13 und eine komplette Biofilmbesiedelung nach 48 Stunden auf rauen Implantatoberflächen nachgewiesen werden konnte.14 Die Ergebnisse der aktuellen Studie konnten aufzeigen, dass die drei getesteten Gruppen die Biofilme in ihrer Aktivität reduzieren. Sowohl durch die Behandlung mit dem Diodenlaser für 60 Sek. (226,5 ± 60,7 CPS) als auch die Behandlung mit PAD für 30 Sek. (222,2 ± 21,0 CPS) beziehungsweise 60 Sek. (178,2 ± 60,1 CPS) wurde die Viabilität im Biofilm signifikant gegenüber der unbehandelten Kontrollgruppe verringert. Zwischen den einzelnen Gruppen konnten keine signifikanten Unterschiede festgestellt werden. Diese Ergebnisse wurden mittels Live/Dead-Färbung bestätigt, indem in den drei Testgruppen jeweils rötliche Bereiche nachgewiesen werden konnten. Die Tendenz, dass PAD 30 und PAD 60 die Biofilme stärker inaktivieren als Diode 60, konnte durch die Live/Dead-Färbung stärker visualisiert werden, als die reinen Zahlen der Viabilitätstestung vermuten ließen. Die Wirksamkeit eines Diodenlasers zur Dekontamination von Implantatoberflächen ist bekannt.15,16 Streptococcus sanguis konnte auf Titanoberflächen mittels Diodenlaser (810 nm Wellenlänge) bei Applikation einer Leistung von 3 W um mehr als vier Log-Stufen reduziert werden. Eine Applikation von einer Leistung von 1 W führte zu einer Reduktion um zwei Log-Stufen. Porphyromonas gingivalis hingegen konnte sowohl durch Applikation von einer Leistung von 3 W als auch 1 W effektiv reduziert werden.15 Dieser Versuchsaufbau lässt sich nur schwer mit dem der aktuellen Studie vergleichen, obwohl beide die effektive Wirkung des Diodenlasers nachweisen konnten. In der vorangegangen Studie wurden lediglich die Einflüsse auf einzelne Bakterienstämme untersucht. Die aktuelle Studie konnte hingegen die Wirkung in einem reifen, initialen Biofilm belegen, was eine deutlich höhere Herausforderung an eine Therapie darstellt und der natürlichen klinischen Situation näher steht als Untersuchungen an ausgewählten Bakterienspezies, die lediglich für wenige Stunden adhärent auf Implantatoberflächen wuchsen. Bereits in einer klinischen Studie wurde im Split-Mouth-Verfahren die Effektivität von Scaling und Root Planing (SRP) ohne versus SRP in Kombination mit PADPLUS-Therapie getestet. Hierbei wurden signifikant geringere Werte für Bleeding on Probing eine Woche sowie drei Monate nach Behandlung festgestellt. Auch die anfangs der Studie gleichwertigen Taschentiefen waren drei Monate nach Therapie signifikant geringer in der PADPLUS-Gruppe als in der Gruppe mit alleinigem SRP.17 Die klinische Effektivität wurde damit belegt. Doch nicht nur die Effektivität der Therapien ist entscheidend. Ein weiterer wichtiger Aspekt, gerade für den klinischen Anwender, könnte sein, dass die PAD-Gruppe bereits bei halber Anwendungszeit der Diodenlasergruppe ein vergleichbares, sogar ein tendenziell etwas besseres Ergebnis in der aktuellen Studie aufzeigte. Dies könnte ein Anzeichen sein, dass die PAD nicht nur leicht effektiver im initialen Biofilm ist als die Diodenlaseranwendung, sondern auch effizienter.
Schlussfolgerung
Die präklinische Studie konnte zeigen, dass sowohl die Diodenlaseranwendung als auch die PAD-Therapie effektive Methoden darstellen, um Bakterienviabilitäten im reifen, initialen Biofilm auf Titanimplantatoberflächen zu reduzieren. Die Ergebnisse zeigten weiterhin, dass selbst unter optimalen Laborbedingungen die Mikroorganismen im Biofilm jedoch nur teilweise inaktivert werden können. Für die klinische Anwendung deuten diese Ergebnisse darauf hin, dass alle getesteten Verfahren die mechanische Biofilmentfernung unterstützen können, wobei die PAD-Therapie mit einer Einwirkzeit von 30 Sekunden hierbei effizienter als die Diodenlaseranwendung erschien.
Hier geht's zur Literaturliste.












 Proto-Cam® Smart
Proto-Cam® Smart  Patientenbrille P07.P1P11.1001
Patientenbrille P07.P1P11.1001  Laserschutz-Lupenbrille F27P1M03
Laserschutz-Lupenbrille F27P1M03  IPL-Brille F22P5L04 für Behandlungspersonal
IPL-Brille F22P5L04 für Behandlungspersonal  F18P1C02 für Dentallaser Anwendungen
F18P1C02 für Dentallaser Anwendungen  WaterLase MDX
WaterLase MDX  Waterlase Epic X
Waterlase Epic X  Waterlase Express
Waterlase Express  Maskensystem Axess™
Maskensystem Axess™  Accutron-Doppelmaskensystem seda-view®
Accutron-Doppelmaskensystem seda-view®